Gases color violeta: la importancia del yodo Understand article
Traducción de Elisa López Schiaffino. El yodo, con su característico vapor de color violeta, tiene miles de usos, desde la conocida función desinfectante hasta su empleo en innovadoras células solares.

Imagen cortesía de Eleanor A.
Merritt
¿Por qué el yodo es tan importante e interesante? Además de sublimarse y convertirse en un espectacular gas violeta, también influye en muchos aspectos de la civilización humana y de la vida en la Tierra. ¿Sabía que, por ejemplo, el yodo protege a las algas marinas del daño por oxidación (por ejemplo el ocasionado por el sol), previene algunas anormalidades congénitas en los seres humanos, y tiene muchos usos industriales?
El descubrimiento del yodo se remonta al siglo XIX y a las guerras napoleónicas. Como los británicos habían impuesto un bloqueo sobre los puertos europeos, los franceses se vieron ante la escasez de salitre (KNO3) para la fabricación de pólvora. Entonces, el químico Bernard Courtois investigó si las algas pardas (Laminaria sp.) podían constituir una fuente de potasio para fabricar esta importante sustancia. Agregó ácido sulfúrico concentrado a la ceniza de las algas y quedó maravillado por los hermosos gases violetas que se produjeron.

Gay-Lussac, físico y químico
francés, realizado por el
artista François Séraphin
Delpech (1778–1825).
Imagen de dominio público /
Wikimedia Commons
Aunque Courtois sospechaba que el vapor violeta era un elemento nuevo, no tuvo los recursos financieros para continuar con su investigación. Esa tarea pasó a sus colegas, incluido Jaseph Gay-Lussac, quienes confirmaron los resultados y nombraron al elemento yodo, de la palabra de origen griego iodes, que significa púrpura o violeta.
Gay-Lussac procedió a investigar la química del yodo y, a pesar de la guerra, los químicos franceses encontraron la manera de comunicarse con los químicos británicos, en particular con sir Humphry Davy. En un comienzo, Davy creía que el vapor era un compuesto del cloro, pero pronto llegó a la conclusión de que era en realidad un elemento nuevo.

algas pardas, como por
ejemplo el quelpo, son las
que más yodo acumulan.
Fotografía tomada en la orilla
de Dunstaffnage, cerca de
Oban, Escocia (Reino Unido).
Imagen cortesía de FCK
Gracias a la espectroscopia de absorción de rayos X, ahora sabemos que las algas (véase la figura 2) acumulan yodo en forma de ion yoduro (I–), que actúa como antioxidante para proteger a las algas del daño por oxidación que causa el ozono atmosférico (O3). Esto explica en cierto modo por qué se detectan rastros de yodo molecular (I2) en la atmósfera de zonas costeras y por qué el consumo humano de yodo en estas zonas depende de la abundancia de algas en vez de la cercanía al mar.
Durante la mayor parte del siglo siguiente, el yodo continuó extrayéndose de las algas. Hoy, sin embargo, se obtiene de la salmuera que contiene yodo en los yacimientos de gas y petróleo de Japón y los Estados Unidos, o de los caliches de Chile (minerales nitratos) que contienen yodato de calcio (Ca(IO3)2). El yodo se comercializa en el mercado como un sólido negro violáceo.
La química del yodo
El yodo forma parte del grupo de los halógenos, y por eso comparte varias de las características propias de los elementos de este grupo. Debido a su alta electronegatividad, el yodo forma yoduros con la mayoría de los elementos en su estado de oxidación formal, -1. Muchos compuestos que contienen yodo se usan con frecuencia como reactivos en la síntesis orgánica, principalmente para la yodación, la oxidación y la formación de enlaces C-C.
En general, el yodo en la atmósfera se origina a partir de procesos biológicos y químicos en el océano, por ejemplo el sistema antioxidante de yoduro en las algas. La mayoría del yodo desaparece de la atmósfera al formarse nubes. En el océano, el yodo se disuelve y existe en forma de yodato (IO3–, forma oxidada) y yoduro (I–, forma reducida). En la capa exterior de la Tierra (la litósfera), la mayoría del yodo está en los sedimentos marinos y terrestres; el nivel de yodo es bajo en las rocas ígneas.
La importancia fisiológica del yodo
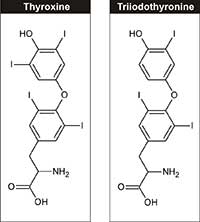
tiroxina (T4) y
triyodotironina (T3).
Imagen cortesía de Michael
Zimmermann
Fisiológicamente, el yodo es un elemento esencial, necesario para la síntesis de las hormonas tiroideas (triyodotironina y tiroxina, véase la figura 3) que regulan el crecimiento, el desarrollo y el metabolismo celular. La ingesta diaria recomendada de yodo para los adultos es de 150 µg/día, que puede obtenerse de los productos lácteos, las algas y la sal de mesa yodada.
El síntoma clásico de la deficiencia de yodo es el aumento de tamaño de la glándula tiroides (bocio). A medida que la ingesta de yodo disminuye, la glándula pituitaria anterior segrega mayores niveles de la hormona que estimula a la tiroides para intentar maximizar el consumo de yodo disponible, lo que lleva al crecimiento excesivo de la glándula tiroides.
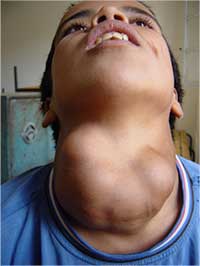
bocio, causado por una
deficiencia de yodo.
Imagen cortesía de Michael
Zimmermann
Pero el efecto más dañino de la falta de yodo ocurre en el cerebro en desarrollo de los bebés, y puede ocasionar retardo mental. Además, la deficiencia severa de yodo durante el embarazo está asociada a una mayor incidencia de mortinato, aborto y anormalidades congénitas.
La manera más efectiva de prevenir la deficiencia de yodo es agregar yoduro de potasio (KI) o yodato de potasio (KIO3) a la sal de mesa. La práctica de la yodación de la sal se lleva a cabo en alrededor de 120 países, y ahora más del 70 % de la población mundial tiene acceso a la sal yodada.
Los usos industriales del yodo
El yodo y sus compuestos se usan en muchos productos, desde alimentos y productos farmacéuticos hasta el forraje para el ganado y catalizadores industriales (véase la figura 4). Por ejemplo, el yodo es un potente agente antimicrobiano. Durante más de un siglo, la tintura de yodo (una mezcla de etanol, agua, yodo y yoduro de potasio) se usó como antiséptico para las heridas. Ahora se lo ha reemplazado en gran medida por ionóforos solubles en agua (yodo complejado con agentes tensioactivos), que no irritan tanto la piel. Por ejemplo, la yodopovidona, una mezcla de polivinilpirrolidona y yodo, se usa ampliamente como producto para el lavado quirúrgico.
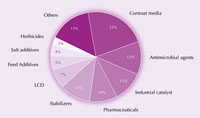
industriales del yodo. Haga
clic sobre la imagen para
ampliarla.
Imagen cortesía de Tatsuo
Kaiho
En la producción industrial de ácido acético, se usan los compuestos de yodo como el yoduro de rodio (el proceso Monsanto) o el yoduro de iridio (el proceso Cativa de BP) para catalizar la carbonilación del metanol.
El yoduro de plata (AgI), usado antiguamente para las placas fotográficas, hoy se usa en la siembra de nubes para provocar lluvias y controlar el clima. Debido a que el AgI tiene una estructura cristalina similar a la del hielo, puede causar congelamiento al proveer sitios de nucleación. Eso se hizo en los Juegos Olímpicos de 2008 en Pekín para evitar que llueva durante las ceremonias de apertura y cierre.

dos generadores de yoduro
de plata en los costados para
la siembra de nubes.
Imagen cortesía de Christian
Jansky / Wikimedia
Debido al elevado peso atómico (126,9) y al gran número de electrones, el yodo también es un excelente absorbente de rayos X y se usa en los medios de contraste de rayos X. En general, estas sustancias se suministran a las personas de manera segura y permiten la visualización de tejidos blandos en los exámenes con rayos X.
Un uso más cotidiano del yodo es en las pantallas con cristal líquido de los televisores, las computadoras y los teléfonos celulares, que usan películas polarizadoras para filtrar la luz. Estos filtros generalmente están hechos con capas de alcohol polivinílico dopado con yodo. Aquí, el yodo actúa como agente reticulante y asegura que la estructura esté polarizada.
El yodo en la industria energética

(Francia) está ubicada cerca
de una región densamente
poblada. Aproximadamente
cada cinco años se
distribuyen pastillas de
yoduro de potasio a la gente
de la zona para poder evitar
el daño a la glándula tiroides
en caso de accidente nuclear.
Imagen cortesía de
AIEA/Wikimedia
El yodo se usa en una de las células solares más prometedoras del mercado para la producción de energía ecológica de bajo costo: la célula solar de óxido de titanio sensibilizada con colorante. También se la llama célula de Grätzel (lleva el nombre de uno de los inventores), y tiene electrolitos de poliyoduro que funcionan como capa transportadora de carga entre el cátodo y el ánodo (para más información, consulte Shallcross et al., 2009).
De los 37 isótopos conocidos del yodo, todos son radioactivos, excepto uno: el 127I. La mayoría de estos radioisótopos, producidos mediante reacciones de fisión en las plantas y armas nucleares, son efímeros, característica que los convierte en agentes terapéuticos y útiles indicadores en la medicina. Por ejemplo, los isótopos del yodo pueden usarse para obtener imágenes de la glándula tiroides, que absorbe yodo radioactivo al inyectarlo en el torrente sanguíneo.
Lamentablemente, la tiroides también absorbe el yodo radioactivo 131I, liberado en los accidentes nucleares, como en el desastre en Fukushima (Japón) en 2011. Debido a que este yodo radioactivo es emisor de partículas β de alta energía, daña las células y provoca cáncer. Para contrarrestar este efecto, se pueden tomar pastillas de yoduro de potasio (KI) no radioactivo; de este modo se satura la capacidad de la tiroides de absorber yodo radioactivo.
Estos son solo algunos ejemplos de los muchos usos del yodo. Está claro que, aunque solo hace doscientos años que se conoce el elemento, está sólidamente establecido en la química moderna, la física y la medicina.
El yodo en el aula
Sin duda, todos conocemos el colorido experimento del “reloj de yodo” con peróxido de hidrógeno, yoduro de potasio, almidón y tiosulfato de sodio, pero hay otras maneras de presentar el yodo de manera práctica en el aula. Por ejemplo:
- Cuando el agua actúa como catalizador, el aluminio y el yodo reaccionan y producen espectaculares nubes de vapor de yodo color violeta.
- En una reacción directa entre un metal y un no metal, el zinc en polvo reacciona con una solución de yodo en etanol y forma yoduro de zinc; es una reacción redox exotérmica.
- El yoduro de potasio puede usarse para detectar la presencia de almidón en varios alimentos.
- Varias soluciones, como la solución acuosa de yoduro de sodio, pueden electrolizarse, y se pueden identificar los productos en los electrodos. Los estudiantes pueden usar las experiencias prácticas y sus conocimientos teóricos para construir ecuaciones iónicas simples.
Puede descargar estos experimentos escolares descriptos en detalle, y muchos otros experimentos, en el sitio web Learn Chemistryw1.
Agradecimientos
Este artículo ha sido adaptado de una publicación más extensa que se encuentra en Angewandte Chemie International Edition (Küpper et al., 2011).
References
- Küpper FC, Feiters MC, Olofsson B, Kaiho T, Yanagida S, Zimmermann MB, Carpenter LJ, Luther GW, Lu Z, Jonsson M, Kloo L (2011) Commemorating two centuries of iodine research: an interdisciplinary overview of current research. (Una conmemoración de dos siglos de investigación sobre el yodo: un panorama general interdisciplinario sobre la investigación actual). Angewandte Chemie International Edition 50: 11598-11620. doi: 10.1002/anie.201100028
- Shallcross D, Harrison T, Henshaw S, Sellou L (2009) Observando los cielos: experimentos sobre el cambio climático. Science in School 12: 34-39.
Web References
- w1 – El sitio web Learn Chemistry de la Royal Society of Chemistry (Real Sociedad de Química) del Reino Unido ofrece una amplia variedad de recursos descargables para complementar la enseñanza y el aprendizaje de la química.
Review
En esta síntesis actualizada sobre el elemento yodo, los autores guían al lector a través de la historia y de los muchos usos de este importante elemento, desde su importancia para la medicina hasta la industria y la producción energética. Las sugerencias de los experimentos en el laboratorio escolar hacen que el tema sea más interesante y atractivo.
Debido al estilo claro y sencillo, recomiendo este artículo no solo a los docentes de ciencia europeos sino también a sus estudiantes de entre 13 y 18 años. Este artículo puede usarse en las clases de química (la tabla periódica, los halógenos), biología (las glándulas endocrinas, la tiroides y las enfermedades que la afecta) y física (isótopos, radioactividad y las células solares). También brinda la posibilidad de realizar actividades interdisciplinarias: estudiar la historia de la ciencia (el descubrimiento de los elementos), el papel que desempeñaron los científicos en el desarrollo de las armas, o las relaciones entre los científicos de países enemigos durante épocas de guerra.
Se podrían plantear preguntas de comprensión como las siguientes:
- A partir de este artículo, podemos deducir que las algas acumulan yodo:
- para oxidar ozono atmosférico
- para absorber ozono atmosférico
- para producir ozono atmosférico
- para protegerse del ozono atmosférico
- Si no consumimos suficiente yodo:
- La glándula tiroides aumenta su tamaño / se atrofia
- La glándula pituitaria anterior segrega menos / más hormonas que estimulan la tiroides
Giulia Realdon, Italia





