Química y luz Understand article
Traducido por Amalia Bonilla Díaz. Peter Douglas y Mike Garley investigan cómo la química y la luz interactúan en muchos aspectos de nuestro día a día.

/ iStockphoto
Desde tiempo inmemorial, hemos utilizado la luz del sol para calentarnos durante el día y el brillo de una llama para iluminar el mundo durante la noche. En la actualidad, controlamos la interconversión de la energía para crear luz a partir de la electricidad, el calor y las reacciones químicas. Diariamente utilizamos la química y la luz en las comunicaciones, la electrónica, la medicina y la industria del entretenimiento y los especialistas en fotoquímica trabajan para lograr un futuro más limpio y brillante creando nuevas formas de convertir la luz solar en energía útil y de eliminar los contaminantes mediante la fotoquímica.
Crear luz: lámparas, láseres, LED y luz líquida
El componente esencial en el proceso de creación de luz es la interconversión de la energía. Existen diferentes tipos de lámparas y aparatos que convierten la energía de distinto modo y con distinto rendimiento.
En la lámpara de tungsteno, la energía eléctrica calienta un filamento hasta el “rojo-blanco”, convirtiendo así la energía termal en energía lumínica. La luz emitida por el filamento sólido es un espectro continuo en luz visible, como un arco iris. Por desgracia, el rendimiento con el que se crea la luz visible ronda solo entre el 5 y 10%.

Imagen cortesía de mipokcik /
iStockphoto
En las lámparas fluorescentes, la energía eléctrica se convierte en energía de excitación atómica dentro de un tubo que contiene vapor de átomos de mercurio. En este caso, el rendimiento de conversión energética dobla el de una bombilla de tungsteno. Sin embargo, el espectro de luz (cuando los electrones vuelven al estado de no excitación) no es continuo, sino que se emite en diferentes ondas de luz y colores correspondientes a los niveles de energía eléctrica de los átomos de mercurio. Por tanto, los tubos fluorescentes domésticos poseen un recubrimiento interior de fósforo blanco que convierte esta luz en un espectro más continuo. Al reemplazar el vapor de mercurio por otros grases, como el neón (que emite una luz naranja) u otros gases inertes, se posibilita la producción de lámparas fluorescentes de multitud de colores utilizadas para distintas señales y dispositivos (véase imagen). También los distintos recubrimientos de fósforo permiten cambiar el color de la luz.

reproductor de CD
Imagen cortesía de Petrovich9
/ iStockphoto
La conversión de la energía eléctrica en luz puede ser más eficiente utilizando los diodos emisores de luz (LED): la electricidad excita a los electrones del semiconductor (véase el glosario para los términos en cursiva) estructurado en capas para producir luz visible, logrando una eficiencia de conversión del 35%. El papel electroluminiscente se basa en el mismo principio. Muchos láseres utilizan energía eléctrica para generar luz láser de alta intensidad, que puede acumularse en un rayo intenso y estrecho. Los láseres de gran potencia pueden cortar metal o incluso utilizarse como bisturí en cirugía.

utiliza la técnica de la
quimioluminiscencia
Imagen de dominio público;
fuente: Wikimedia Commons
Los láseres también pueden utilizarse en las comunicaciones, en la tecnología digital, en los lectores de códigos de barras y en los lectores de discos ópticos.
La “luz líquida” depende de un tipo diferente de conversión de energía: la quimioluminiscencia, que produce una luz fría mediante reacciones químicas, como en el caso de las barritas luminosas. En la naturaleza, los gusanos de luz y las criaturas que viven en la oscuridad de las cuevas o en la profundidad de los océanos utilizan la quimioluminiscencia para iluminar tanto su interior como su exterior.
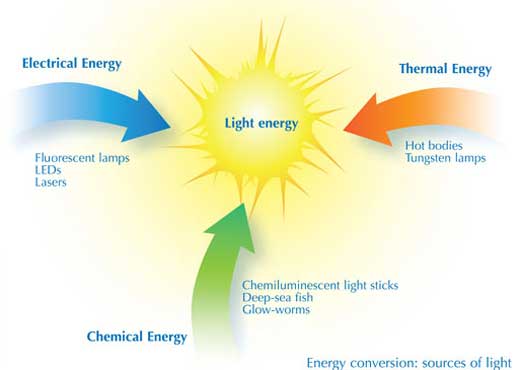
Imagen cortesía de Nicola Graf
La fotoquímica: fluorescencia, plásticos, fotografía y medicina
La fluorescencia, un tipo de emisión lumínica, se utiliza en abrillantadores ópticos y detergentes, que absorben una pequeña cantidad de luz UV invisible del espectro solar y la reemiten, luego, como luz azul, dejando la ropa “más blanca que blanca”. La fluorescencia se utiliza también en las marcas de seguridad y en los billetes, mientras que la fosforescencia (similar a la fluorescencia pero más duradera) se utiliza en las señales de seguridad. La fluorescencia, la fosforescencia y la qumioluminiscencia también se utilizan para pintura corporal luminosa, gomina, barra de labios y joyería.
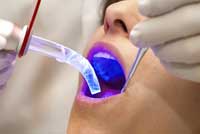
utiliza en odontología
Imagen cortesía de dem10 /
iStockphoto
La luz puede utilizarse para crear plástico. El plástico se crea mediante el proceso de polimerización: la unión de multitud de pequeñas moléculas (monómeros) para formar una molécula mayor (polímero). Para este proceso se necesita con frecuencia algún elemento con suficiente energía para que el procedimiento continúe, aunque una vez iniciado, la energía liberada en la fase de unión resulta normalmente suficiente para su desarrollo. Cuando una molécula absorbe la luz, aumenta su energía puesto que ha absorbido la energía del fotón, es decir, se ha producido una excitación molecular. En este estado, las moléculas son excelentes iniciadores del proceso de polimerización gracias a esa energía extra. Así, la luz puede usarse para convertir los monómeros líquidos en un plástico sólido. Gracias a este proceso, denominado fotopolimerización, se obtiene adhesivo dental que endurece bajo la luz UV (véase la imagen inferior), así como el fotocurado que se utiliza para estampar imágenes en una gran variedad de sustratos, como las latas de cerveza. A diferencia de la estampación convencional, la fotocurada se fija mediante la luz.

de cristal, “Bili Rubin”,
muestra cómo se utiliza la
luz para el tratamiento de la
ictericia
Imagen cortesía de Peter
Douglas
Las películas fotográficas cuentan con propiedades fotoquímicas de haluros de plata. Cuando un grano de haluro de plata absorbe un fotón de luz, se crea un átomo de plata. Es entonces cuando se procesa químicamente la película y los granos de plata metálica forman la parte negra de un negativo en blanco y negro.
El uso más conocido de la fotoquímica en la medicina es el tratamiento de la ictericia: una acumulación en el cuerpo de un pigmento amarillento, neurotóxico y liposoluble llamado bilirrubina.
La bilirrubina es un subproducto resultante de la hemólisis (descomposición de los glóbulos rojos), que se metaboliza en el hígado y se convierte en hidrosoluble para luego excretarse. Sin embargo, si el hígado está dañado o no está formado del todo, la incontrolable acumulación de bilirrubina puede ser fatídica. La exposición a la luz azul disminuye la bilirrubina mediante una transformación fotoquímica que la convierte en hidrosoluble para permitir su excreción. En la sala de prematuros del hospital, hay incubadoras con luces especiales para el tratamiento de la ictericia en bebés prematuros, que son particularmente propensos a esta enfermedad.
Otra de las aplicaciones médicas de la fotoquímica es la terapia fotodinámica como tratamiento contra el cáncer. Consiste en la inyección directa en el tumor de una sustancia coloreada con un fotoquímico concreto. Las células, preferentemente las cancerígenas, absorben la sustancia. Luego, se irradian con la luz de un láser u otra fuente y se produce un estado de excitación en las moléculas que reaccionan con oxígeno para generar químicos letales para las células cancerígenas.

Imagen cortesía de Nicola Graf
Energía limpia, planeta limpio

Imagen cortesía de narvikk /
iStockphoto
La demanda mundial de energía aumenta mientras las fuentes de energías no renovables son cada vez más limitadas. Un modo de afrontar este problema es la disminución del consumo de energía (p. ej.: con bombillas de bajo consumo). Otro, la explotación de recursos renovables como las células solares de silicona, que convierten la energía de la luz en electricidad. Las células monocristalinas originales, desarrolladas en los años 50 para dar energía a los satélites, eran muy caras. Ahora, se utilizan células policristalinas y de silicona amorfa más baratas en calculadoras o cargadores de batería, así como en instalaciones energéticas domésticas, industriales e incluso nacionales a gran escala.
En el aula, la conversión de luz solar en electricidad puede observarse en una célula de Grätzel, que emplea la fotosíntesis artificial utilizando colorantes naturales orgánicos, como por ejemplo, el de las cerezas (véase Shallcross et al., 2009).
Otro auténtico problema en el futuro será la necesidad de un combustible transportable. Aunque el hidrógeno puede generarse indirectamente de la energía solar a través de la electrolisis del agua, esta reacción es poco económica en términos energéticos. Por tanto, las investigaciones se centran principalmente en la separación directa del oxígeno y el hidrógeno del agua mediante la luz solar.
¿Cuánto más puede contribuir la química y la luz a un planeta limpio? El dióxido de titanio (TiO2) es un semiconductor con algunas propiedades fotoquímicas interesantes. Se utiliza como pigmento blanco porque dispersa la luz visible de forma efectiva y, además, absorbe la luz ultravioleta. Ya sea como pigmento o como absorbente en filtros solares, cada partícula se recubre con sílice para impedir que la superficie desnuda del TiO2 entre en contacto con el ambiente. Debe evitarse porque cuando se irradia con luz ultravioleta, las partículas de TiO2 generan químicos muy reactivos que destruyen cualquier molécula compleja de su alrededor. Este inconveniente, en apariencia, de la superficie del TiO2 se convierte ahora en provechoso para la destrucción de contaminantes, porque cuando se irradia con luz ultravioleta en solución, el dióxido de titanio destruye todo compuesto orgánico cercano a su superficie. Como resultado, los contaminantes orgánicos presentes son completamente mineralizados a dióxido de carbono, agua e iones de amonio y cloruro.
Estos ejemplos ilustran cómo estamos rodeados por la química y la luz. Forman una parte importante de nuestro mundo tecnológico y juegan un papel clave en la construcción de un futuro más limpio y brillante.
Glosario
Quimioluminiscencia: La generación de luz directamente causada por una reacción química, como p. ej. la luz de los gusanos de luz y la quimioluminiscencia de las barritas luminosas.
Electroluminiscencia: La generación directa de luz a partir de electricidad, p. ej. en las pantallas de los teléfonos móviles.
Fluorescencia: La emisión de luz asociada con la transición de un electrón de un estado excitado a un estado de baja energía en el que no tiene que cambiar su giro. Debido a esto, la emisión de luz después de la excitación se produce tan rápido que normalmente transcurren pocos nanosegundos. Por tanto, si la fuente de excitación se elimina, la fluorescencia se para a los pocos nanosegundos.
Luminiscencia: Término general para denominar a la emisión de luz.
Fosforescencia: La emisión de luz asociada con la transición de un electrón de un estado excitado a un estado de baja energía en el que no tiene que cambiar su giro. La emisión de luz se produce de forma más lenta, a veces, en una escala de tiempo de segundos en las moléculas y con frecuencia de mayor tiempo en los fósforos en estado sólido. Por tanto, si la fuente de excitación se elimina, la fosforescencia puede contemplarse en muchos casos, como p. ej. en los adhesivos fosforescentes o en la luminiscencia del fósforo de un tubo fosforescente emitida inmediatamente después de apagar la luz.
Terapia fotodinámica: Procedimiento médico en que la luz se utiliza para destruir tumores en tratamiento contra el cáncer.
Fotopolimerización: El proceso por el que la luz se utiliza para crear un polímero a partir de moléculas monoméricas. La fotopolimerización se utiliza en el fotocurado, la tinta y los pegamentos. Los adhesivos de fotocurado son comunes en odontología.
Semiconductor: Para el propósito de este artículo, el rasgo más importante de un semiconductor es la distribución de los niveles de energía eléctrica en dos bandas: una banda de valencia llena de energía baja y una banda de conducción vacía de más alta energía. La excitación provoca que un electrón salte de la banda de valencia a la de conducción dejando un hueco. Tanto el hueco como el electrón son móviles y pueden migrar a la superficie del semiconductor donde pueden actuar como oxidante y reductor, respectivamente, en la destrucción de contaminantes.
El London International Youth Science Forum
La base de este artículo fue una conferencia del Dr. Peter Douglas y del Dr. Mike Garley sobre el uso de la química y la luz en nuestro día a día. La conferencia se llevó a cabo en la London Internacional Youth Science Forum de 2009 a la que asistieron 250 estudiantes de 40 países.
En el foro de 2010, el Dr. Douglas explorará los progresos científicos del futuro de la mano de destacados científicos, dignatarios y pioneros en la industria. Un elemento clave del programa es la oportunidad que se brinda para visitar las instalaciones industriales, centros de investigación, instituciones y organizaciones científicas, además de laboratorios de calidad mundial. Para más información sobre cómo pueden participar los estudiantes, consulte: www.liysf.org.uk
References
- Shallcross D et al. (2009) Observando los cielos: experimentos sobre el cambio climático. Science in School 12. www.scienceinschool.org/2009/issue12/climate/spanish
Resources
-
Para una comparación de los espectros de diferentes fuentes de luz y la construcción de su propio espectrómetro, consulteWestra MT (2007) Una mirada nueva a la luz: construye tu propio espectrómetro. Science in School 4. www.scienceinschool.org/2007/issue4/spectrometer/spanish
Review
Hay más luz de la que podemos ver. La utilización de la luz se extiende a todos los aspectos de la ciencia, desde la iluminación hasta la rotura del plástico. Este artículo ofrece una visión general de los prácticos usos de la luz y una interesante lectura de referencia para estudiantes que investigan la luz como fuente de energía.
Andrew Galea, Malta





