Supporting materials
Cómo preparar el proceso de fermentación (Word)
Cómo preparar el proceso de fermentación (Pdf)
Download
Download this article as a PDF

Traducido por los Alumnos del Máster de Traducción (Universidad de Zaragoza). Más de la mitad del vino mundial se produce (y buena parte también se bebe) en Europa. Con estas actividades prácticas, descubriremos que tras el vino perfecto se oculta una buena dosis de ciencia.

Aunque la edad legal para beber alcohol varía de un país a otro, la mayoría de los educadores coinciden en que beber vino en clase de química resulta improcedente, además de potencialmente peligroso. Sin embargo, producir y analizar vino en clase puede ser divertido y didáctico. Estas actividades, desarrolladas en el centro científico Experimentaw1, invitan a los estudiantes de entre 15 y 18 años a convertirse en vinicultores por un día a través de la aplicación de técnicas de análisis que exploran los cambios producidos durante el proceso elaboración del vino.
El vino se produce por la fermentación del zumo de uva (que presenta unos niveles particularmente altos de azúcares) gracias a unas levaduras especializadas. En condiciones anaeróbicas, los azúcares se convierten en etanol y dióxido de carbono:
C6H12O6 + 2 ADP + 2 Pi = 2 C2H5OH + 2 CO2 + 2 ATP
Con sede en Heilbronn, Experimentaw1 es el mayor centro científico de aprendizaje informal e interactivo del sur de Alemania. Además de exposiciones interactivas y del jardín de la ciencia, Experimenta ofrece más de 30 programas de laboratorio para grupos escolares o alumnos individuales, desde educación infantil hasta secundaria. Estos programas abarcan todas las ciencias naturales y la tecnología, además de facilitar formación para los educadores.

Los tres factores principales que determinan la calidad del producto final son el dulzor, la graduación alcohólica y la acidez. Mediante el empleo de técnicas convencionales de los laboratorios de vino comercial, estas tres actividades creadas para el laboratorio escolar exploran de qué manera la calidad del zumo de uva del que partimos y la del mosto (zumo de uva en fermentación) afectan al producto final. Cada actividad dura entre 20 y 30 minutos.


Otras cuatro actividades que puedes descargarw2:
Para obtener el mosto necesario en estos experimentos, solo hay que hacer fermentar previamente el zumo de uva, durante al menos un día. El zumo de uva, preferentemente tinta, puede comprarse en el supermercado. También se necesitará material de laboratorio básico, además de un vinómetro para medir el contenido de alcohol, un picnómetro (también conocido como botella de gravedad específica) y un refractómetro. Puedes descargar las instrucciones sobre cómo preparar la fermentaciónw2.

El dulzor del vino está determinado por la cantidad de azúcares que permanecen tras la fermentación, junto con su grado de acidez. Un vino seco contiene menos de 9 g/l de azúcares y tiene un grado de acidez al menos 2 g/l más bajo que el contenido de azúcares. Un vino semiseco tiene un contenido de azúcares de entre 9 y 18 g/l y un grado de acidez que no debe estar a más de 10 g/l por debajo del contenido de azúcares. Un vino dulce tiene entre 18 y 45 g/l de azúcares. Para garantizar un equilibrio adecuado entre azúcares, acidez y alcohol en el vino resultante, es importante determinar la concentración inicial de azúcares. En caso necesario, se pueden añadir cantidades controladas de azúcar antes de la fermentación.
La mayor densidad del mosto en comparación con el agua se debe principalmente a los azúcares fermentables. Las mediciones de la densidad o la refractometría pueden utilizarse para medir el contenido de azúcares. En Alemania, esto se expresa como «peso del mosto» y se mide en grados Oechsle (°Oe). En el mundo anglosajón, el contenido de azúcares se expresa en grados Brix (°Bx), y representa la concentración de azúcares disueltos en relación al peso (% en peso).
El peso del mosto se calcula de la siguiente manera:
Peso del mosto = (densidad – 1) x 1000
Donde el peso del mosto se mide en °Oe y la densidad en g/l.
Aproximadamente, 1 °Oe equivale a 2,37 g/l de azúcares (es decir, unos 0,237 °Bx o 0,132 °Bé). Por lo tanto, la concentración de azúcares será:
Concentración de azúcares = peso del mosto x 2,37
Donde la concentración de azúcares se mide en g/l.
La fermentación de todos los azúcares en una solución de 100 °Oe (concentración de azúcares de 237 g/l o 23,7 °Bx) genera aproximadamente 100 g/l de etanol (o 10 % en peso de alcohol). Como el etanol tiene una densidad de 0,79 g/ml, esto da un 12,67 % en volumen de etanol. Por lo tanto:
Concentración de alcohol (en % en volumen) = concentración de alcohol (en g/l) x 0,1267
La cantidad de azúcares en el zumo de uva determinará tanto el contenido de alcohol como el dulzor final del vino. En esta actividad, tendrás que utilizar el índice de refracción para valorar el contenido de azúcares.
La refracción es el cambio de dirección de la luz cuando pasa de un medio a otro (p. ej., del aire al agua). Esta tendencia de las disoluciones a desviar un haz de luz cambia a medida que aumenta la concentración de soluto (sustancias disueltas). Un refractómetro utiliza este principio para determinar la concentración de soluto en una disolución. En el vino, se trata fundamentalmente de sacarosa.
La mayoría de los refractómetros portátiles leen la concentración de sustancias disueltas tanto en grados Brix (°Bx), una escala graduada en función del contenido de sacarosa, como en grados Oechsle (°Oe). Una solución acuosa al 20 % en peso de sacarosa tiene 20 °Bx. El grado Oechsle puede transformarse aproximadamente en grado Brix si se multiplica por 0,237.

| Sacarosa al 20 % en peso | Zumo de uva | |
|---|---|---|
| Peso del mosto (°Oe) | ||
| Concentración de azúcares (°Bx) | ||
| Producción de alcohol estimada (% en volumen) |
La cantidad de alcohol que se obtiene durante la fermentación depende del contenido de azúcares del zumo de uva y la tolerancia al alcohol de la cepa de levadura. La mayoría de cepas toleran hasta un 16 % de alcohol. La cantidad de alcohol se puede medir con bastante exactitud mediante el empleo de un vinómetro, un aparato muy sencillo destinado a vinicultores aficionados. Se basa en el principio de que la tensión superficial decrece conforme aumenta el contenido de alcohol.
En esta actividad, medirás el contenido de alcohol del mosto.
| Contenido de alcohol (% vol.) | |
|---|---|
| Mosto (filtrado) | |
| Vino |
Nota: Probablemente, el contenido de alcohol del mosto sea mucho menor que el del vino. Esto puede deberse a que el proceso de fermentación no ha concluido. También puede indicar que los azúcares residuales han hecho aumentar la tensión superficial del líquido, lo que influye en la medición.

Los zumos de fruta pueden contener porcentajes variados de diferentes tipos de ácido, como el tartárico, málico, cítrico u oxálico, según el tipo de fruta de que se trate. En el vino predomina el ácido tartárico, cuyo pH oscila entre 3 y 4. Sin embargo, la compleja mezcla de distintos ácidos, bases, proteínas y sales hace que no se pueda estimar el contenido de ácido total mediante una simple medición del pH. En vez de ello, se determina mediante una titulación en la que se neutraliza el reactivo y se expresa como la cantidad total equivalente de ácido tartárico en g/l. El contenido de ácido en el vino suele ser entre 4 y 8,5 g/l, pero puede alcanzar los 15 g/l. Siempre hay que relacionarlo con la cantidad de azúcares que permanecen en el vino (ver «Determinar el contenido de azúcares»).
El ácido tartárico (cuya masa molecular es de 150 g/mol) es un ácido diprótico (es decir: contiene dos átomos de hidrógeno por molécula que pueden disociarse en el agua en forma de protones). Este ácido puede neutralizarse con hidróxido sódico. Como 1 mol de NaOH neutraliza 0,5 moles de ácido tartárico (75 g), 1 ml de disolución 0,1 M de NaOH neutralizará 7,5 mg de ácido tartárico.
HOOC-CH(OH)-CH(OH)-COOH + 2NaOH → Na+-OOC-CH(OH)-CH(OH)-COO– Na+ + 2H2O
Todos los vinos contienen una cierta cantidad de ácido. A los vinicultores les preocupa la acidez total, producida principalmente por el ácido tartárico. La acidez total se determina mediante una titulación con hidróxido sódico diluido.
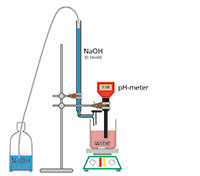
Para cada muestra (mosto o vino):
Ejemplo: Hemos usado 14 ml 0,1 M de NaOH para neutralizar 10 ml de solución. Por lo tanto, la concentración de ácido es (14 x 7,5 mg/ml x 100) = 10,5 g/l.
| Mosto | Vino | |
|---|---|---|
| pH inicial | ||
| Volumen inicial de NaOH (ml) | ||
| Volumen final de NaOH (ml) | ||
| Volumen de NaOH empleado (ml) | ||
| Concentración de ácido (g/l) |
Utiliza gafas y guantes protectores. Lee también la advertencia general de seguridad.

Durante las actividades 1 a 3, has analizado los tres factores más importantes que determinan la calidad final del vino: dulzor, grado alcohólico y acidez. Ahora ha llegado el momento de evaluar el producto.
El autor desea agradecer al laboratorio vinícola Pfäffle GmbH de Heilbronn, en Alemania, el apoyo prestado durante el desarrollo de estas actividades. También le gustaría agradecer de forma especial la colaboración de Christine Dietrich y Karsten Wiese, del centro de formación del profesorado de Heilbronn.
Schmitt A (1975) Aktuelle Weinanalytik, Ein Leitfaden für die Praxis. Germany: Heller Chemie. ISBN: 978-3-9800498-3-2
Cómo preparar el proceso de fermentación (Word)
Cómo preparar el proceso de fermentación (Pdf)
Download this article as a PDF