Pintando en verde: GFP Understand article
Traducido por Mónica González. Medusas, detectores de arsénico y un Premio Nobel: Sonia Furtado comenta el hallazgo la proteína verde fluorescente y, entrevista a científicos del Laboratorio Europeo de Biología Molecular (EMBL) en Heidelberg, Alemania, para conocer sus aplicaciones.
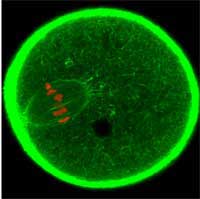
división. GFP se usa para
marcaje de citoesqueleto
celular en verde y,
cromosomas, en rojo
Imagen cortesía de Jan
Ellenberg / EMBL
Todo comienza con la medusa Aequorea victoria y su anillo marginal de bioluminiscencia verde, que aparece en ciertas condiciones; esta peculiaridad, descrita por primera vez en 1955, protagonizó el Premio Nobel de Químicaw1 en 2008. En el origen, un solo “agente”: la proteína verde fluorescente, GFP.
A principios de los 60s Osamu Shimomura descubrió la acuorina, proteína de medusa que brilla en presencia de calcio. La acuorina emite luz azul, mientras que la medusa brilla en verde; ¿ por qué? Shimomura explicó que GFP absorbe la emisión de la acuorina, ocurre una reacción y, como resultado final, el brillo es verde.
Martin Chalfie propuso una aplicación práctica para este hallazgo: unir el gen de la GFP, como marcador, a otro gen específico para estudiar la expresión de éste último ¿Por qué? La proteína resultante llevará “pegada” la GFP brillante, que indicará el patrón de expresión del gen de interés ¿Cómo? Sencillo: iluminando con luz ultravioleta y, detectando luz verde.
Ahora bien, se necesitaban más estudios para la propuesta práctica anterior: identificar el gen de la GFP y, dilucidar el mecanismo molecular de fluorescencia. Se sabía que la GFP brilla por la presencia de un fluoróforo de tres aminoácidos para la transformación bioluminiscente. Además, se supuso la necesidad de enzimas para su plegamiento, propias de A. victoria.
En 1992 Douglas Prasher identificó el gen de la GFP; se pensó que su introducción en otros organismos produciría una versión no fluorescente. Pero, Chalfie y su equipo unieron el gen de GFP a otro bacteriano ¿resultado?: la bacteria transformada emitía fluorescencia verde!
Así, la GFP no necesitaba enzimas específicos para adoptar su plegamiento “brillante”; era un proceso espontáneo. Más aún, Roger Tsien confirmó que la reacción química del fluoróforo para el brillo sólo requería oxígeno, disponible en la mayoría de las células vivas.
Al conocer exactamente cómo se formaba el fluoróforo de la GFP, Tsien procedió a su manipulación. Intercambiando aminoácidos diferentes en distintas partes de la cadena obtuvo nuevas versiones de GFP más brillantes, que absorbían luz a diferentes longitudes de onda, y emitían en colores diversos: cian, azul y amarillo. Además, Tsien y col. trasladaron estos conocimientos sobre GFP a una proteína fluorescente de color rojo en coral, otro marcador biológico potencial.
Shimomura, Chalfie y Tsien recibieron el Nobel “por el descubrimiento y desarrollo de la proteína verde fluorescente”, de la que, en la actualidad, se disponen un abanico multicolor.
La GFP es una herramienta experimental cuyo empleo ha reducido el efecto perjudicial de marcadores fluorescentes químicos. Un fluoróforo, tras cierto tiempo de exposición a luz, libera un electrón.
Imagen cortesía de Typoform / the Royal Swedish Academy of Sciences (RSAS)

GFP plegada en cilindro, con
fluoróforo en el centro
Imagen cortesía de Typoform /
the Royal Swedish Academy of
Sciences (RSAS)
Los electrones así liberados reaccionan con el oxígeno, originando radicales tóxicos que dañarían la célula e, incluso, causarían su muerte. La estructura de GFP evita ese impacto: cuando el fluoróforo libera un electrón, los radicales resultantes quedan dentro de la GFP sin tocar la célula.
La GFP puede utilizarse como marcador de biomoléculas y, también, para seguir procesos como la migración celular.
Esta es la belleza de la GFP”, dice Darren Gilmour, científico delw2: “Con esta proteína accedemos a distintos niveles celulares – podemos pintarlos con la misma pintura sin cambiar el pincel.”
En su trabajo con embriones de pez cebra, Darren y su grupo utilizan GFP para observar migración celular e histogénesis. Estos embriones son transparentes ¿será fácil visualizar el proceso? No, Darren habla de “sobrecarga; no puedes aislar una sola cosa”. Con la GFP puedes “controlar el encendido” y centrarte en un grupo de células, o incluso en una sola célula (Más sobre el trabajo de Darren en Spinney, 2007).
La posibilidad de seguir un proceso tan dinámico es crucial según Francesca Peri, que estudia embriones bajo el microscopio durante días ¿ La alternativa? Sacrificar el animal, cortar y tomar imágenes fijas. “Sería como entender un partido de fútbol con apenas media docena de fotografías”, afirma Francesca. “Nunca obtendrías toda la imagen.” Peri y col estudian microglía, células que fagocitan neuronas dañadas. “Usando GFP podemos codificar con colores diferentes tipos de células: microglía, en verde; neuronas,rojo. Si vemos una célula roja dentro de una verde podremos confirmar la fagocitosis de una neurona por microglía para evitar progreso del daño al resto del tejido cerebral”.
Marcus Heisler y col. grupo utilizan la GFP y sus variantes en plantas. Este grupo se ha centrado en la auxina, hormona vegetal que sale de la célula por un transportador (“carrier”) de membrana. Este “carrier” se desplaza por la periferia celular y cambia la dirección de liberación de la hormona. “La GFP “mapea el proceso” en plantas vivas”, dice Marcus, “y en resolución 3D.”
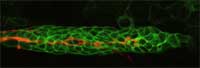
en naranja guía a otras
células ( en verde) en
migración a lo largo de un
embrión de pez cebra en
desarrollo
Imagen cortesía de Darren
Gilmour / EMBL
La fiabilidad de la GFP es fundamental para la obtención de imágenes en 3D, dice Ernst Stelzer, cuyo grupo desarrolla tecnologías de imagen tridimensional a tiempo real. “Introducir el colorante en una muestra de cierto espesor es complicado”, comenta. Los marcadores inyectados en las muestras no penetran bien y, el marcado tiende a ser irregular, bueno, en las capas externas, peor en las intermedias. En todo caso, con la GPF, señala Ernst, “podemos estar seguros que toda la muestra estará marcada, ya que el colorante penetra dentro de las células.”
Otro científico del EMBL, Rainer Pepperkok, explica: “Con la GFP podemos hacer biología molecular en las células vivas y no in vitro. Él y otros científicos se benefician de la disponibilidad de GFP en diferentes colores y, aplican el fenómeno físico de la transferencia de energía entre fluorocromos.
Este fenómeno se produce cuando dos moléculas fluorescentes de distintos colores – rojo y verde – se acercan. Si la verde recibe luz ultravioleta o azul la absorbe y, luego, transfiere parte de la energía a la molécula de roja, que luego emitirá luz roja, de una manera similar a la GFP verde brillante en las medusas, gracias a la luz azul de la acuorina. “Si tienes una proteína marcada con GFP verde y otra con RFP (proteína fluorescente de color rojo)”, explica Rainer, ” interactúan entre sí y, el rojo será más brillante y el verde, más tenue.”
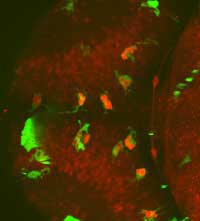
pueden investigar todo el
cerebro de un pez cebra de
embrión vivo , observar las
interacciones entre microglia
(verde) y neuronas (rojo ) y
encontrar neuronas dentro
de microglia (rojo brillante)
Imagen cortesía de Francesca
Peri / EMBL
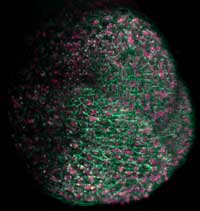
meristemo apical de
Arabidopsis , que dará lugar
a la parte aérea de la planta
se utilizaron proteínas
fluorescentes que marcaron
membranas de células en
verde y, de núcleo, en rosa
Imagen cortesía de Ernst
Stelzer / Marcus Heisler / EMBL
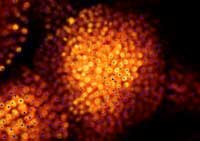
informáticas de marcado GFP,
los científicos pueden
comparar sus predicciones (
azul) con la ubicación real de
los núcleos celulares
(naranja)
Imagen cortesía de Marcus
Heisler / EMBL
A pesar de los diferentes usos de la GFP los científicos aún no están satisfechos. Desearían que GFP brillase bajo la luz roja o, incluso, infrarroja para mayor penetración en tejidos. “También se ampliaría el espectro de colores disponibles,” señala, JanEllenberg “lo que permitiría marcar más proteínas para un seguimiento simultáneo” ”Se necesitaría otro descubrimiento para lograr un nuevo objetivo, ya que Jan cree que la forma estándar de fluorescencia de la GFP a longitudes de onda más largas – apilando más aminoácidos en el fluoróforo – está casi agotada.
Por su parte, Darren valora que las técnicas de microscopía tienen que actualizarse: “Estamos en una etapa donde podríamos hacer un pez cebra con cinco colores, pero sin ser capaces de distinguirlos con la mayoría de los microscopios disponibles”.
Sin embargo, el uso de la GFP se está extendiendo más allá de la investigación: juguetes que brillan en la oscuridad, mascotas fluorescentes e, incluso bacterias modificadas genéticamente para detectar arsénico, TNT y metales pesados.
Aún así, el misterio continúa: ¿por qué la medusa nos deslumbra y prefiere el “brillo” verde?
References
- Spinney L (2007) La gran migración. Science in School 7. www.scienceinschool.org/2007/issue7/migration/spanish
Web References
- w1 – Más información sobre el Premio Nobel de Química en 2008 en: http://nobelprize.org/nobel_prizes/chemistry/laureates/2008
- w2 – Más sobre el EMBL y sus científicos aquí: www.embl.org





