Φως εν Ζωή: η χημεία του βιοφωτισμού Teach article
Μετάφραση από: Αλέξανδρο Χαρωνιτάκη (Alexander Charonitakis) – Φοιτητής Βιολογίας, ΕΚΠΑ και Παναγιώτη Κ. Στασινάκη (Panagiotis K. Stasinakis) - Εκπαιδευτικός, Βιολόγος, MEd, PhD, Πανελλήνια…

Εικόνα με την ευγενική
παραχώρηση του Chris
Favero Πηγή εικόνας: Flickr
Οι εμφανίσεις του βιοφωτισμού, αποτελούν ένα από τα φυσικά θαύματα του κόσμου. Η απόλυτη ομορφιά από τα χορευτικά φώτα των πυγολαμπίδων ή τα λαμπερά μπλε κύματα που προκαλούνται από το πλαγκτόν του ωκεανού, συνάρπαζαν για χιλιετίες τους ανθρώπους. Ενώ εξακολουθούμε να βρίσκουμε οπτική ευχαρίστηση σε αντίστοιχες εμφανίσεις ακόμα και σήμερα, μπορούμε πια να κατανοήσουμε τη χημεία που τις προκαλεί – μέχρι και να τις προσαρμόσουμε για εργαστηριακή χρήση αλλά και οπουδήποτε αλλού.
Μεγάλο πλήθος οργανισμών, από έντομα, ψάρια και μαλάκια έως βακτήρια και πλαγκτόν, μπορούν να παράγουν φως – όπως είναι γνωστό εδώ και χιλιάδες χρόνια. Ο Ρωμαίος συγγραφέας Πλίνιος ο Πρεσβύτερος περιέγραψε ένα βρώσιμο οστρακοειδές, το Pholas dactylus το οποίο, μάλλον ιδιόρρυθμα, εκπέμπει φως όταν τρώγεται. Επίσης ανέφερε ότι ένας μύκητας του δέντρου, ο Omphalotus olearius, παράγει μία λαμπερή λάμψη τη νύχτα.
Πιθανόν οι πιο εντυπωσιακές εμφανίσεις του βιοφωτισμού προκύπτουν στα δινομαστιγωτά, πλαγκτονικές μορφές οι οποίες δημιουργούν τα λαμπερά μπλε κύματα που κάποιες φορές διακρίνονται στην επιφάνεια του ωκεανού. Πιο εξωτικές μορφές βιοφωτισμού βρίσκονται στα ωκεάνια βάθη: όπου δεν μπορεί να φτάσει το φως και πολλά είδη έχουν τη δική τους φωταγώγηση. Διάσημο παράδειγμα αποτελούν τα αγκιστρόψαρα (angler fish), που χρησιμοποιούν ένα αιωρούμενο «φωτάκι», για να δελεάσουν το θήραμα κατευθείαν στα δόντια τους.

pyralis
Εικόνα με την ευγενική
παραχώρηση του Terry Priest
Πηγή εικόνας: Flickr
Ο Βιοφωτισμός – το φως που παράγεται από τους ζωντανούς οργανισμούς – είναι ευρέως διαδεδομένος στη φύση, αλλά τι πλεονέκτημα προσφέρει στα είδη που το χρησιμοποιούν; Στην πραγματικότητα υπάρχουν πολλά, στα οποία περιλαμβάνονται:
- Αποσηματικός χρωματισμός (τοξική εμφάνιση), για να δείχνουν ακατάλληλοι προς βρώση από πιθανούς θηρευτές. Παράδειγμα: οι πυγολαμπίδες Photinus ignitus και Lucidata atra.
- Άμυνα, για να τρομάζουν τους θηρευτές εκπέμποντας μία φωτεινή λάμψη σε κοντινή απόσταση. Παράδειγμα: τα sternchasers, ένας τύπος λυχναρόψαρου (μυκτοφίδες).
- Ερωτοτροπία, για να επικοινωνούν πριν ή κατά τη διάρκεια του ζευγαρώματος. Παράδειγμα: οι πυγολαμπίδες.
- Δολώματα, για να προσελκύουν το θήραμα στην πηγή φωτός. Παράδειγμα: τα αγκιστρόψαρα (angler fish).
- Παραλλαγή (καμουφλάζ), για να βοηθήσει το ζώο να αναμειχθεί με το περιβάλλον γύρω του. Όπως φαίνεται από κάτω ένα θαλάσσιο ζώο, θα δείχνει πιο σκοτεινό σε αντιδιαστολή με την φωτεινή επιφάνεια του νερού από πάνω του, επομένως παράγοντας το δικό του φως θα βοηθηθεί να κρυφτεί από πιθανούς θηρευτές. Παράδειγμα: καλαμάρια όπως το Abralia verany.
Αστραφτερά χρώματα
Στη φύση, ο βιοφωτισμός παράγει διαφορετικά χρώματα: κυρίως μπλε, πράσινο και κίτρινο. Το χαρακτηριστικό χρώμα φωτός που παράγει ένα είδος, εξαρτάται από το περιβάλλον στο οποίο έχει εξελιχθεί. Μπλε εκπομπές φωτός συνήθως συμβαίνουν βαθιά στον ωκεανό, πράσινες εκπομπές σε είδη που ζουν παράλληλα με τις ακτογραμμές και κίτρινες (αλλά και πράσινες) εκπομπές στα γλυκά νερά και στα είδη που ζουν στην ξηρά.
Ποια είναι η χημεία που δημιουργεί το βιοφωτισμό; Και πώς αποκτώνται αυτά τα διαφορετικά χρώματα – μπλε, πράσινο και κίτρινο;
Χημικά, οι περισσότερες περιπτώσεις βιοφωτισμού είναι αποτέλεσμα αντιδράσεων οξυγόνωσης: το οξυγόνο αντιδρά με ουσίες που ονομάζονται λουσιφερίνες, παράγοντας ενέργεια υπό τη μορφή φωτός. Οι αντιδράσεις αυτές καταλύονται από ένζυμα, γνωστά ως λουσιφεράσες. Σε αυτή τη διαδικασία οι λουσιφερίνες οξυγονώνονται για να σχηματίσουν οξυλουσιφερίνες. Όπως φαίνεται στον Πίνακα 1, οι λουσιφερίνες που χρησιμοποιούνται από διαφορετικά είδη και οι σχηματιζόμενες οξυλουσιφερίνες, μπορούν να ποικίλουν ως προς τη χημική τους δομή.
|
Βιοφωτίζοντα είδη |
Λουσιφερίνη |
Οξυλουσιφερίνη |
|---|---|---|
|
Δινομαστιγωτά |
Λουσιφερίνη δινομαστιγωτών C33H3806N4Na2 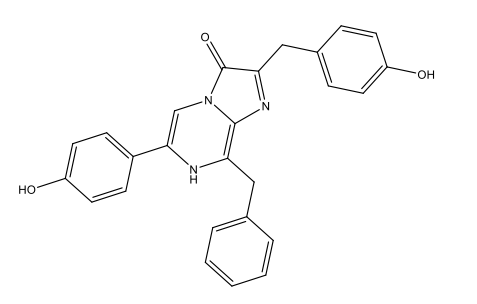 |
 |
|
Καλαμάρια, μερικές γαρίδες, κάποια ψάρια |
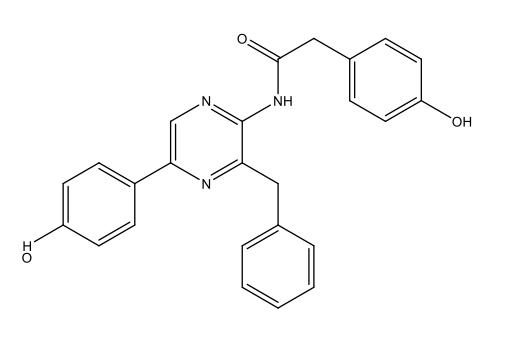
Κοιλεντεραζίνη (Coelenterazine) C26H2103N3  |
 |
|
Πυγολαμπίδες |
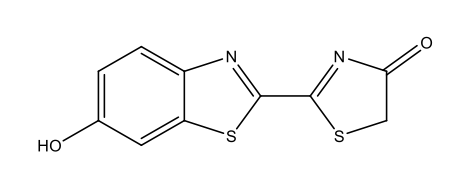
Λουσιφερίνη πυγολαμπίδας C11H8N2O3S2 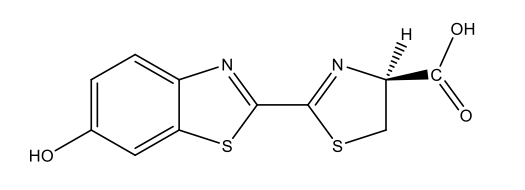 |
 |
Αυτές οι αντιδράσεις είναι πολύ αποδοτικές, με το 98% της ενέργειας που εμπλέκεται να απελευθερώνεται με τη μορφή φωτός. Συγκρίνετέ το, με την απόδοση στο επίπεδο του 2% μίας παραδοσιακής λάμπας πυράκτωσης, η οποία όμως επιπλέον ελευθερώνει μεγάλα ποσά ενέργειας, υπό τη μορφή θερμότητας.
Όπως συμβαίνει σε διάφορα είδη, κάποιες λουσιφερίνες μπορούν να παράγουν περισσότερα από ένα φωτεινά χρώματα (δείτε στον Πίνακα 2). Επιπλέον οι φωτοεκπέμπουσες ουσίες ή φθορίζουσες ουσίες (fluorophores), μπορούν να αλλάξουν επίσης το χρώμα της φωτοβολίας. Η μέδουσα Aequorea victoria περιέχει μία τέτοια φθορίζουσα ουσία, γνωστή ως πράσινη φθορίζουσα πρωτεΐνη (GFP). Η GFP απορροφά το μπλε φως που παράγεται από την αρχική αντίδραση και το επανεκπέμπει σε μεγαλύτερο μήκος κύματος ως πράσινο φως, οπότε η μέδουσα παράγει πράσινο βιοφωτισμό.
|
Λουσιφερίνη |
Μέγιστη φωταύγεια (nm) |
Χρώμα κατά προσέγγισηw1 |
|
|---|---|---|---|
| Λουσιφερίνη πυγολαμπίδας | 560 (at pH=7.1) | Πράσινο |
 |
| 615 (at pH=5.4) | Πορτοκαλί |
 |
|
| Βακτηριακή λουσιφερίνη | 490 | Τιρκουάζ |
 |
| Λουσιφερίνη δινομαστιγωτών | 474 | Μπλε |
 |
| Κοιλεντραζίνη | 450-480 σε μορφή ανιόντος | Μπλε προς τιρκουάζ |
 |
| 400 στην –COOH μορφή | Μωβ |
 |
|
Στις τελευταίες δεκαετίες, αυτό το ιδιαίτερο σύστημα βιοφωτισμού έχει βρει μία σημαντική χρήση στην επιστημονική έρευνα: το γονίδιο που κωδικοποιεί την GFP χρησιμοποιείται πια ως γενετική ‘ετικέτα’, για να εντοπίζει συγκεκριμένες πρωτεΐνες και να αποκαλύπτει πότε εκφράζονται συγκεκριμένα γονίδια. Επειδή η GFP φωτίζει πράσινη κάτω από μπλε ή υπεριώδη ακτινοβολαί, είναι πολύ εύκολο να ανιχνευθεί (δείτε Furtado, 2009). Αυτή η εργασία θεωρήθηκε τόσο σημαντική, που βραβεύτηκε με το Βραβείο Nobel Χημείας το 2008w2.
Ευτυχώς για εμάς, είναι σχετικά εύκολο να αντιγράψουμε στο εργαστήριο τον τύπο της χημικής αντίδρασης που προκαλεί βιοφωτισμό, όπως παρουσιάζει και η παρακάτω δραστηριότητα.
Δραστηριότητα μαθητή: βιοφωτισμός στο εργαστήριο
Σε αυτή τη δραστηριότητα, οι μαθητές μπορούν να δουν μία αντίδραση βιοφωτισμού, όταν αναμειχθούν χημικά αντιδραστήρια. Το σημαντικό συστατικό είναι η λουμινόλη, μία συνθετική χημειοφωτοβόλος ουσία η οποία παράγει μπλε φως όταν αντιδράσει χημικά. Παρόλο που οι αντιδράσεις της λουμινόλης και της λουσιφερίνης είναι διαφορετικές – η οξειδωτική αντίδραση της λουμινόλης καταλύεται με σιδηροκυανιουχο κάλιο αντί για ένζυμο – (για περισσότερες λεπτομέρειες, δείτε Welsh, 2011) – το αποτέλεσμα είναι το ίδιο: βιοφωτισμός.
Το τελικό στάδιο σε αυτή τη δραστηριότητα, θα πρέπει να μεταφερθεί σε σκοτεινό μέρος για να είναι ορατό περισσότερο φως.
Υλικά
- 1 g λουμινόλης (5-amino-2,3-dihydrophthalazine-1,4-dione)
- 50 ml υδροξείδιο του νατρίου (NaOH), διάλυμα 10% w/w
- 50 ml σιδηροκυανιούχο κάλιο (K3[Fe(CN)6]), διάλυμα 3% w/w
- Περίπου 0,5 g σιδηροκυανιούχο κάλιο (K3[Fe(CN)6])
- 3 ml υπεροξείδιο του υδρογόνου (H2O2), διάλυμα 30% m/m
- Απιονισμένο νερό
- Ποτήρια ζέσεως
- Χωνί
- Ογκομετρικοί κύλινδροι
- Κωνική φιάλη
Διαδικασία
Σημείωμα ασφάλειας
Θα πρέπει να φοράτε προστατευτικά γυαλιά, εργαστηριακή ποδιά και προστατευτικά γάντια. Προσοχή όταν χρησιμοποιείτε το διάλυμα υπεροξειδίου του υδρογόνου 30%, καθώς αντιδρά βίαια παρουσία ενός καταλύτη. Κλείστε το μπουκάλι αμέσως, μόλις αφαιρέσετε τα 3ml διαλύματός.
Δείτε επίσης το γενικότερο σημείωμα ασφάλειας του Science in School.
- Σε ένα ποτήρι ζέσεως, διαλύστε 1 g λουμινόλης, σε 450 ml απιονισμένου νερού.
- Προσθέστε 50 ml διαλύματος 10% υδροξείδιο του νατρίου και αναμίξτε.
- Πάρτε 50ml από το διάλυμα που προέκυψε και το προσθέτετε σε 350 ml απιονισμένου νερού σε ένα άλλο ποτήρι ζέσεως. Αυτό τώρα είναι το Διάλυμα Α.
- Σε ένα τρίτο ποτήρι ζέσεως, αναμίξτε 50 ml διαλύματος 3% σιδηροκυανιούχου καλίου με 350ml απιονισμένου νερού και 3ml διαλύματος 30% υπεροξειδίου του υδρογόνου. Αυτό είναι το Διάλυμα Β.
- Βάλτε ίσες ποσότητες από τα διαλύματα Α και Β σε διαφορετικούς ογκομετρικούς κυλίνδρους.
- Βάλτε λίγο σιδηροκυανιούχο κάλιο μέσα στην κωνική φιάλη και τοποθετήστε το χωνί πάνω στη φιάλη.
- Μετακινήστε την κωνική σε σκοτεινό μέρος.
- Ρίξτε ταυτόχρονα τα διαλύματα Α και Β μέσα στην κωνική και δείτε τι συμβαίνει.
Ένας θαυμάσιος γαλάζιος βιοφωτισμός θα αρχίσει αμέσως!
- Απόβλητα: θερμάνετε το διάλυμα στον απαγωγό για να το συμπυκνώσετε μέχρι ο όγκος να φτάσει στο 1/8 της αρχικής ποσότητας, μετά ρίξτε το υπόλοιπο διάλυμα στη δεξαμενή υπολειμμάτων βαρέων μετάλλων.
Τι συνέβη;
Η οξείδωση της λουμινόλης πραγματοποιείται σε αρκετά στάδια.
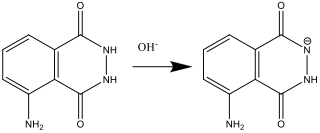
- Ενώ το διάλυμα Α ετοιμάζεται (βήμα 2), η λουμινόλη αντιδρά με τη βάση (OH–):
- Ενώ το διάλυμα Β ετοιμάζεται (βήμα 4), το υπεροξείδιο του υδρογόνου αποσυντίθεται για να σχηματίσει σουπεροξειδικό δραστικό ανιόν Ο2. Αυτή η αντίδραση καταλύεται από το εξασιδηροκυανιούχο (ΙΙΙ) ιόν.
- Όταν αναμιγνύονται τα διαλύματα Α και Β (βήμα 8), η λουμινόλη οξειδώνεται από το εξασιδηροκυανιούχο (ΙΙΙ) ανιόν, σχηματίζοντας ένα δραστικό ανιόν:
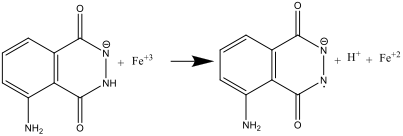
Επομένως, το εξασιδηροκυανιούχο ιόν έχει διττό ρόλο: καταλύει το σχηματισμό του σουπεροξειδικού δραστικού ανιόντος Ο2. και επίσης οξειδώνει τη λουμινόλη σε δραστικό ανιόν. Ο σίδηρος πρέπει να βρίσκεται στη μορφή ενός συμπλόκου [Fe(CN)6]-3, για να εμποδίσει την κατακρήμνιση του Fe(OH)3 στο ισχυρά αλκαλικό περιβάλλον.
- Το δραστικό ανιόν της λουμινόλης και το σουπεροξειδικό δραστικό ανιόν Ο2.-, ύστερα αντιδρούν:
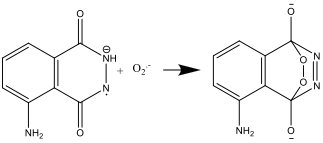
- Η ένωση που προκύπτει είναι ασταθής και αποσυντίθεται για να παράγει άζωτο και μία διεγερμένη μορφή του αμινοφθαλικού ιόντος:
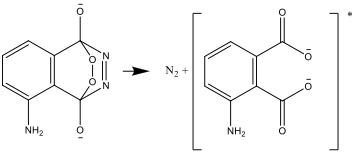
- Η διεγερμένη μορφή ύστερα μετασχηματίζεται και διασπάται σε μία σταθερή μορφή, εκπέμποντας τη διαφορά ενέργειας ως φως:
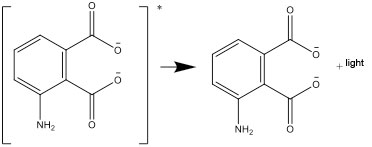
Ερωτήσεις προς συζήτηση
- Στην αντίδραση της λουμινόλης, από που προέρχεται η ενέργεια για την παραγωγή του φωτός;
- Ποιος είναι ο ρόλος του σιδηροκυανιούχου καλίου; Στις φυσικές αντιδράσεις βιοφωτισμού, ποια ουσία επιτελεί αυτό το ρόλο;
- Ποια ουσία είναι υπεύθυνη για την οξείδωση στην αντίδραση της λουμινόλης; Είναι η ίδια στη φύση?
Επέκταση
Υπάρχει ένας μεγάλος όγκος πληροφοριών διαθέσιμος για τον βιοφωτισμό (δείτε στις πηγές, για παραδείγματα). Οι μαθητές μπορούν να συμπληρώσουν αυτή τη δραστηριότητα, με ερευνητικές εργασίες που θα εντοπίσουν μόνοι τους. Για παράδειγμα:
- Χρήσεις του βιοφωτισμού στη φύση. Βρείτε περισσότερους λόγους για τους οποίους ο βιοφωτισμός είναι μία χρήσιμη προσαρμογή. Για κάθε προσαρμογή, προσδιορίστε κάποια είδη που ευνοούνται από αυτή.
- Χημεία βιοφωτισμού. Βρείτε για κάποιες συγκεκριμένες χημειοφωτοβόλες αντιδράσεις που γίνονται στη φύση. Πόσο παρόμοιες είναι, με την αντίδραση της λουμινόλης;
- Χρώματα βιοφωτισμού. Βρείτε περισσότερα, για τον τρόπο με τον οποίο παράγονται.
- Εξέλιξη του βιοφωτισμού. Έχει εξελιχθεί πολλές φορές, ή μόνο μία;
- Χρήσεις της λουμινόλης σε έρευνες, στον τόπο του εγκλήματος. Βρείτε πως η λουμινόλη χρησιμοποιείται στην εγκληματολογία και τη χημεία αυτής της χρήσης (π.χ. βλέπε Welsh, 2011).
Μελετώντας χημεία με τον Πλίνιο τον Πρεσβύτερο
Αυτή η δραστηριότητα είναι τμήμα ενός μεγαλύτερου διεπιστημονικού προγράμματος, που αναπτύχθηκε μαζί με μαθητές ηλικίας 14-15 ετών, για να εξερευνήσουνε αρχαίες επιστημονικές πρακτικές. Ο Πλίνιος ο Πρεσβύτερος (23-78 μ.Χ.), ήταν ένας Ρωμαίος συγγραφέας και φυσιοδίφης του οποίου η εγκυκλοπαίδεια, Naturalis Historia, συγκέντρωνε αρκετή από την επιστημονική γνώση της εποχής. Ξεκινάμε κάθε θέμα συζητώντας ένα χωρίο από τη Naturalis Historia και ύστερα εργαζόμαστε στο πως να αναπαράγουμε, είτε το πείραμα που περιγράφεται στο κείμενο, είτε κάτι παρόμοιο.
Κατ’ αυτόν τον τρόπο οι μαθητές ξεκινούν στο ίδιο προ-επιστημονικό επίπεδο όπως ο Πλίνιος και μέσα από εργαστηριακή δουλειά και συζήτηση κερδίζουν μοντέρνα επιστημονική γνώση, σε κάθε ένα από τα θέματα. Η διαδικασία κινητοποιεί ακόμα και τους λιγότερο ενθουσιασμένους μαθητές.
Άλλες δραστηριότητες στο πρόγραμμα περιλαμβάνουν σύνθεση λουλακής (indigo) (Farusi, 2012), επαναδημιουργία αρχαίων αρωμάτων (Farusi, 2011), προετοιμασία γυάλινων ψηφίδων με βορικό οξύ και προετοιμασία μελανιού από σίδηρο και χολή (Farusi, 2007). Το όλο πρόγραμμα παρουσιάστηκε διεθνώς στο Science on Stage festivalw3 στην Κοπεγχάγη της Δανίας, το 2011.
References
- Farusi G (2007) Μελάνι μοναχών : συνδέοντας τη χημεία με την ιστορία. Science in School 6.
- Farusi G (2011) Smell like Julius Caesar: recreating ancient perfumes in the laboratory. Science in School 21: 40-46.
- Farusi G (2012) Indigo: recreating Pharaoh’s dye. Science in School 24: 40-46.
- Furtado S (2009) Painting life green: GFP. Science in School 12: 19-23.
- Welsh E (2011) Τι είναι η χημειοφωταύγεια; Science in School 19.
Web References
- w1 – Ένα απλό εργαλείο για να μετασχηματίσεις νανόμετρα σε σύστημα χρώματος RGB ή δεκαεξαδικό είναι διαθέσιμο στην ιστοσελίδα Academo, μία δωρεάν συλλογή από εκπαιδευτικές πηγές.
- w2 – Ένας προσβάσιμος λογαριασμός των βραβείων Nobel Χημείας το 2008 όπου βραβεύτηκαν οι Osamu Shimomura, Martin Chalfie και Roger Y Tsien, είναι διαθέσιμος στην ιστοσελίδα των βραβείων Nοbel.
- w3 – Το Science on Stage είναι ένα δίκτυο τοπικών, εθνικών και διεθνών δράσεων για εκπαιδευτικούς, που αρχικά ξεκίνησε το 1999 από το EIROforum, εκδότη του Science in School. Σε κάθε εθνικό γεγονός, μία αντιπροσωπεία εκπαιδευτικών επιλέγεται για να εκπροσωπήσει τη χώρα στο φεστιβάλ Science on Stage. Κατά τη διάρκεια του φεστιβάλ, περίπου 350 εκπαιδευτικοί της πρωτοβάθμιας και δευτεροβάθμιας εκπαίδευσης από 25 χώρες, θα μοιραστούν τις πιο καινοτόμες διδακτικές ιδέες του σε εργαστήρια, παραστάσεις επί της σκηνής και στην έκθεση διδασκαλίας.
- Το επόμενο διεθνές φεστιβάλ θα λάβει χώρα στις 29 Ιουνίου – 2 Ιουλίου 2017, στο Debrecen της Ουγγαρίας. Οι συμμετέχοντες θα επιλεγούν μέσω ανταγωνιστικών εθνικών εκδηλώσεων, σε 25 χώρες. Για να βρείτε περισσότερες πληροφορίες για τη διαδικασία των αιτήσεων, επικοινωνήστε με την επιτροπή συντονισμού της χώρας σας.
Resources
- Δύο διαθέσιμα άρθρα σχετικά με το (βιο)φωτισμό:
- Douglas P, Garley M (2010) Chemistry and light. Science in School 14: 63-68
- Judson O (2015) Luminous life. National Geographic
- Μία γοητευτική και ενημερωτική απεικόνιση για το βιοφωτισμό.
- Ένα ατμοσφαιρικό βίντεο με μουσική που εορτάζει την εντυπωσιακή ομορφιά του ωκεάνιου βιοφωτισμού.
- Ένα σύντομο βίντεο που παρουσιάζει το πώς να φτιάξετε λουμινόλη.
- Ένα αναλυτικότερο βίντεο που δείχνει πως να φτιάξετε λουμινόλη.
Institutions
Science on StageReview
Ο Βιοφωτισμός έχει συναρπάσει ανθρώπους για χιλιάδες χρόνια και συνεχίζει να είναι ένα υψηλής προτεραιότητας ερευνητικό θέμα, ιδιαίτερα σε ωκεάνιες ερευνητικές εργασίες. Οι χημικές αντιδράσεις που οδήγησαν στην παραγωγή του φωτός από οργανισμούς, είναι ένα σπουδαίο παράδειγμα βιοφωτισμού. Η πρακτική δραστηριότητα που περιγράφεται στο άρθρο, είναι χρήσιμη για να εμπλέξει και να διασκεδάσει τους μαθητές καθώς και να επάγει την επιστημονική συζήτηση.
Marie Walsh, Ινστιτούτο Τεχνολογίας Limerick, Ιρλανδία





