Supporting materials
Διοξείδιο του άνθρακα – βασικές πληροφορίες (Word)
Διοξείδιο του άνθρακα – βασικές πληροφορίες (Pdf)
Ιστορίες με το διοξείδιο του άνθρακα (Word)
Ιστορίες με το διοξείδιο του άνθρακα (Pdf)
Download
Download this article as a PDF

Μεταφρασμένο από την Παρασκευή Θάνου (Paraskevi Thanou). Η Marlene Rau παρουσιάζει μερικές αφρίζουσες και διασκεδαστικές δραστηριότητες που περιλαμβάνουν το διοξείδιο του…

Το διοξείδιο του άνθρακα (CO2) δεν είναι μόνο ένα από τα πιο σημαντικά αέρια του φαινομένου του θερμοκηπίου, αλλά βρίσκεται παντού γύρω μας: στον αέρα (0,0388 % κ.ο.) που αναπνέουμε, στον αέρα που εκπνέουμε (4 % κ.ο.), στα αεριούχα ποτά, στα γλυκίσματα που διογκώνονται χάρη στο CO2, το οποίο παράγεται από τις διογκωτικές ύλες (baking powder), και όταν οργανικές ουσίες όπως η παραφίνη, το χαρτί, το ξύλο ή το πετρέλαιο καίγονται. Σε υγρή μορφή, χρησιμοποιείται στους πυροσβεστήρες και ως ψυκτικό μέσο στη βιομηχανία τροφίμων (για παράδειγμα στην αποθήκευση και τη μεταφορά των παγωτών).
Σε υψηλές συγκεντρώσεις, το CO2 μπορεί να αποβεί επικίνδυνο για τους ανθρώπους και τα ζώα, αλλά είναι επίσης η πηγή της ζωής: κατά τη διάρκεια της φωτοσύνθεσης, τα φυτά χρησιμοποιούν CO2 και φως για να συνθέσουν σάκχαρα, άμυλο, λίπη και πρωτεΐνες, καθώς επίσης και οξυγόνο που είναι απαραίτητο για να επιβιώσουμε.
Οι ακόλουθες δραστηριότητες από το Chemolw1 και το Science on the Shelvesw2 (βλ. πλαίσιο) παρουσιάζουν στα παιδιά της πρωτοβάθμιας εκπαίδευσης αυτό το σημαντικό αέριο. Για την υποστήριξη των δραστηριοτήτων, περισσότερες βασικές πληροφορίες για τη χημεία, τη φυσιολογική σημασία, την ανίχνευση και την εμφάνιση του CO2 είναι διαθέσιμες στις πηγές παρακάτωw3.

Σημείωση: οι ποσότητες του διοξειδίου του άνθρακα που παράγονται σε αυτές τις δραστηριότητες δεν είναι αρκετά υψηλές ώστε να είναι επικίνδυνες.
Αν προσθέσετε νερό σε αναβράζοντα δισκία ή σε baking powder, σχηματίζονται φυσαλίδες: παράγεται ένα αέριο. Μπορείτε να χρησιμοποιήσετε αυτό το αέριο για να φουσκώσετε ένα μπαλόνι χωρίς να φυσήξετε εσείς. Τι είδους αέριο είναι αυτό; Ας το συλλέξουμε και ας το αναλύσουμε.

Τα πρώτα έξι βήματα είναι κοινά και για τις δύο δραστηριότητες – στη συνέχεια έχετε δύο επιλογές για να συνεχίσετε.
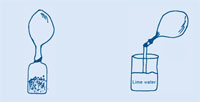
Όταν το μπαλόνι σταματήσει να φουσκώνει, στρίψτε το για να κλείσει, ώστε να μην μπορεί να διαφύγει αέριο, και τραβήξτε το από τη φιάλη.
Αν το ασβεστόνερο έρθει σε επαφή με τα μάτια σας, ξεπλύνετέ τα αμέσως με νερό. Δείτε επίσης τη γενική σημείωση ασφαλείας.
Η δοκιμασία του ασβεστόνερου για την ανίχνευση του CO2 αναπτύχθηκε από το χημικό Joseph Black (1728–1799). Το τσιμέντο και ο ασβέστης περιέχουν υδροξείδιο του ασβεστίου (Ca(OH)2). Όταν το CO2 προστίθεται στο υδατικό διάλυμα του Ca(OH)2, παράγονται πολύ μικρά σωματίδια ανθρακικού ασβεστίου (CaCO3) και αυτό είναι που θολώνει το ασβεστόνερο.
Από πού προήλθε τοCO2 Τόσο το baking powder όσο και τα αναβράζοντα δισκία περιέχουν όξινο ανθρακικό νάτριο (NaHCO3) και ένα στερεό οξύ (όπως κρυσταλλικό κιτρικό οξύ ή δισόξινο φωσφορικό ασβέστιο). Σε επαφή με το νερό, το όξινο ανθρακικό νάτριο και το οξύ αντιδρούν μεταξύ τους, σχηματίζοντας τελικά νερό και CO2. Αυτό το αέριο προκαλεί τις φυσαλίδες που σχηματίζονται, όταν ένα αναβράζον δισκίο διαλύεται στο νερό. Αυτό διογκώνει επίσης τα γλυκίσματα.
Το κεράκι θα πρέπει να σταματήσει να καίγεται, γιατί το αέριο (CO2) θα σβήσει τη φλόγα.
Ξανά η φλόγα σβήνει, αποδεικνύοντας ότι καταφέραμε να αποχύσουμε το αέριο από το ένα ποτήρι στο άλλο, σαν να ήταν υγρό. Αυτό δείχνει ότι το CO2 είναι βαρύτερο από τον αέρα.
Το Chemolw1 είναι ένα πρόγραμμα με έδρα το Πανεπιστήμιο του Oldenburg, Γερμανία, που φέρνει σε επαφή με τη χημεία παιδιά πρωτοβάθμιας εκπαίδευσης. Η ομάδα, η οποία περιλαμβάνει εκπαιδευόμενους δασκάλους και έχει επικεφαλής την Dr Julia Michaelis, προσφέρει εργαστήρια για παιδιά σε θέματα σχετικά με τη φωτιά, τη γη, τον αέρα και το νερό, καθώς επίσης και εκπαίδευση σε δασκάλους.
Περαιτέρω δραστηριότητες του Chemol που σχετίζονται με το διοξείδιο του άνθρακα περιλαμβάνουν την κατασκευή ενός δικού σας πυροσβεστήρα με βάση το CO2, πειράματα με ανθρακούχα ποτά, τη μέτρηση της ποσότητας του αερίου που παράγεται από ένα αναβράζον δισκίο, και τη δοκιμασία της επίδρασης της θερμοκρασίας στη διαλυτότητα του CO2 στο νερό. Λεπτομέρειες υπάρχουν στην ιστοσελίδα του Chemolw1.
Το Science on the Shelves (η Επιστήμη στα Ράφια) είναι μια ιστοσελίδαw2 που παρέχει οδηγίες για ένα μεγάλο εύρος απλών επιστημονικών πειραμάτων χρησιμοποιώντας τρόφιμα και άλλα προϊόντα από το σούπερ μάρκετ, κατάλληλα για παιδιά 6 έως 11 ετών , για τους δασκάλους τους και για τις οικογένειές τους. Το πρόγραμμα, με έδρα το Ηνωμένο Βασίλειο, συντονίζεται από τον Dr Nigel Lowe και είναι μια συνεργασία μεταξύ του University of York και του Engineering and Physical Sciences Research Council. Αν έχετε ιδέες για σπουδαία πειράματα, ο Nigel περιμένει να τις ακούσει.
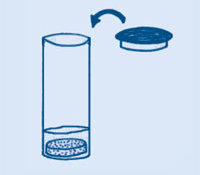
Αναμίξτε 3 κουταλιές όξινου ανθρακικού νατρίου και 1 κουταλιά κρυσταλλικού κιτρικού οξέος (κατάλληλου για τρόφιμα). Για να βελτιώσετε τη γεύση, προσθέστε είτε 2-4 κουταλιές άχνης ζάχαρης είτε 1 κουταλιά σκόνης ζελέ και 1 κουταλιά ζάχαρης. Το “sherbet” είναι έτοιμο προς κατανάλωση.
Οι κρύσταλλοι του κιτρικού οξέος διαλύονται στη γλώσσα σας και αντιδρούν με το όξινο ανθρακικό νάτριο. Η αντίδραση αυτή παράγει φυσαλίδες αερίου διοξειδίου του άνθρακα, που προκαλούν την αίσθηση του αναβρασμού στη γλώσσα σας. Για να φτιάξετε ένα αναψυκτικό, αναμίξτε το “sherbet” με νερό.
Οι πύραυλοι και τα εκρηκτικά λειτουργούν παράγοντας τεράστιους όγκους αερίων σε σύντομο χρόνο. Μπορείτε να δημιουργήσετε τους δικούς σας πυραύλους χρησιμοποιώντας κιτρικό οξύ και μαγειρική σόδα ή αναβράζοντα δισκία.
Τα παρακάτω πειράματα παράγουν βλήματα που προωθούνται με μεγάλη ταχύτητα. Ακολουθήστε όλες τις οδηγίες ασφαλείας που δίνονται παρακάτω και φορέστε προστατευτικά γυαλιά. Πραγματοποιήστε όλα τα πειράματα σε εξωτερικό χώρο, γιατί προκαλούν αναστάτωση. Δείτε επίσης τη γενική σημείωση ασφαλείας.
Ποτέ μην επιτρέψετε σε κάποιον να κοιτάξει το κανόνι από πάνω από τη στιγμή που έχει ‘οπλιστεί’. Αν αποτύχει να εκραγεί (όπως συμβαίνει μερικές φορές όταν το καπάκι δεν κλείνει αεροστεγώς), ανοίξτε το πολύ προσεκτικά, κρατώντας το μακριά από το πρόσωπό σας.

Όταν οι κρύσταλλοι του κιτρικού οξέος και η μαγειρική σόδα διαλύονται στο νερό, αντιδρούν μεταξύ τους και παράγεται αέριο διοξείδιο του άνθρακα. Τα αναβράζοντα δισκία περιέχουν ήδη και τα δύο συστατικά (όξινο ανθρακικό νάτριο και ένα οξύ), τα οποία θα αντιδράσουν μεταξύ τους όταν προστεθεί νερό. Το παραγόμενο αέριο διαστέλλεται, πιέζοντας τα τοιχώματα και το καπάκι του κανονιού. Όταν η πίεση γίνει μεγαλύτερη από αυτή που αντέχει το ασθενέστερο σημείο των τοιχωμάτων (το καπάκι), το κανόνι θα εκραγεί και το καπάκι θα εκτιναχθεί έως 5 μέτρα στον αέρα, απελευθερώνοντας το αέριο.
Χρονομετρήστε το διάστημα που χρειάζεται για να ανοίξει το καπάκι και στη συνέχεια πειραματιστείτε με τις ποσότητες: για παράδειγμα, προσπαθήστε να επιτύχετε να πετάγεται το καπάκι έπειτα από ακριβώς 1 λεπτό.

Το διοξείδιο του άνθρακα μπορεί να αποτελέσει κίνδυνο αν βρίσκεται σε αρκετά υψηλές συγκεντρώσεις. Για να παρακολουθήσει τόσο αυτό όσο και άλλα επικίνδυνα αέρια στο χώρο εργασίας, το EFDA-JETw4 χρησιμοποιεί μια ποικιλία οργάνων, φορητών καθώς και εγκατεστημένων σε κτίρια, για να ανιχνεύσει αέρια που μειώνουν τη συγκέντρωση του οξυγόνου και επομένως μπορούν να οδηγήσουν σε ασφυξία. Τα αέρια που καταγράφονται περιλαμβάνουν όχι μόνο το διοξείδιο του άνθρακα και άλλα κρυογόνα αέρια όπως το ήλιο, αλλά επίσης το άζωτο (που χρησιμοποιείται για την καταστολή της φωτιάς), το εξαφθοριούχο θείο (SF6, ένα αέριο που χρησιμοποιείται για ηλεκτρική μόνωση) και οι ατμοί των ψυκτικών υγρών όπως το Galden®. Πριν δουλέψει το προσωπικό σε χώρους, στους0 οποίους αυτά τα αέρια αποτελούν απειλή, πρέπει να ελέγξει τα εγκατεστημένα όργανα ή να ζητήσει μια μέτρηση με ένα φορητό όργανο, για να διαπιστωθεί ότι η ατμόσφαιρα είναι ασφαλής.
Το διοξείδιο του άνθρακα αποτελεί επίσης έναν πιθανό κίνδυνο σε υψόμετρο 350 km πάνω από την επιφάνεια της Γης – για τους αστροναύτες που βρίσκονται στο Διεθνή Διαστημικό Σταθμό (International Space Station, ISS), μια συνεργασία μεταξύ του Ευρωπαϊκού Οργανισμού Διαστήματος (European Space Agency, ESA)w5 και άλλων διεθνών συνεργατών.
Όταν οι άνθρωποι αναπνέουν, καταναλώνουν οξυγόνο και παράγουν διοξείδιο του άνθρακα. Ως αποτέλεσμα, σε κλειστό περιβάλλον, όπως στα υποβρύχια, τα αεροπλάνα και τον ISS, τα επίπεδα του οξυγόνου θα πέσουν και το διοξείδιο του άνθρακα θα συσσωρευτεί, θέτοντας σε κίνδυνο το πλήρωμα (όπως περιγράφεται στην ταινία Apollo 13). Τα επίπεδα και των δύο αερίων πρέπει να ρυθμίζονται.
Προς το παρόν, ο ISS χρησιμοποιεί μια ανοιχτή προσέγγιση: το διοξείδιο του άνθρακα παγιδεύεται με ειδικές παγίδες αερίων (πχ υδροξείδιο του λιθίου, LiOH, το οποίο ενώνεται με το CO2 σχηματίζοντας ανθρακικό λίθιο και νερό), και φιάλες οξυγόνου μεταφέρονται από τη Γη. Στο μέλλον ο ISS θα χρησιμοποιεί ένα κλειστό σύστημα ανακύκλωσης: θα ανακτεί το O2 από το CO2, χρησιμοποιώντας είτε φυσικοχημικές τεχνικές (ουσιαστικά “κόβοντας” το οξυγόνο από τον άνθρακα) ή φύκη και άλλα φυτά (φωτοσύνθεση).
Το EFDA-JET και o ESA είναι μέλη του EIROforumw6, του εκδότη του Science in School.

Η λέξη geyser (θερμοπίδακας) προέρχεται από την αρχαία σκανδιναβική λέξη geysa, που σημαίνει αναβλύζω. Πρωτοχρησιμοποιήθηκε για το Great Geysir, μια θερμή πηγή στην κοιλάδα Haukadalur, Ισλανδία, που εκτοξεύει βραστό νερό στον αέρα έως ύψος 70 m, αλλά τώρα ο όρος χρησιμοποιείται γενικότερα για πηγές με περιοδικές εκρήξεις νερού μορφής πίδακα. Όπως υπάρχουν πίδακες βραστού νερού, υπάρχουν ψυχροί πίδακες CO2. Αναδυόμενο από τα βάθη της Γης, το αέριο συλλέγεται στον πυθμένα μιας υπόγειας δεξαμενής υδάτων και η πίεση αυξάνεται. Συνήθως εκτονώνεται με τη μορφή ενός συντριβανιού ψυχρού νερού. Ίσως υπάρχει κάποιο πιο κοντά στο σπίτι σας από ό,τι νομίζετε – για παράδειγμα στο Herl’any, στη Σλοβακία, ή στο Wallenborn και κοντά στο Andernach, στη Γερμανία.
Αν όχι, μπορείτε να φτιάξετε ένα μόνοι σας. Τοποθετήστε 200 ml νερού σε μία πλαστική φιάλη με πώμα που μπορεί να ανεβοκατεβαίνει (για παράδειγμα, μια φιάλη από υγρό απορρυπαντικό βλ. εικόνα παρακάτω), προσθέστε ένα γεμάτο κουταλάκι όξινου ανθρακικού νατρίου και ανακατέψτε καλά.

Προσθέστε περίπου 35 ml υγρού απορρυπαντικού και ανακινήστε καλά. Χρησιμοποιώντας ένα χωνί προσθέστε γρήγορα τρία γεμάτα κουταλάκια κρυσταλλικού κιτρικού οξέος. Πολύ γρήγορα, βιδώστε το κλειστό καπάκι στη φιάλη, ανακινήστε για λίγο και τραβήξτε το καπάκι προς τα πάνω για να το ανοίξετε.
Ένα συντριβάνι αφρού ψηλό έως 5 m θα εκτοξευθεί στον αέρα. Εναλλακτικά, μπορείτε να περιμένετε έως ότου το καπάκι ανοίξει μόνο του. Σε κάθε περίπτωση, μετά από λίγο, η πίεση θα μειωθεί και το συντριβάνι θα σταματήσει. Κλείστε τη φιάλη πιέζοντας το καπάκι προς τα κάτω. Μετά από 30 δευτερόλεπτα, η πίεση θα είναι πάλι αρκετά υψηλή για να ξεκινήσει ο πίδακας. Μπορείτε να το επαναλάβετε πολλές φορές.
Βασικές πληροφορίες για το CO2 (σε μορφή PDF ή Word® format)
Αληθινές ιστορίες για τις θανατηφόρες συνέπειες του διοξειδίου του άνθρακα (σε μορφή PDF ή Word®)
de Vries T (2002) Vitamintabletten einmal anders. Chemkon 9(3): 144-146. doi: 10.1002/1521-3730(200207)9:3<144::AID-CKON144>3.0.CO;2-K
Johnson S (2008) Planting ideas: climate-change activities for primary school. Science in School 10: 55-63. www.scienceinschool.org/2008/issue10/psiclimate
Shallcross D, Harrison T (2011) Is climate change all gloom and doom? Introducing stabilisation wedges. Science in School 20: 60-64. www.scienceinschool.org/2011/issue20/wedges
Αυτό το άρθρο προσφέρει απλούς τρόπους για να ξεδιαλύνει τα μυστήρια της επιστήμης. Βοηθάει τον καθένα να καταλάβει τα φυσικά φαινόμενα και γεγονότα, τόσο τα καθημερινά (αναπνοή) όσο και τα περιστασιακά (ηφαιστειακή δραστηριότητα). Μπορεί να εμπνεύσει την τάξη να αναπτύξει περαιτέρω πρακτικά πειράματα. Τόσο σε παγκόσμιο επίπεδο (κλιματική αλλαγή) όσο και σε πιο περιορισμένο (πειράματα), επιτρέπει στους μαθητές να συνειδητοποιήσουν ότι κίνδυνοι υπάρχουν και ότι είναι απαραίτητο να πάρουμε μέτρα για να τους αποφύγουμε.
Το άρθρο μπορεί να συνδυαστεί με πρόσφατα γεγονότα ή τοπικά φυσικά φαινόμενα όπως είναι οι εκρήξεις του Ισλανδικού ηφαιστείου ή οι γεωθερμικές δεξαμενές. Μπορεί επίσης να συμβάλει στην αφύπνιση της οικολογικής συνείδησης. Διαθεματικές συνδέσεις μπορούν να γίνουν μεταξύ περιβαλλοντικών και οικολογικών θεμάτων στη χημεία και στη φυσική, τη βιολογία (αναπνοή), τις γεωεπιστήμες, τα μαθηματικά (μέτρα και αναλογίες) και τη λογοτεχνία (οδηγίες και κανόνες).
Τα μικρότερα παιδιά θα λατρέψουν τα μπαλόνια και τους πίδακες. Θα συνιστούσα τις πιο εκρηκτικές δραστηριότητες για τους μεγαλύτερους μαθητές.
Maria João Lucena, Πορτογαλία