Supporting materials
Download
Download this article as a PDF

Gute Dinge kommen in Päckchen: Entdecken Sie, wie Experimente im Mikromaßstab eine große Wirkung im MINT-Unterricht haben können.
Experimente im Klassenzimmer sind notwendig, um die Aufmerksamkeit der Schüler zu wecken und wichtige chemische Prinzipien zu veranschaulichen. Herkömmliche Methoden erfordern jedoch oft große Mengen gefährlicher Reagenzien, eine komplexe Ausrüstung und viel Arbeit für die Lehrkraft oder die Schüler für den Aufbau und die Reinigung. Viele dieser Experimente können problemlos in kleinem Maßstab durchgeführt werden, ohne dass der Lerneffekt darunter leidet. Tatsächlich können mikroskalige (manchmal auch kleinskalige) Experimente sogar Effekte hervorheben, die bei der Durchführung ähnlicher Experimente in größerem Maßstab nicht sichtbar sind. In diesem Artikel wird das Prinzip der mikroskaligen Experimente im Klassenzimmer vorgestellt und es werden Gründe genannt, warum Sie es in Ihrem Klassenzimmer ausprobieren sollten.
Ich habe am CLEAPSS[1] im Vereinigten Königreich mikroskalige Verfahren entwickelt, um die Bedenken von Arbeitgebern in Schulen auszuräumen, daß die Schüler und Lehrer gefährlichen Reagenzien aussetzen sind.
In der Mikrochemie werden sehr häufig Reaktionen in Tröpfchenmengen durchgeführt. Dies kann bequem geschehen, indem Tröpfchen (0,2 bis 0,5 ml) von Lösungen auf ein Arbeitsblatt gegeben werden, das in eine durchsichtige Plastikhülle oder -mappe (bevorzugt) eingeschlossen oder laminiert ist (Korrekturen und Verbesserungen erfordern mehr Laminierung).
Abbildung 1 zeigt eine Darstellung von pH-Indikatoren und Lösungen mit unterschiedlichen pH-Werten. Dies wird von CLEAPSS in seinen Gesundheits- und Sicherheitskursen für Lehrer und Techniker im Vereinigten Königreich verwendet und die schönen Farben und die Schnelligkeit, mit der es gemacht werden kann, begeistern die Teilnehmer, die Ideen in ihre Schulen mitzunehmen.

Andere Reaktionen, einschließlich Fällungen (Abbildung 2) und Verdrängungsreaktionen, können auf ähnliche Weise durchgeführt werden. Die Reagenzien können bequem mit einer kleinen Pipette aufgetragen werden, so dass verschiedene Muster oder Trends dargestellt werden können. Die Arbeitsblätter können dann leicht abgewischt werden. Ein anderer Ansatz besteht darin, Reagenztropfen in Petrischalen zu geben (siehe Abbildung 5).
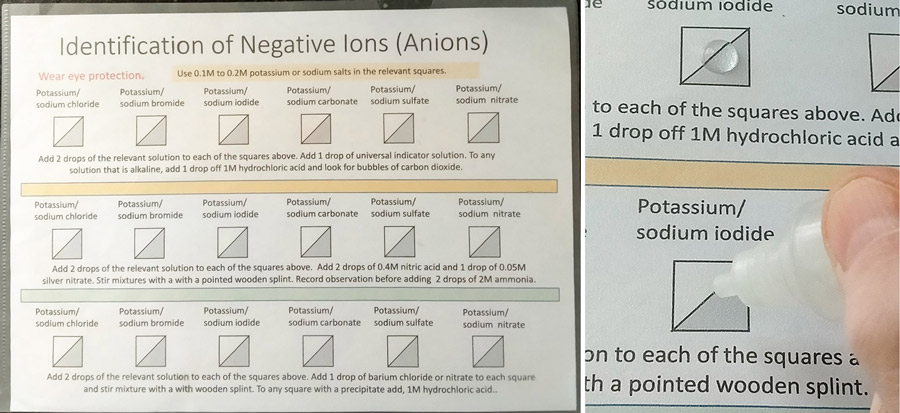
Neben der Zugabe von Lösungstropfen oder flüssigen Reagenzien können die Schüler die Lösung auch an Ort und Stelle herstellen, indem sie mit einem Zahnstocher oder einem Holzstückchen Salzkörner in ein Lösungsmittel geben. Durch das geringe Volumen erfolgt das Auflösen und Mischen sehr schnell, was an sich bereits eine hervorragende Vorführung des Auflösens, der Löslichkeit und der Diffusion sein kann.
Abbildung 3 zeigt, was passiert, wenn winzige Körnchen von Kupfer(II)-sulfat und Natriumcarbonat auf beide Seiten eines Tropfens destillierten Wassers gegeben werden. Die beiden ionischen Feststoffe lösen sich auf und diffundieren durch das Wasser, und in der Mitte des Tropfens, wo sich die Kupfer- und Carbonat-Ionen treffen, bildet sich ein Strich aus basischem Kupfercarbonat-Niederschlag.

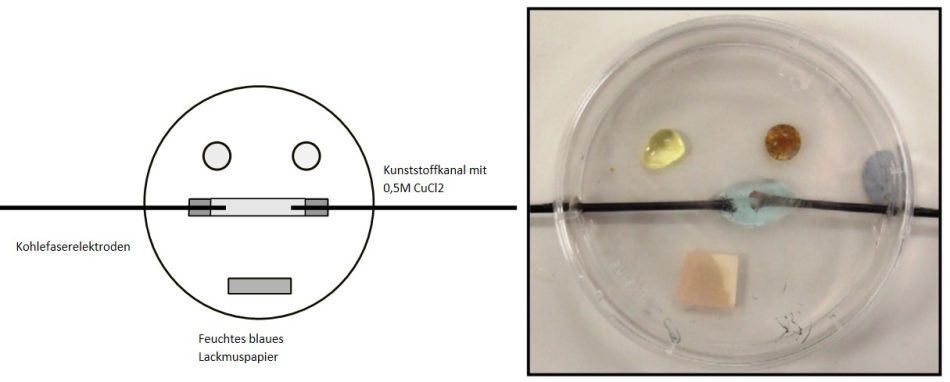
Die Tropfen können auch mit einem Leitfähigkeitsindikator versehen werden, um das Vorhandensein von Ionen und die Elektrolyse nachzuweisen (Abbildung 4).

Idealerweise sollte die mikroskalige Version mehr Informationen für Unterrichtszwecke liefern als die traditionelle Form des Experiments.
Die Verwendung von Flüssigkeitstropfen auf einer Kunststoffoberfläche beruht auf der Oberflächenspannung, die bei wässrigen Lösungen gut funktioniert, bei organischen Flüssigkeiten jedoch nicht. Außerdem werden viele Kunststoffe durch organische Lösungsmittel wie Ketone und Ester aufgeweicht. Daher werden für organische Lösungsmittel kleine Glasfläschchen, Porzellanteller oder Reagenzgläser benötigt.
Das Beheizen kann ein Problem darstellen, aber Flüssigkeiten können in ein Glasfläschchen gegeben werden, das mit kochendem Wasser aus einem Wasserkocher umgeben ist, oder sie können auf eine Heizplatte oder einen speziell entwickelten Heizer gestellt werden[2]
Dieser Ansatz hat viele Vorteile, von denen die wichtigsten im Folgenden zusammengefasst werden.
Im Hinblick auf die Sicherheit liegen die Vorteile der Verwendung kleinerer Mengen von Reagenzien auf der Hand. Dies gilt insbesondere für flüchtige Chemikalien, bei denen die Konzentration giftiger Gase in der Luft viel geringer ist, wenn die Schüler nur Tröpfchenmengen verwenden. Ein hervorragendes Beispiel hierfür ist die Elektrolyse von Natriumchlorid oder Kupfer(II)-chlorid, bei der giftiges Chlorgas entsteht, das zu Atembeschwerden führen kann. Einige Arbeitgeber wollten, dass diese Tätigkeit gestrichen wird, obwohl sie in den Lehrplänen für die Prüfungen vorgesehen war. CLEAPSS war jedoch in der Lage, eine Ausrüstung zu entwickeln, mit der dieses Experiment in kleinerem Maßstab durchgeführt werden kann (Abbildung 5), und in diesem Fall werden nur 5 bis 6 cm3 Chlorgas erzeugt.

Einige Lehrer befürchten, dass die Schüler benachteiligt werden, wenn der Versuchsaufbau nicht mit dem in den Prüfungen verwendeten übereinstimmt. Diesem Problem kann jedoch in der Regel mit einem Diagramm begegnet werden, das die Gleichwertigkeit mit den klassischen Experimenten in größerem Maßstab deutlich macht. Bei dem oben beschriebenen Elektrolyse-Experiment war ein Lehrer beispielsweise der Meinung, dass die Mikroelektrolyse gut war, aber er war besorgt darüber, dass der Aufbau nicht der in den Lehrbüchern und Prüfungsfragen gezeigten Apparatur entsprach. Der geistesgegenwärtige Techniker zeichnete ein “horizontales Becherglas” auf Papier und positionierte die Elektroden neu, und der Lehrer war zufrieden.
Vielleicht weniger offensichtlich als die praktischen Vorteile in Bezug auf Bequemlichkeit und Sicherheit sind die Vorteile von Experimenten, die schnell und einfach durchzuführen sind. Dadurch wird das Kurzzeitgedächtnis der Schüler weniger belastet und sie können sich besser auf das spannende Experiment und die dahinter stehende Wissenschaft einlassen. Die Art des mikroskaligen Experiments kann auch das Verständnis der wissenschaftlichen Prinzipien erleichtern. Bei dem oben gezeigten Experiment zur Ausfällung von Kupferkarbonat sehen die Schüler zum Beispiel, wie die Feststoffe hinzugefügt werden, und verstehen, wie sie sich auflösen und dann in der Mitte zusammenkommen. Beim Mischen zweier vom Lehrer vorbereiteter Lösungen hingegen kann es wie Zauberei erscheinen, wenn plötzlich ein fester Niederschlag entsteht.
Es gibt noch so viel mehr. Wenn dieser Artikel Ihr Interesse geweckt hat, empfehle ich Ihnen, sich den Vortrag anzusehen, den Adrian Allan und ich kürzlich bei Science on Stage zusammen mit dem anderen Video im Ressourcenteil. In den nächsten Ausgaben von Science in School werden weitere Lernstoffartikel mit Schritt-für-Schritt-Anleitungen zur Durchführung einiger dieser Mikroexperimente veröffentlicht, zusammen mit druckbaren Anleitungen.
[1] Eine Einführung in CLEAPSS: http://science.cleapss.org.uk/Policies/What-Is-Cleapss.aspx
[2] Allan A, Worley B, Owen M (2018) Perfumes with a pop: aroma chemistry with essential oils. Science in School 44:40–46.
[3] Mehr Information zum RADMASTE Mikrowissenschaftsprojekt: https://www.radmaste.org.za/
[4] Science on Stage bringt MINT-Lehrkräfte mit hervorragenden Unterrichtsideen zusammen: https://www.science-on-stage.eu/
Download this article as a PDF