Infektiöse Tumoren: die Geschichte der DNA Understand article
Übersetzt von Korinna Kochinke. Was veranlasst eine Zelle, kanzerogen zu werden – und wie wird ein Tumor infektiös? In dem zweiten Artikel zu übertragbaren Tumoren erklärt uns Elizabeth Murchison, was uns die genetischen Details verraten.

Mit freundlicher Genehmigung
von Wayne McLean/Wikipedia
Dr. Elizabeth Murchison beschreibt ihre Arbeit als ‚molekulare Archäologie’: anstelle von alten Steinen und Knochen untersucht sie minutiös die Details an DNS-Molekülen, und versucht die Schlüsselmutationen zu identifizieren, die die Natur der Zellen verändert haben.
Das Ziel von Dr. Murchison ist es, die Geschichte zu erzählen, wie eine besonders garstige Krankheit – Devil Facial Tumour Disease’ (Teufelsgesichtstumorkrankheit, DFTD) – entstanden ist und sich ausgebreitet hat. Diese infektiöse Krankheit wird nicht von Viren oder Bakterien verursacht, sondern von Tumorzellen, die die Eigenschaft erlangt haben, von einem Individuum zum nächsten übertragen werden zu können, und dabei fatale Tumoren in jedem neuen Wirt erzeugen. Zwar wird sie nicht auf Menschen übertragen, aber DFTD ist so virulent, dass sie bereits droht die Tierart, in der sie vorkommt, den Tasmanischen Beutelteufel, auszurotten, obgleich sie erst in den letzten Jahrzehnten entstanden ist.
Archäologischer Krebs
Die Nukelotidsequenz des heutigen DFTD-Tumors ist praktisch eine archäologische Aufzeichnung, die sich aus dem Genome des ursprünglichen DFTD-Tumors von vor 30 Jahren und den darin seitdem akkumulierten Mutationen zusammensetzt. „Als molekularer Archäologe setzen wir die genomischen Varianten, die wir heute finden, zusammen, und versuchen herauszufinden, welche im ursprünglichen Teufels-Tumor und welche erst später auftraten,“ sagt Dr. Murchison.
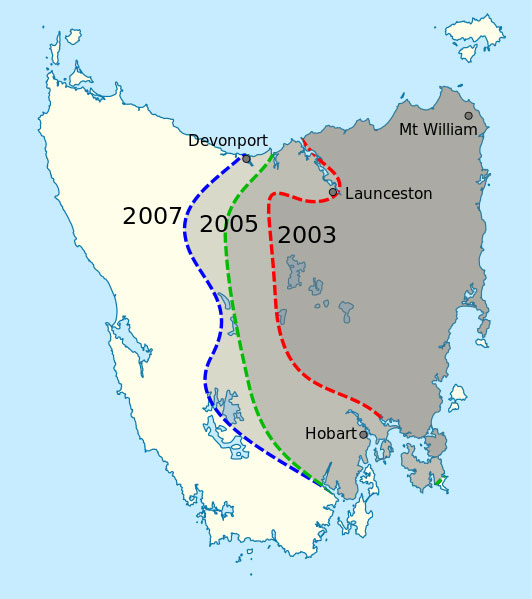
Ausbreitung von DFTD in
Tasmanien in 2007.
Public Domain Bild; Bildquelle:
Wikipedia
Alle Krebsarten – nicht nur die übertragbaren – entstehen, wenn eine Zelle Mutationen anhäuft. Jedes Mal, wenn eine Zelle sich teilt und die DNS kopiert, besteht die Chance, dass dabei eine Mutation entsteht. Andere Mutationen entstehen als Folge von Karzinogenen – zum Beispiel durch Zigarettenrauch oder Infektion mit dem Humanen Papillomvirus (HPV). Einige Mutationen, die das Risiko der Krebsentstehung erhöhen, können auch vererbt werden, wie zum Beispiel das Gen BRCA1, das mit Brustkrebs assoziiert wird.
Typischerweise haben Zellen humaner Tumoren in ihrer DNS zwischen 1000 und 5000 Mutationen durchlaufen, obgleich diese Zahl auf mehr als 100 000 ansteigen kann, falls ein Individuum einem Karzinogen über einen längeren Zeitraum ausgesetzt worden war.
Überraschend wenige Mutationen
Zu Beginn schätzten Dr. Murchison und ihr Team die Anzahl der im DFTD-Tumor vorkommenden Mutationen weitaus höher ein als die in menschlichen Krebsarten, aufgrund der außergewöhnlichen Eigenschaften und der Seltenheit übertragbarer Tumore – aber dies ist nicht der Fall. „Wir haben errechnet, dass DFTD um die 20 000 Mutationen hat, was unter dem Wert für manche humanen Krebsarten liegt,“ sagt sie. „Dies legt nahe, dass ein Krebs, um übertragbar zu sein, keine enorme Anzahl an Mutationen bedarf – allein auf die Schlüsselmutationen, die es dem Krebs erlauben sich zu verbreiten und im Wirt zu überleben, kommt es an.“
Das Team versucht nun, diese Schlüsselmutationen ausfindig zu machen. Die erste Herausforderung war es, die genetische Information des gesunden Tasmanischen Teufels zu erarbeiten, um diese zum Vergleich mit Tumor-DNS heranziehen zu können. „Wir mussten zunächst das Genom des Tasmanischen Teufels sequenzieren, da es bislang kein Referenzgenom gab,“ sagt Dr. Murchison. „Wenn wir allein die Gene eines DFTD-Tumors sequenziert hätten, hätten wir niemals wissen können, welche Gene mutiert und welche normal waren.“ Dies war eine Herausforderung in sich selbst, dem Unterfangen, das menschliche Referenzgenom zu erstellen, nicht unähnlichw1.
Der nächste Schritt – der Vergleich der DNA von DFTD-Tumoren mit dem Referenzgenom – war auch nicht so einfach, wie er klingt. Da sich die Krankheit in den 1980er Jahren entwickelte, ist es schwierig zu entscheiden, ob eine genetische Variation, welche man beim Vergleich des Referenzgenoms mit einem spezifischen DFTD-Tumor findet, von dem ursprünglichen Tumor stammt oder in den vergangenen 30 Jahren entwickelt wurde. Um die ursprünglichen Mutationen, welche es der Krankheit ermöglichten sich zu verbreiten, von den später akkumulierten zu unterscheiden, führt das Team nun einen ‚big screen’ durch, bei dem es DNS von hunderten normalen Tasmanischer Teufeln sequenziert und mit der DNS von hunderten von DFTD-Tumoren vergleicht.
Bislang haben die Ergebnisse gezeigt, dass der ursprüngliche Tumor in einem weiblichen Beutelteufel aufgetreten ist, denn das Tumorgenom besitzt zwei unterscheidbare X-Chromosomen. Die genetische Basis einer entscheidenden Veränderung wurde auch schon identifiziert: die Fähigkeit des Tumors, sich vor dem Immunsystem des neuen Wirts zu verstecken, beruht darauf, dass ein Gen, welches das molekulare Signal der ‚Freund-Feind-Erkennung’ in normalen Zellen produziert, unterdrückt wird. Zusammen mit der Tatsache, dass die Population der Beutelteufel genetisch sehr ähnlich ist, erklärt dieses Ergebnis, warum Zellen des einen Individuums in einem anderen wachsen können, ohne das Immunsystem zu aktivieren. Diese Entdeckung wird bereits bei der Entwicklung eines Impfstoffes gegen DFTD berücksichtigt. Die Forschung hat außerdem bereits herausgefunden, wie der DFTD-Tumor während seines Ausbreitens über Tasmanien evolviert ist, und konnten bereits verschiedene genetische Subtypen identifizieren.
Dr. Murchison bezieht außerdem die einzige andere übertragbare Krebsart in ihre Forschung mit ein: das Sticker-Sarkom (engl. Canine transmissible venereal tumor, CTVT), welcher in Hunden vorkommt. Für diese Krebsart will sie, ebenso wie für DFTD, die genetischen Profile der Tiere erarbeiten, in denen der Krebs das erste mal entstand, um dann den evolutionären Weg des Tumors zu erschließen (siehe Kasten).
Die Genetik des Sticker-Sarkoms
Anhand von genetischer Analyse konnte man herausfinden, dass das heutige Sticker-Sarkom einen gemeinsamen Vorfahren hat – welcher vor 11 000 das erste Mal auftrat. Aufgrund dieser Analyse ist es außerdem möglich das Aussehen des Hundes, in dem das erste Mal das Sticker-Sarkom auftrat, zu skizzieren, wie in dem Entwurf gezeigt.
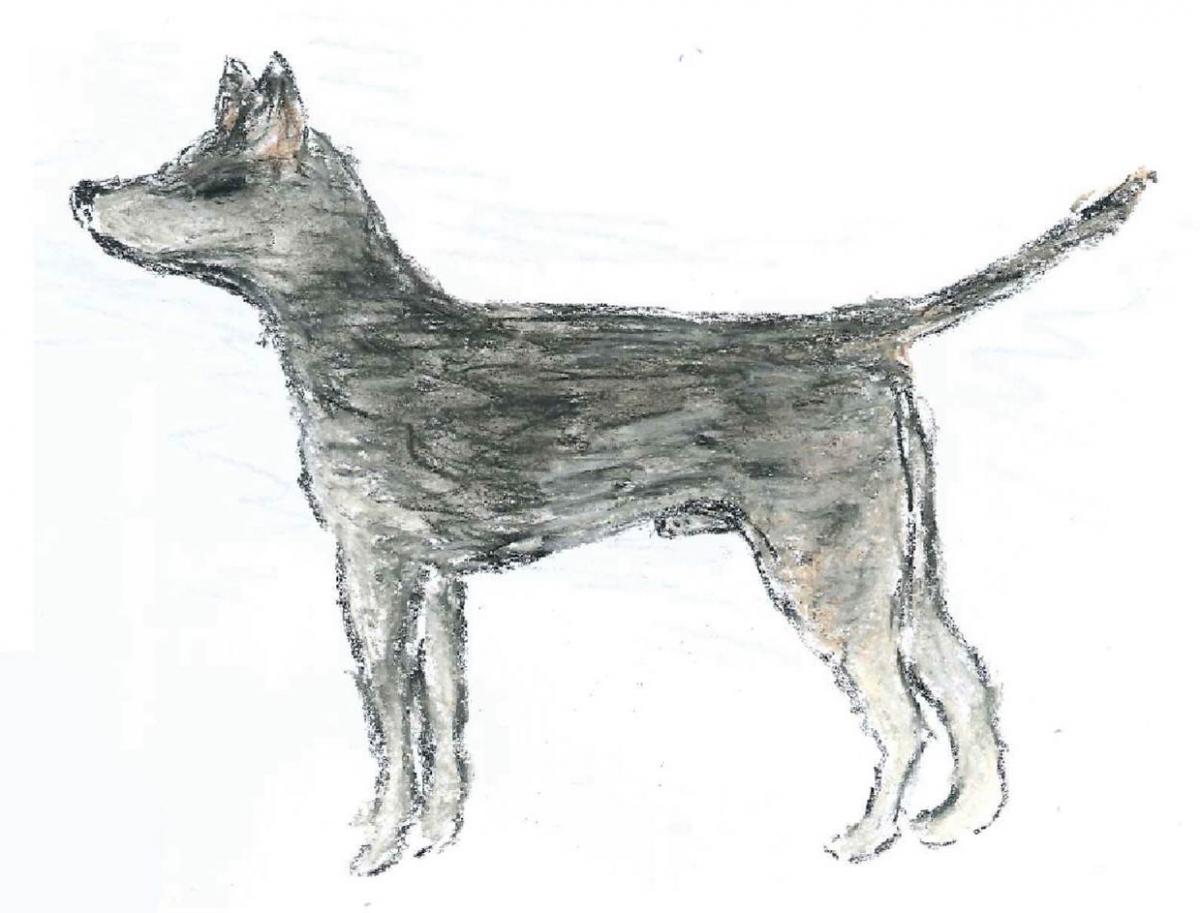
Mit freundlicher Genehmigung von Emma Werner
|
Gene Name |
Assoziierte physische Merkmale |
|---|---|
|
ASIP |
Agouti’ (gemischte) Fellfarbe |
|
CBD103 |
Eventuell schwarze Fellfarbe |
|
KRT71 |
Glattes oder welliges Haar |
|
FGF5 |
Kurzes Haar |
|
IGF1 |
Mittelgroß oder groß |
|
BMP3 |
Eventuell spitze Schnauze |
|
MGAM |
Angepasst an Stärke- oder Fleisch-Diät |
Kampf ums Überleben
In Tasmanien verlassen sich die Leute, die für den Erhalt des Tasmanischen Teufels kämpfen, nicht alleine auf den Forschungsaufwand, um mit der Bedrohung des DFTDs fertig zu werden. Ein Artenschutzprogramm ist ins Leben gerufen worden um eine neue Population gesunder, uninfizierter Beutelteufel auf ihrer eigenen kleinen Insel zu etablieren, getrennt von der Hauptpopulation. Während also das wissenschaftliche Bemühen weitergeht, die verheerende Krankheit zu verstehen, sieht die Zukunft des wilden kleinen Tieres wieder ein kleines bisschen rosiger aus. „Wir verfolgen alle ein klares gemeinsames Ziel, in dem wir versuchen etwas zu tun, um dem Beutelteufel zu helfen,“ sagt Dr. Murchison.
Web References
- w1 – Das humane Referenzgenom ist vom Human Genome Project etabliert worden. Weitere Information kann auf der Webseite des Projekts gefunden werden.
Resources
- Für eine Einführung in das Thema DFTD lies den ersten der beiden Science in School-Artikel:
- Watt S (2015) Infectious cancers. Science in School 32: 6–9.
- Lies hier mehr über DFTD und die Bemühungen, den Beutelteufel zu retten.
- Schaut Euch einen kurzen Vortrag von Dr. Elizabeth Murchison an, in dem sie ihre Arbeit einer breiten Öffentlichkeit erklärt (auf englisch).
- Ein weiterer Artikel über infektiöse Tumoren ist dieser:
- Giles C (2010) Sympathy for the devil. Wellcome News 62: 8–9
- Diese Ausgabe von Wellcome News kann von der Wellcome Trust website heruntergeladen werden.
Review
Der zweite Teil der DFTD-Story konzentriert sich auf die Genetik des übertragbaren Krebs. DFTD ist eine verheerende Krankheit, die die Population der Tasmanischen Beutelteufel dezimiert.
Der Artikel kann als Basis genutzt werden, um einige interessante Topics zu ergründen, wie zum Beispiel ‚molekulare Archäologie’, Sequenzierung von DNS/Genomen und der immunologische Aspekt von normalen und übertragbaren Krebs. Eine eventuell noch interessantere Idee wird im letzten Abschnitt des Artikels aufgegriffen, der eine Schutzstrategie für den Beutelteufel beschreibt. Dieser Abschnitt könnte dazu genutzt werden, um ethische Anliegen und Grenzen von Naturschutzbestrebungen zu diskutieren:
- Sollten Menschen in einen natürlichen Selektionsprozess eingreifen?
Umgekehrt, sollten Menschen versuchen eine Art zu retten, die durch natürliche Ursachen bedroht wird?
- Haben wir, vor dem Hintergrund von Darwins Entdeckungen über die Galapagos-Finken, ein Recht dazu, eine Gruppe von Individuen auszusuchen und diese von der Hauptpopulation zu trennen? Welche Konsequenzen können einer Art drohen, wenn man Populationen von ihr reproduktiv isoliert?
Wie bereits der Artikel zuvor stimuliert auch dieser Biologielehrer/innen ihr Wissen in diesen Gebieten zu vertiefen.
Luis M. Aires, Antonio Gedeao Gymnasium, Portugal





