Supporting materials
Download
Download this article as a PDF

Übersetzt von Veronika Ebert. Die europäischen Länder sind für mehr als die Hälfte der weltweiten Weinproduktion verantwortlich – und trinken auch eine Menge davon! Die folgenden praktischen Unterrichtsaktivitäten beleuchten den naturwissenschaftlichen Hintergrund eines perfekten Weins.

Das Alter, ab dem es erlaubt ist, Alkohol zu trinken variiert von Land zu Land, aber die meisten Lehrkräfte würden zustimmen, dass es unpassend, und möglicherweise auch gefährlich) wäre, während der Chemiestunden Wein zu trinken. Dennoch kann die Herstellung und Analyse von Wein in der Schule Freude bereiten und zur Bildung beitragen. Die Aufgabenstellungen, die vom Science Center Experimentaw1 entwickelt worden sind, laden 15-18-jährige Schüler/innen ein, einen Tag lang Winzer/in zu sein, und analytische Techniken anzuwenden, mit denen die Veränderungen während der Weinherstellung verfolgt werden können.
Wein wird durch Vergärung von Traubensaft, der besonders viel Zucker enthält, mit Hilfe spezialisierter Hefezellen erzeugt. Der Zucker wird unter anaeroben Bedingungen (=Ausschluss von Sauerstoff) in Ethanol und Kohlendioxid umgewandelt.
C6H12O6 + 2 ADP + 2 Pi = 2 C2H5OH + 2 CO2 + 2 ATP
Die Experimentaw1 in Heilbronn ist das größte informelle interaktive Lern- und Wissenschaftszentrum in Süddeutschland. Die Experimenta bietet nicht nur interaktive Ausstellungen, sondern auch mehr als 30 Laborprogramme für Schulklassen und einzelne Schüler/innen an, von Kindergartenniveau bis zu höheren Klassen der Sekundarstufe. Die Programme beschäftigen sich mit Technik, und allen Formen der Lebenswissenschaften, es werden auch Seminare für Lehrkräfte angeboten.

Die drei Hauptfaktoren für die Qualität des Endprodukts sind: Süße, Alkoholgehalt und Säuregehalt. Die drei Aufgabenstellungen für Schullabors nutzen Standardmethoden, kommerzieller Weinlaboratorien, um zu untersuchen, wie sich die Qualität des ursprünglichen Traubensafts und des Mosts (= gärender Traubensaft) auf das Endprodukt auswirkt. Die Bearbeitung jeder Aufgabenstellung dauert etwa 20-30 Minuten.


Vier weitere Aufgabenstellungen sind online abrufbarw2:
Zur Gewinnung des für diese Experimente erforderlichen Mosts reicht es aus, einen Tag davor den z.B. im Supermarkt gekauften Saft roter Trauben vergären zu lassen. Außerdem werden einige einfache chemische Laborgeräte benötigt, dazu eine Weinwaage zur Messung des Alkoholgehalts, ein Pyknometer (Geräte zur Dichtemessung) und ein Refraktometer. Eine Anleitung zum Ansetzen der Gärung ist ebenfalls herunterladbarw2.

Die Süße des Weins hängt von der Zuckermenge, die nach der Gärung noch vorhanden ist, und vom Gesamtsäuregehalt ab. Ein trockener Wein hat bis zu 9g/L Zucker und einen um mindestens 2g/l geringeren Säuregehalt. Ein halbtrockener Wein hat einen Zuckergehalt von 9-18g/l und einen nicht mehr als 10g/l geringeren Säuregehalt. Ein süßer Wein enthält 18-45g Zucker pro Liter. Um die richtige Balance zwischen Zucker, Säuregehalt und Alkoholgehalt im Endprodukt zu erhalten, ist es erforderlich, die Ausgangskonzentration an Zucker zu bestimmen. Wenn nötig, können vor der Vergärung begrenzte Mengen Zucker zugesetzt werden.
Die – im Vergleich zu Wasser – erhöhte Dichte des Mosts ist vor allem auf den Gehalt an vergärbaren Zuckern zurück zu führen. Zur Ermittlung des Zuckergehalts kann eine Dichtemessung durchgeführt werden, oder der Brechungsindexes refraktometrisch bestimmt werden. In Deutschland wird dieser Wert als „Mostgewicht“ bezeichnet, und in Oechsle gemessen (°Oe). Im angloamerikanischen Raum wird der Wert in Brix (°Bx) angegeben, der die Konzentration des gelösten Zuckers in Massenprozent angibt (m%).
Das Mostgewicht wird mit folgender Formel errechnet:
Mostgewicht = (Dichte-1) x 1000
Angabe des Mostgewichts in °Oe und Dichte in g/l.
Für eine grobe Abschätzung kann man 1°Oe mit 2,37g/L Zucker gleich setzen (das entspricht 0.237 °Bx).Daher kann der Zuckergehalt wie folgt errechnet werden:
Zuckergehalt = Mostgewicht x 2,37
Angabe des Zuckergehalt in g/l.
Die Umsetzung aller vergärbaren Zucker in eine Lösung mit 100 °Oe (Zuckergehalt 237 g/l oder 23,7 °Bx) ergibt ungefähr 100g/l, oder 10 w% Ethanol. Da Ethanol eine Dichte von 0,79g/mL hat, entspricht das 12,67 Volumprozent.
Alkoholgehalt (in Volumprozent) = Alkoholgehalt (in g/L) x 0,1267
Die Menge des Zuckers im Traubensaft ist sowohl für den Alkoholgehalt als auch für die Süße des fertigen Weins verantwortlich. Bei dieser Aufgabe kannst du den Brechungsindex zur Abschätzung des Zuckergehalts heranziehen.
Unter Lichtbrechung versteht man die Ablenkung des Lichts beim Übertritt von einem optisch dichten Medium in ein weniger dichtes, oder umgekehrt, z.B. von Luft zu Wasser. Das Ausmaß der Lichtbrechung hängt von der Menge an gelösten Stoffen ab. Ein Refraktometer verwendet dieses Prinzip zur Bestimmung der Konzentration gelöster Stoffe. In Wein ist das vor allem Saccharose.
Die meisten Handrefraktometer geben die Konzentration gelöster Stoffe entweder in Brix (°Bx; womit im Prinzip der Saccharosegehalt angegeben wird) oder in Oechsle (°Oe) an. Eine Lösung mit 20 Massenprozent Saccharose entspricht 20 °Bx. Der Oechsle-Wert kann durch Multiplikation mit 0,237 annäherungsweise in Brix umgerechnet werden.

| 20% (w%) Saccharose | Traubensaft | |
|---|---|---|
| Mostwaage (°Oe) | ||
| Zuckerkonzentration (°Bx) | ||
| Mögliche Ausbeute an Ethanol (vol%) |
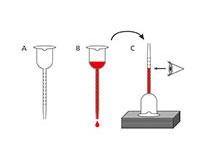
Die Menge des während der Gärung gebildeten Alkohols hängt vom Zuckergehalt des Traubensafts und der Alkoholtoleranz des Hefestammes ab: die meisten Hefestämme tolerieren bis zu 16% Alkohol. Der Alkoholgehalt kann mit einem Vinometer, einem einfache Gerät, das für Hobbywinzer entwickelt worden, recht zuverlässig bestimmt werden. Dabei wird das Prinzip, dass die Oberflächenspannung mit zunehmender Alkoholkonzentration sinkt, ausgenutzt.
Bei dieser Aufgabe wirst du den Alkoholgehalt des Mosts bestimmen.
| Alkoholgehalt (vol%) | |
|---|---|
| Most (filtriert) | |
| Wein |
Anmerkung: Der Alkoholgehalt des Mosts ist wahrscheinlich viel niedriger als jener des Weins. Das liegt vermutlich daran, dass die Gärung noch nicht abgeschlossen ist. Es ist aber auch möglich, dass der noch vorhandene Zucker die Oberflächenspannung vergrößert, und dadurch den Messwert verfälscht.

Fruchtsäfte können – in Abhängigkeit von der Fruchtsorte – mehrere unterschiedliche Säuren, darunter Weinsäure und Apfelsäure, enthalten. Im Wein dominiert die Weinsäure, die einen pH-Wert von 3 bis 4 aufweist. Da der pH-Wert des Weins von einer komplexen Mischung aus verschiedenen Säuren, Basen, Proteinen und Salzen beeinflusst wird, kann der Gesamtsäuregehalt nicht nur aus dem pH-Wert ermittelt werden. Stattdessen wird bis zum Neutralpunkt titriert, und der Gesamtsäuregehalt als Äquivalent der Weinsäure in g/L angegeben. Der Säuregehalt von Wein beträgt üblicherweise zwischen 4 und 8,5g/l, kann aber bis zu 15 g/l betragen. Er muss immer in Verbindung mit dem Restzuckergehalt betrachtet werden (siehe „Bestimmung des Zuckergehalts“).
Weinsäure (Molekulargewicht 150 g) ist eine zweiprotonige Säure, d.h. sie verfügt über zwei Wasserstoffatome pro Molekül, die als Protonen ins Wasser diffundieren können. Sie kann durch Natronlauge vollständig neutralisiert werden. Da 1 mol NaOH 0,5 mol Weinsäure (75g/l) neutralisieren kann, neutralisiert 1 ml einer 0,1 mol/l NaOH 7,5 mg Weinsäure.
HOOC-CH(OH)-CH(OH)-COOH + 2NaOH → Na+-OOC-CH(OH)-CH(OH)-COO– Na+ + 2H2O
Alle Weine haben einen bestimmten Säuregehalt. Für den Winzer/die Winzerin ist der Gesamtsäuregehalt interessant, der in erster Linie von der Weinsäure verursacht wird. Der Gesamtsäuregehalt wird durch Titration mit verdünnter Natronlauge bestimmt.
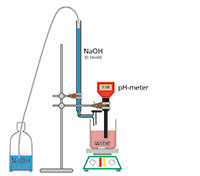
Für jede Probe (Most oder Wein):
Beispiel: 14 ml 0,1 mol/l NaOH neutralisierten 10 ml Lösung. Die Konzentration beträgt daher (14 x 7,5 mg/ml x 100) = 10,5 g/l Säure.
| Most | Wein | |
|---|---|---|
| pH-Wert zu Beginn | ||
| Füllstand der NaOH (ml) zu Beginn | ||
| Füllstand der NaOH (ml) am Ende | ||
| Verbrauch der NaOH (ml) | ||
| Konzentration der Säure (g/l) |
Schutzbrille und Handschuhe tragen. Allgemeine Sicherheitshinweise berücksichtigen.

Mit den Aufgaben 1-3 konntest du drei wichtige Qualitätskriterien des Endprodukts untersuchen: Süße, Alkoholgehalt und Säuregehalt. Nun ist es an der Zeit, die Qualität des Produkts zu beurteilen.
Der Autor dankt den Weinlaboratorien der Fa. Pfäffle GmbH in Heilbronn, Deutschland, für die Unterstützung bei der Entwicklung der Aufgabenstellungen. Dank für die Zusammenarbeit vor allem an Christine Dietrich and Karsten Wiese vom Lehrerausbildungskolleg in Heilbronn.
Schmitt A (1975) Aktuelle Weinanalytik, Ein Leitfaden für die Praxis. Germany: Heller Chemie. ISBN: 978-3-9800498-3-2
Download this article as a PDF