Stärke: Geheimnisse der Struktur Understand article
Übersetzt von Veronika Ebert, Höhere Bundeslehr- und versuchsanstalt für chemische Industrie, Wien. Der Strang eines Glukosemoleküls: klingt simpel, ist es aber nicht. Dominique Cornuéjols und Serge Pérez Pérez untersuchen die Komplexizität dieser Struktur – und zeigen, dass das…

von Dietmar Klement /
iStockphoto
Nimm eine Handvoll Spaghetti und wirf sie ins kochende Wasser. Die starren Stäbchen werden rasch weicher und biegen sich sanft beim Quellen.
Wir finden dieses Verhalten der Nudeln in heißem Wasser ganz normal, aber wie verändert sich die Feinstruktur der Spaghetti, die zu einer so dramatischen Veränderung führt, genau?
Die Antwort beginnt damit, dass Nudeln – genauso wie Reis, Kartoffeln oder Brot – große Mengen Stärke enthalten. Aber was ist Stärke? Stärkekörner werden von Pflanzen bei der Fotosynthese aus Kohlendioxid hergestellt. Chemisch ist Stärke ein Polymer von Glukose, sie dient der Energiespeicherung. Stärke akkumuliert gegen Ende der Wachstumsperiode in den Ästen der Bäume, in der Nähe der Blattknospen. Sie kommt auch in Früchten, Samen, Rhizomen und Knollen vor. Da Stärkekörner sehr kompakt, relativ trocken und sehr stabil sind, eignen sie sich sehr gut als Langzeitspeicher.
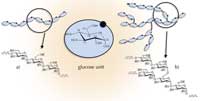
von Amylose (a) und
Amylopektin (b). Zum
Vergrößern auf das Bild
klicken
Mit freundlicher Genehmigung
von Serge Pérez, ESRF
Diese wichtige Energiequelle kann vom Menschen allerdings nur genutzt werden, wenn sie durch Hitze aufgeschlossen ist, weil Stärkekörner so kompakt sind, dass sie praktisch unverdaulich sind. Stärke muss gekocht werden, um ihre Verdaulichkeit zu verbessern – nach einmaliger Erhitzung ist wird sie wasserlöslich und genießbar.
Die Umwandlung von roher Stärke in heißem Wasser nennt man Verkleisterung: die Körner quellen, platzen auf und bilden einen Kleister. Bei Abkühlung und längerer Lagerung wird der Kleister durch den Prozess der „Retrogradation“ wieder zähflüssiger. Verkleisterung und Retrogradation gehen mit strukturellen Veränderungen der Körner einher und beeinflussen die Eigenschaften von Stärke-haltigen Systemen.
Daraus folgt, dass sich Stärke hervorragend eignet, um die Textur vieler zu Hause zubereiteter und industriell verarbeiteter Lebensmittel zu modifizieren (z.B. Getreide- oder Maismehl als Verdickungsmittel für Saucen). Stärke wurde außerdem jahrhundertelang für andere Zwecke verwendet, zum Beispiel bei der Papierherstellung zur Verleimung, als Klebemittel oder als Textilverstärker. Heutzutage eröffnen sich neuer Anwendungsmöglichkeiten für Stärke, wie z.B. als Ballaststoff mit geringem Nährwert, für dünne Filme und thermoplastische Materialen.
Forschung: langsame Fortschritte
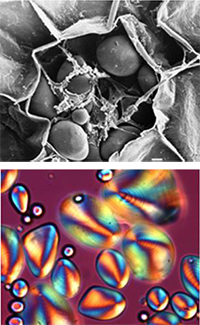
Stärkekorn,
rasterelektronenmikroskopische
Aufnahme; b) die
entsprechende Stärke unter
polarisiertem Licht
Mit freundlicher Genehmigung
von Serge Pérez, ESRF
Die industrielle Verwendung von Stärke ist daher weit verbreitet, genauso wie vor tausenden von Jahren. Die wissenschaftliche Untersuchung von Stärke begann im Jahr 1833, als der französische Chemiker Anselme Payen herausfand, dass Stärke aus Glukoseeinheiten aufgebaut ist. Trotzdem sind die biochemischen Eigenschaften und die genaue Struktur bis heute nicht genau erforscht. Auf molekularer Ebene weiß man, dass native (in der natürlich vorkommenden Form) Stärke aus zwei unterschiedlichen Komponenten aufgebaut ist, Amylose und Amylopektin. Diese beiden Komponenten können durch Fraktionierung isoliert, und unabhängig voneinander untersucht werden.
Sowohl Amylose als auch Amylopektin sind Glukosepolymere, die sich nur durch die Art der Kettenbildung unterscheiden: Amylose ist überwiegend linear, die Glukoseeinheiten sind durch (1-4)-Verbindungen verknüpft (Abbildung a1), während bei Amylopektin (1-6)-Verbindungen für die stark verzweigte, sehr dichte Struktur verantwortlich sind (Abbildung 1b). Amylopektin kann aus bis zu hunderttausend Glukoseresten bestehen, und ist das größte bekannte Biomakromolekül.
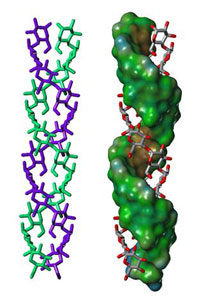
Struktur des Amylopektins
Mit freundlicher Genehmigung
von Serge Pérez, ESRF
Natürlich vorkommende Stärkekörner unterscheiden sich sehr stark in Form und Größe (von 0,1 bis 200µm), haben aber dennoch gemeinsame Charakteristika: bei Verwendung eines Mikroskops mit polarisiertem Licht zeigt sich – nach Einfärbung mit Jod – ein charakteristisches Malteserkreuz (in Abbildung 2b als orange Struktur erkennbar). Dies deutet auf einen einheitlichen inneren Aufbau hin. Bei der Erhitzung in größeren Mengen heißen Wassers (z.B. wenn Spaghetti gekocht werden), verschwindet das Polarisationskreuz, ein Hinweis darauf, dass diese molekulare Struktur zerstört worden ist.
Die physikalischen Eigenschaften von Stärke – ihre Festigkeit und Phasenveränderungen, wenn z.B. Stärkekörner in ein Gel umgewandelt werden, oder spröde Nudeln weich werden – haben direkt mit dieser molekularen Anordnung zu tun. Um allerdings die genauen Strukturen der Stärke aufzuklären, benötigt man hochmoderne Forschungsgeräte und – techniken, wie Röntgenstrukturanalyse, Elektronenmikroskopie, Kernspinresonanz und Computermodellierungen.
Mit Hilfe dieser Werkzeuge gelingt es den Wissenschaftler/innen langsam, ein klareres Bild über den Aufbau von Stärke, die für uns so alltäglich ist, zu gewinnen.
Beginn im Nanomaßstab: Doppelhelices, Lamellen und Superspiralen
Untersuchungen mit Röntgenstrukturanalyse zeigen, dass
- Stärke aus dünnen Lamellen aufgebaut sind (etwa 4,5 nm dick)
- Jede Lamelle aus etwa 100 doppelsträngigen Helices (Schrauben) aufgebaut ist, die aus jeweils 20 Glukoseeinheiten bestehen (Abbildung 3)
- Die Doppelhelices sehr dicht gepackt sind, mit einem hohen Ordnungsgrad, wie in einem Kristall (kursive Begriffe sind im Glossar sind im Glossar erklärt).
(Wie Kristallstrukturen mit Röntgenstrukturanalyse aufgeklärt werden können, kann bei Cornuéjols, 2009.)
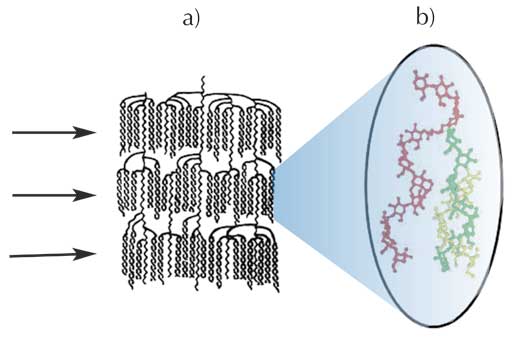
b) mögliche Verbindung zwischen einer Amylosekette (rot) und Amylopektin-Doppelhelices (grün und gelb)
Mit freundlicher Genehmigung von Serge Pérez, ESRF

Modell für die superhelikale
Struktur
Mit freundlicher Genehmigung
von Serge Pérez, ESRF
Diese Röntgenstrukturanalysedaten erhärten biochemische Befunde über das Amylopektinmolekül, bei denen gezeigt werden konnte, dass dieses riesige Molekül aus kristallinen Clustern von Doppelhelices besteht (Abbildung 4a): die Lamellen, die bei der Röntgenstrukturanalyse entdeckt worden entsprechen den Clustern von Doppelhelices aus den biochemischen Untersuchungen. Bei diesem Modell befinden sich die Verzweigungen (d.h. die (1-6)-Verknüpfungen) des Amylopektins in den weniger stark organisierten (mehr amorphen) Regionen zwischen den Clustern. Die Amylose steht in Verbindung mit dem Amylopektin (Abbildung 4b), wobei bisher unklar ist, wie genau.
Durch weitere Röntgenstrukturanalysen (Small-angle and Wide-angle scattering; SAXS und WAXS) von hydratisierter Stärke konnte gezeigt werden, dass die Lamellen der Doppelhelices möglicherweise in einer helikalen Superstruktur, oder Superhelix organisiert sind (Abbildung 5). (Die SAXS-Technik wird bei Stanley, 2009.)
Untersuchungen im Mikromaßstab: Wachstumsringe und Blöckchen

Wachstumsringe aus
wechselnden Schichten von
amorphen und
halbkristallinen Bereichen.
Zum Vergrößern auf das Bild
klicken
Mit freundlicher Genehmigung
von Serge Pérez, ESRF
Die lamellaren und superhelikalen Strukturen von Amylopektin sind allerdings nur ein kleiner Ausschnitt des Gesamtbildes. Von geringeren Vergrößerungen mit dem Mikroskop ist bekannt, dass Stärkekörner aus – zwischen 100 und 800 nm dicken – alternierenden amorphen und semikristallinen Schichten aufgebaut sind. Sie werden Wachstumsringe genannt (Abbildung 6).
Über die amorphen Bereiche der Wachstumsringe ist so gut wie nichts bekannt. Im Gegensatz dazu können die stärker kristallinen Bereiche mit Röntgenstrukturanalyse untersucht werden. Neuere Experimente mit den extrem stark fokussierten Röntgenstrahlen eines Synchrotrons (siehe Box) haben gezeigt, dass die Lamellen innerhalb des semikristallinen Bereichs parallel zur Oberfläche des Stärkekorns liegen (Abbildung 7). Dadurch konnten die Wissenschaftler/innen den Zusammenhang zwischen den kleinen Strukturen (Mikromaßstab, z.B. Stärkekörner) und den extrem kleinen Strukturen (Nanomaßstab, z.B. Lamellen) herstellen.
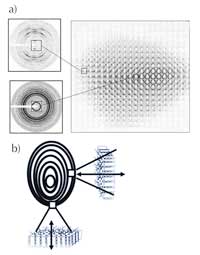
Streuungsbildern aus
verschiedenen Regionen des
Stärkekorns (“Mappen” des
Korns)
b) Anordnung der Lamellen
zur Kornoberfläche. Zum
Vergrößern auf das Bild
klicken
Mit freundlicher Genehmigung
von Serge Pérez, ESRF
Eine weitere, erst kürzlich durchgeführte Untersuchung der Oberfläche des Stärkekorns mit Atomkraftmikroskopie zeigte das Vorhandensein von Blöckchen in den Wachstumsringen. Diese Blöckchen sind annähernd kugelförmig, und 20-100 nm groß. Bis jetzt ist nicht mehr über diese Blöckchen bekannt.
Unter Berücksichtigung aller bisher durchgeführten Studien kann man sagen, dass die Nanostrukturen ziemlich genau bekannt sind (Doppelhelices, die Lamellen bilden). Dies gilt auch für die Wachstumsringe (alternierende amorphe und semikristalline Schichten). Über die dazwischenliegenden Strukturen (die Superhelices und die Blöckchen) herrscht viel weniger Klarheit. Es ist noch immer unklar, wie die Superhelices, Blöckchen und Wachstumsringe zueinander in Beziehung stehen. Abbildung 8 fasst die unterschiedlichen Strukturebenen (Glukoseeinheiten, Helices, Lamellen, Superhelices, Blöckchen und Wachstumsringe) vom molekularen Maßstab (10-9 m) zum mikroskopischen Maßstab (10-5 m) zusammen.

a) Glukoseeinheit
b) Doppelhelix
Oben: Röntgenstreuungsdiagramm, das die doppelhelikale Struktur zeigt (mit Genehmigung von Imberty et al., 1988)
Unten: Modell der dopelhelikalen Struktur
c) Lamellen
Oben: Aufnahme von hydrolysierter Stärke, sichtbar ist die Form der kristallinen Lamellen (mit Genehmigung von Angellier-Coussy et al., 2009)
Unten: Modell der kristallinen Lamellen, die aus 100 Doppelhelices bestehen
d) Superhelix
Oben: Small-angle X-ray scattering (SAXS) und Wide-angle X-ray scattering (WAXS)-Beugungsbilder, die das Vorhandensein einer superhelikalen Struktur zeigen (mit Genehmigung von Waigh et al., 2000)
Unten: Modell der Superhelix, mit einer Steigung von 9 nm und einem Durchmesser von 18 nm
e) Blöckchen
Oben: Atomkraftmikroskopie-Aufnahme der typischen Oberfläche eines Stärkekorns (mit Genehmigung von Gallant et al., 1997). Die Erhebungen an der Oberfläche weisen auf die Anwesenheit von Blöckchen hin.
dürften in den amorphen Regionen kleiner sein (Bereich im Zentrum) als in den semikristallinen Regionen (oben und unten)
f) Wachstumsringe
Die transmissionselektronische Aufnahme eines Dünnschnittpräparats eines Stärkekorns zeigt die Wachstumsringe als alternierende Schichten von amorphen und semikristallinen Bereichen (mit Genehmigung von I. Paintrand, CERMAV, Grenoble, Frankreich)
g) Körner
Oben: Rasterelektronische Aufnahme eines Stärkekorns (großes Bild) und die ensprechende Stärke unter polarisiertem Licht (inneres Bild)
Mitte: Ein Satz von Röntgenstrukturbeugungsmustern im Mikromaßstab zeigt die Verteilung und die Ausrichtung der kristallinen Bereiche in einem Stärkekorn. Jedes Röntgenstrukturbeugungsbild entspricht einer Fläche von 3 μm2 Probenfläche, zwischen den Beugungsmustern liegen 7 μm (mit Genehmigung von Buleon et al., 2009)
Unten: Schnitt eines Stärkekorns, das die strahlenförmige Orientierung der kristallinen Bereiche (Lamellen) in einem Stärkekorn zeigt
Zum Vergrößern auf das Bild klicken
Mit freundlicher Genehmigung von Serge Pérez, ESRF
Schon im Jahr 1858 hatte der Schweizer Botaniker Carl von Nägeli eine brilliante Eingebung, als er meinte, dass “das Stärkekorn…den Weg für eine neue Disziplin eröffnet..die molekulare Mechanik von räumlich organisierten Objekten.” Er wäre zweifellos überrascht, wenn er wüsste, dass wir 150 Jahre später noch immer damit ringen die komplexe Architektur der Stärke zu verstehen.
Glossar
Amorph: Bezeichnet ein Material (oder Teile davon) ohne räumliche Organisation und Regelmäßigkeit
Kristall: Ein perfekter Kristall ist ein festes Material, das aus in einem regelmäßig angeordneten, sich wiederholenden Muster von Atomen, Molekülen oder Ionen aufgebaut ist und in alle drei Richtungen des Raumes reicht.
Kristallin: Besitzt die Eigenschaften eines Kristalls; in Ausweitung des Begriffs werden damit auch Teile eines Materials bezeichnet, die regelmäßig angeordnet sind (z.B. ein Cluster von Doppelhelices, deren helikale Achse gleich orientiert ist).
Halbkristallin: Beschreibt ein Material (typischerweise ein Biopolymer) mit amorphen und kristallinen Bereichen.
ESRF
Die European Synchrotron Radiation Facility (ESRF)w1 in Grenoble, Frankreich, ist ein gutes Beispiel für einen Institution, an dem Tag und Nacht für das Wohl tausender Nutzer aus aller Welt gearbeitet wird. Die „Nutzer“ sind Wissenschafter/innen, die üblicherweise einem größeren Forschungsteam angehören und fallweise ein leistungsstarkes Instrument benötigen, um Informationen über interessante Proben (z.B. Polymere, Proteinkristalle, Fossilien oder katalytische Reaktionen) zu erhalten.
ESRF erzeugt extreme starke Röntgenstrahlen, die als Synchotronstrahlung bezeichnet werden. Diese Röntgenstrahlen werden von extremen energiereichen Elektronen ausgesandt, die in einem langen Speicherring mit 844 m Durchmesser zirkulieren. Die Röntgenstrahlen werden zu den Strahlführungen gelenkt, die außerhalb des Speicherrings in der Versuchshalle installiert sind. Jeder der 42 Strahlführungen am ESRF eignet sich für eine ganz bestimmte Technik bzw. Forschungsmethode. Etwa ein halbes Duzend davon ist speziell zur Untersuchung von Polymeren vorgesehen.
Zukünftig wird die Polymerforschung von einer neu gegründeten Partnerschaft für weiche kondensierte Materie (die auch Polymere beinhaltet) profitieren. Die Einführung von Nanostrahlen (noch stärker fokussierte Röntgenstrahlen im Nanomaßstab) werden eine noch genauere Analyse der Feinstruktur, und damit weitere Fortschritte in der Polymerforschung, inklusive der Erforschung von Stärke, ermöglichen.
References
- Angellier-Coussy H, et al. (2009) The molecular structure of waxy maize starch nanocrystals. Carbohydrate Research 344: 1558-1566.
 doi: 10.1016/j.carres.2009.04.002
doi: 10.1016/j.carres.2009.04.002 - Buléon A, Véronèse G, Putaux JL (2007) Self-association and crystallization of amylose. Australian Journal of Chemistry 60: 706-718. doi: 10.1071/CH07168
- Cornuéjols D (2009). Biological crystals: at the interface between physics, chemistry and biology. Science in School 11: 70-76. www.scienceinschool.org/2009/issue11/crystallography
- Gallant DJ, Bouchet B, Baldwin PM (1997) Microscopy of starch: evidence of a new level of granule organization. Carbohydrate Polymers 32: 177-191. doi: 10.1016/S0144-8617(97)00008-8
- Imberty A et al. (1988) The double-helical nature of the crystalline part of A-starch. Journal of Molecular Biology 201: 365-378.
 doi: 10.1016/0022-2836(88)90144-1
doi: 10.1016/0022-2836(88)90144-1 - Stanley H (2009) Plasma balls: creating the 4th state of matter with microwaves. Science in School 12: 24-29. www.scienceinschool.org/2009/issue12/fireballs
- Waigh TA et al. (2000) Side-chain liquid-crystalline model for starch. Starch 53: 450-460. doi: 10.1002/1521-379X(200012)52:12<450::AID-STAR450>3.0.CO;2-5
Web References
- w1 – Weitere Informationen zum ESRF findet man bei www.esrf.eu
Resources
- Eine ausführliche Zusammenfassung über Stärke findet sich auf der Webseite der ESRF-Wissenschafter/innen Serge Pérez und Anne Imberty: www.cermav.cnrs.fr/glyco3d/lessons/starch
- Imberty A, Pérez S (1988) A revisit to the three-dimensional structure of B-type starch. Biopolymers 27: 1205-1221. doi: 10.1002/bip.360270803
- Pérez S, Baldwin P, Gallant DJ (2009) Structural features of starch. In: Starch-Chemistry and Technology, 3rd edition. BeMiller J, Whistler R (eds.). pp149-192. New York, NY, USA: Academic Press. ISBN: 978-0127462752
- Chanzy H, et al. (2006) Morphological and structural aspects of the giant starch granules from Phajus grandifolius. Journal of Structural Biology 154(1): 100-120. doi: 10.1016./j.jsb.2005.11.007
Institutions
Review
Die Ultrastruktur der Stärke findet meist wenig Beachtung, aber dieser Artikel beschreibt, wie die Bestandteile der Stärke – Amylose und Amylopektin – sehr komplexe Strukturebenen im Polymer ausbildet. Der Artikel eignet sich als Vertiefung für eine Unterrichtseinheit, die sich mit dem Verdau oder dem Nachweis von Stärke beschäftigt. Er eignet sich auch als Beispiel für die Nutzung der Röntgenstrukturanalyse oder der Polarisationsmikroskopie. Es könnten Poster (oder Hausübungen) über die die Verwendung von Stärke in der Industrie erstellt werden, wobei sich jede Gruppe auf einen anderen Einsatzbereich spezialisiert. Methoden zur Produktion und/oder zum Nachweis von Stärke in der Industrie könnten ebenfalls bearbeitet werden. Es könnten zusammenfassende Fragen gestellt werden, z.B.:
- Stärke besteht aus 2 Komponenten:
- Amylase und Amylopectin
- Amylose und Amylopectin
- Glucose und Amylase
- Glucose und Amylose
- Erkläre die Verkleisterung.
- Was sind die Wachstumsringe in Stärkekörnern?
- Erkläre den Unterschied zwischen Amylose und Amylase.
- Wandle die Größen der verschiedenen Strukturelemente von 10-9 m in kleinere Einheiten um, z.B. Mikrometer und Nanometer.
- Die Röntgenstrukturanalyse wurden in den 1950er-Jahren zur Strukturanalyse eines bekannten Moleküls eingesetzt – wie heißt das Molekül?
Shelley Goodman, GB





