Canlı ışık: biyolüminesanın kimyası Teach article
Çeviri: Hikmet Geçkil ve Esmanur Eren. Biyolüminesanı inceleyerek kimya derslerinizi aydınlatabilirsiniz.

biyolüminans resmi.
Resim Chris Favero’in izniyle;
resmin kaynağı: Flickr
Biyoluminisan (biyoişıma) görüntüleri dünyanın doğa harikalarından biridir. Ateş böceklerinin dans ışıkları ya da okyanus planktonlarının oluşturduğu mavi dalgaların saf güzelliğine binlerce yıldır insanlar hayranlık duymaktadır. Hala bu tür görüntüleri görsel bir zevk olarak bulurken, son yıllarda bu oluşumun kimyasını anlayabilir ve laboratuarda veya başka bir yerde kullanmak üzere adapte edebiliyoruz.
Böceklerden, balıklara ve yumuşakçalardan bakteri ve planktonlara kadar ışık üretebilen geniş bir organizma çeşitliliğinin olduğu binlerce yıldan beri bilinmektedir. Romalı yazar Pliny the Elder yenildiğinde korkutucu şekilde ışık yayan kabuklu bir deniz canlısı (Pholas dactylus) tanımlamıştır. Pliny ayrıca akşamları harika parlaklık üreten bir ağaç mantarı olan Omphalotus olearius’u da kaydetmiştir.
Belki de en muhteşem Biyoluminan görüntüler dinoflagellat planktonundan gelen görüntülerdir. Bu plankton, bazen okyanus yüzeyinde görülen mavi parlak dalgaları oluşturur. Biyolüminanın daha egzotik formları okyanus derinliklerinde, fazla güneş ışığı almayan yerlerde bulunur. Bazı türler kendi özel ışıldamalarını yaparlar. Ünlü fener balığı avlarını cezp etmek için doğrudan dişlerinden sarkan bir ışık kullanır.

Resim Terry Priest’in izniyle;
resmin kaynağı: Flickr
Biyolüminesan (canlı organizmalar tarafından ışık üretilmesi ) doğada epey yaygındır. Peki, bu durum bunu kullanan türlere nasıl bir avantajlar sağlıyor? Pek çok avantajı arasında aşağıdakiler özellikle öne çıkmaktadır.
- Aposematizm ( zehirli görünüm): potansiyel yırtıcılara karşı yenilemez görünmek. Örnek; ateşböcekleri Photinus ignitus ve Lucidata atra.
- Savunma: yakın mesafeden parlak bir flaş yayarak yırtıcılardan korunmak. Örnek; bir fener balığı veya ışıldak balığı.
- Kur yapma: çiftleşme sırasında ya da öncesinde iletişim kurmak. Örnek; ateşböcekleri.
- Cezp etmek: avı ışık kaynağına çekmek. Örnek; fenerbalığı.
- Kamuflaj: hayvanın çevresi (arka zemin) ile uyumlu olmasını sağlamak. Aşağıda görüldüğü gibi bir deniz hayvanı su yüzeyinin parlaklığına karşın koyu görünür. Böylece kendi ışığını üretmek potansiyel avcılardan gizlenebilir. Örnek: Abralia verany gibi mürekkep balıkları.
Parlayan renkler
Doğada, biyolüminesan farklı renkler üretir: çoğunlukla mavi, yeşil ve sarı. Türün evrildiği ortama bağlı olarak yansıttığı ışığın kendine özgü bir rengi vardır. Mavi ışıma genellikle derin okyanuslarda oluşur, kıyı boyunca yaşayan türlerde yeşil ışıma, sarı ve yeşil ışıma tipik olarak tatlı su ve karasal türlerde görülür.
Biyolüminesan oluşumunun kimyası nedir? Ve nasıl farklı renkler (mavi, yeşil, sarı) elde edilebilir?
Kimyasal olarak, çoğu biyolüminesan oksitlenme tepkimeleri nedeniyle oluşur. Oksitlenme tepkimeleri: oksijen lüsiferin denilen maddeler ile tepkimeye girer ve ışık formunda enerji üretilir. Tepkime lüsiferaz denilen bir enzim tarafından katalizlenir. Bu süreçte lüsiferin oksitlenerek oksilusiferin formuna dönüşür. Tablo 1 de görüldüğü gibi farklı türler tarafından kullanılan lusiferin ve elde edilen oksilusiferin kimyasal olarak oldukça çeşitlendirilebilir.
|
Biyolüminans türleri |
Lusiferin |
Oksilusiferin |
|---|---|---|
|
Dinoflagellatlar |
Dinoflagellat lusiferin C33H3806N4Na2 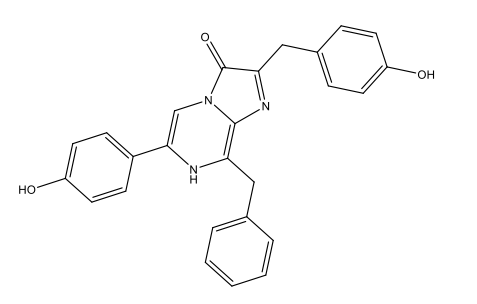 |
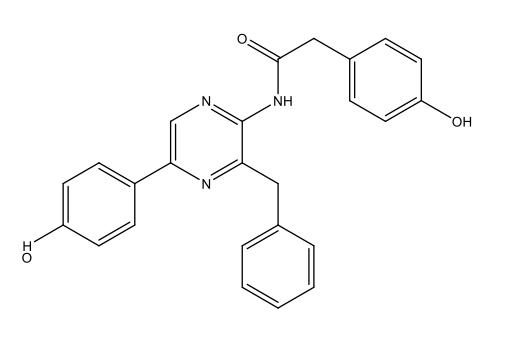 |
|
Mürekkep balıkları, bazı karidesler, bazı balıklar |
Coelenterazin C26H2103N3 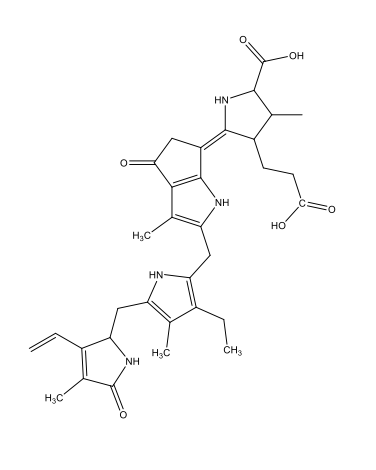 |
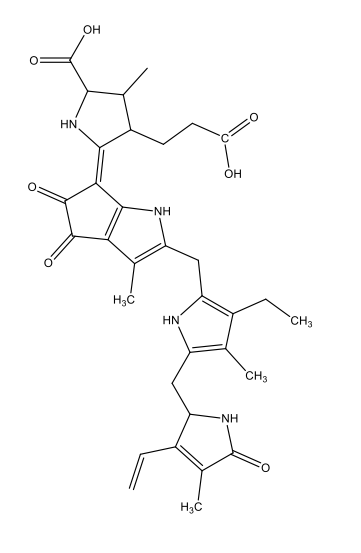 |
|
Ateşböcekleri |
Ateşböceği lusiferin C11H8N2O3S2 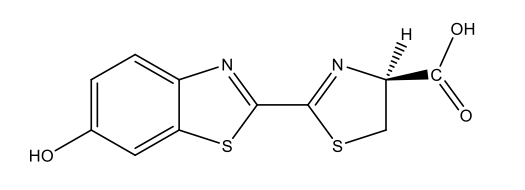 |
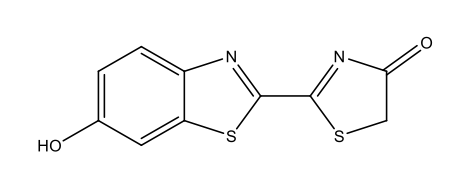 |
Tepkimeye katılan enerjinin % 98’nin ışık olarak serbest bırakılması, bu tepkimelerin çok verimli olduğunu göstermektedir. Bunu, enerjinin büyük miktarlarını ısı ve sadece % 2’sini ışık olarak salan bir ampulle karşılaştırdığımızda, verimi daha net görmüş oluruz.
Farklı türlerde oluşmalarının yanı sıra, lusiferinler birden fazla ışık rengi üretebilirler (tablo 2 de görüldüğü üzere). Ek ışık yayan maddeler veya floroforlar aynı zamanda ışımanın rengini değiştirebilir. Aequorea Victoria denizanası, yeşil florasan proteini (GFP) olarak bilinen bir tür bir florofor içerir. GFP ilk reaksiyonda üretilen mavi ışığı emer ve daha uzun bir dalga boyunda onu yeşil ışık olarak yeniden yayar. Bu yüzden denizanası yeşil biyoparlaklık üretir.
|
Lusiferin |
Luminescence maximum (nm) |
Yaklaşık renk w1 |
|
|---|---|---|---|
| Ateşböceği lusiferini | 560 (pH=7’de) | Yeşil |
 |
| 615 (pH=5.4’de) | Turuncu |
 |
|
| Bakteriyel lusiferin | 490 | Turkuaz |
 |
| Dinoflagella lusiferin | 474 | Mavi |
 |
| Coelenterazin | 450-480 bir anyon olarak | Turkuaz mavi |
 |
| COOH formunda 400 | Mor |
 |
|
Son yıllarda, bu özel biyoparlaklık sistemi bilimsel araştırmalarda önemli bir kullanım bulmuştur. GFP’yi kodlayan gen şimdi belirli proteinleri izlemek ve belirli genlerin ne zaman ifade edildiğini göstermek için bir genetik “etiket” olarak kullanılmaktdır. Çünkü, GFP mavi veya UV ışığı altında yeşil renkte parladığından, algılamak çok kolaydır (bkz Furtado, 2009). Bu çalışma, 2008’de Kimya Nobel Ödülünü alacak kadar önemli kabul edildiw2.
Neyse ki bizim için biyoışımaya neden olan kimyasal tepkimeleri laboratuarda yapmak, aşağıdaki etkinlikte gösterildiği gibi oldukça kolaydır.
Öğrenci aktivitesi: laboratuarda biyolüminesan görüntüleme
Bu aktivitede öğrenciler, kimyasal ajanları birbirleriyle karıştırdığında gerçekleşen ışıma reaksiyonunu görebilirler. Anahtar madde luminoldür. Luminol sentetik bir kemiluminesandır ve kimyasal tepkimeye girdiğinde mavi ışık üretir. Luminol ve lusiferin farklı reaksiyonlara sahip olmalarına rağmen aynı ışıldama sonuçlarına sahiptirler. (luminolün oksitlenme tepkimesi bir enzimden ziyade potasyum ferrisiyanürle katalizlenir).
Son aşamada daha çok ışık gösterisi yapabilmek için aktivite karanlık bir ortamda gerçekleştirilir.
Malzemeler
- 1 g luminal (5-amino-2,3-dihydrophthalazine-1,4-dione)
- 50 ml sodium hidroksit( NaOH ) % 10’luk solüsyon
- 50 ml potasyum ferricyanide (K3[Fe(CN)6]) %3 ‘lük solüsyon
- Yaklaşık 0.5 g potasyum ferricyanide (K3[Fe(CN)6])
- 3 ml hidrojen peroksit (H2O2) % 30’luk solüsyon
- Distile su
- Beher
- Huni
- Silindir
- Balon joje
Prosedür
Güvenlik notu
Koruyucu gözlük, laboratuar önlüğü ve güvenlik eldivenleri giyilmelidir. % 30’luk hidrojen peroksit çözeltisi kullanılırken dikkatli olunmalıdır. Çünkü; katalizör varlığında şiddetli reaksiyon gösterebilir. 3 ml’lik solüsyonu aldıktan sonra şişeyi hemen kapatınız.
Aynı zamanda genel general Science in School güvenlik notlarına da bakınız.
- Bir beherin içerisinde, 1 g luminol 450 ml distile su ile çözünür.
- 50 ml %10 sodyum hidroksit solüsyonu eklenir ve karıştırılır.
- Elde edilen çözeltiden 50 ml alınır ve 350 ml distille su ile başka bir behere aktarılır. Bu artık solüsyon A’dır.
- Üçüncü beherde, 50 ml % 3 potasyum ferrisiyanit solüsyonu, 350 ml distile su ve 3 ml %30 hidrojen peroksit solüsyonu karıştırılır. Bu da solüsyon B’dir.
- Solüsyon A ve B’den eşit miktarlarda farklı silindirlere dökülür.
- Huni yardımıyla balon jojeye biraz potasyum ferrisiyanit aktarılır.
- Balon joje karanlık bir yere kaldırılır.
- Solüsyon A ve B aynı anda balon joje içerisine dök ve gözlemle.
Harika bir mavi biyolüminesan ışık hemen gözlemlenecektir.
- İmha etme: Konsantrasyon hacmi başlangıç hacminin 1/8 kadarı olana kadar bir çeker ocak içerisinde solüsyonu ısıt,sonra kalan solüsyonu ağır metal atıkları içeren bir tanka dök.
Neler oluyor?
Luminol oksitlenmesi çeşitli aşamalardan oluşur.
- Lolüsyon A hazırlanırken (basmak 2), luminol baz (OH–) ile tepkime verir:
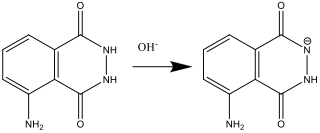
- Solüsyon B hazırlandığında (basamak 4), hidrojen peroksit süperoksit radikal anyonu O2.- oluşturmak için parçalanır. Bu reaksiyon hekzasiyanoferrat (III) iyonu tarafından katalizlenir.
- Solüsyon A ve B karıştırıldığında (basamk 8), luminol hekzasiyonaferrat (III) anyonu tarafından oksitlenir ve radikal bir anyon oluşur.
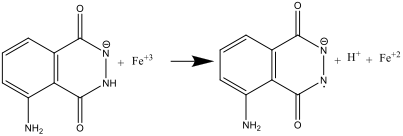
Hekzasiyanoferrat (III) iyonu burada iki rol oynar: superoksit radikal anyonu (O2.) oluşumunu katalizler ve aynı zamanda luminolu radikal bir anyona oksitler. Demir, oldukça alkalı bir ortamda Fe(OH)3 çökelmesini önlemek için, [Fe(CN)6]3 formunda olması gerekir.
- Luminol radikal anyonu ve süperoksit radikal anyonu (O2.-) daha sonra reaksiyona girerler.
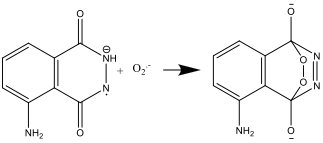
- Elde edilen bileşik kararsızdır olup, azot ve aminofıtalat’ın uyarılmış iyon formunu oluşturmak üzere parçalanır.
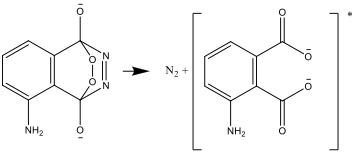
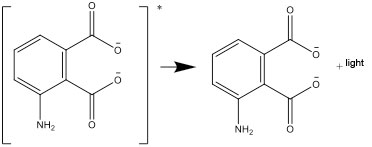
- Uyarılmış form daha sonra kararlı formlara bozunur ve enerji farkı ışık olarak yayılır:
Tartışma soruları
- Luminol reaksiyonunda, ışık için enerji nereden gelir?
- Potasyum ferrisiyanidin rolü nedir? Doğal ışıma (biyolüminesan) reaksiyonlarında hangi madde bu rolü oynar?
- Hangi madde luminol reaksiyonunun oksidasyonundan sorumludur? Bu doğada da aynı mı?
Extension
There is a great deal of information available about bioluminescence (see the resources section for examples). Students can follow up this activity with some research of their own. For example:
- Uses of bioluminescence in nature. Find more reasons why bioluminescence is a useful adaptation. For each adaptation, identify some species that benefit from it.
- Bioluminescence chemistry. Find out about some specific chemiluminescence reactions that occur in nature. How similar are they to the luminol reaction?
- Bioluminescence colours. Find out more about how they are produced.
- Evolution of bioluminescence. Has it evolved many times or just once?
- Uses of luminol in crime-scene investigations. Find out how luminol is used forensically and the chemistry of this use (e.g. see Welsh, 2011).
Studying chemistry with Pliny the Elder
This activity is part of a larger interdisciplinary project, developed together with 14- to 15-year-old students, to explore ancient scientific techniques. Pliny the Elder (23-79 AD) was a Roman author and naturalist whose encyclopaedia, Naturalis Historia, brought together much of the scientific knowledge of the time. We began each topic by discussing a passage from Naturalis Historia and then worked out how to recreate either the experiment described in the text or something similar.
In this way, the students began in the same pre-scientific state as Pliny and, through laboratory work and discussion, gained modern scientific knowledge on each of the topics. The process motivated even the most unenthusiastic students.
Other activities in the project include synthesising indigo (Farusi, 2012), recreating ancient perfumes (Farusi, 2011), preparing glass tesserae with boric acid and preparing iron-gall ink (Farusi, 2007). The whole project was presented at the international Science on Stage festivalw3 in Copenhagen, Denmark, in 2011.
References
- Farusi G (2007) Monastic ink: linking chemistry and history. Science in School 6: 36-40
- Farusi G (2011) Smell like Julius Caesar: recreating ancient perfumes in the laboratory. Science in School 21: 40-46
- Farusi G (2012) Çivit mavisi: Firavun’un boyasına yeniden hayat vermek. Science in School 24: 40-46
- Furtado S (2009) Painting life green: GFP. Science in School 12: 19-23
- Welsh E (2011) What is chemiluminescence? Science in School 19: 62-68
Web References
- w1 – Bir dalga boyunu nanometre cinsinden RGB veya onaltılık renge dönüştürmek için kullanılan basit bir araç Academo web sitesinde, eğitim kaynaklarının ücretsiz bir koleksiyonunda bulunur.
- w2 – Osamu Shimomura, Martin Chalfie ve Roger Y Tsien’e verilen 2008 Nobel Kimya Ödülünü için Nobel Ödül web sitesi
- w3 – Sahnede Bilim, 1999’da Science on Stage yayıncısı olan EIROforum tarafından başlatılan yerel, ulusal ve uluslararası öğretmenler etkinlikleri ağıdır. Her ulustan öğretmenlerden oluşan bir heyet, Sahnede Bilim Fuarı’nda ülkelerini temsil etmek üzere seçilir. Festival süresince, 25 ülkeden yaklaşık 350 ilköğretim ve ortaöğretim öğretmeni atölyelerde, sahne gösterilerinde ve öğretim fuarında en yenilikçi öğretim fikirlerini paylaşırlar.
Bir sonraki uluslararası festival 29 Haziran – 2 Temmuz 2017 tarihleri arasında Macaristan’ın Debrecen kentinde yapılacak. Katılımcılar, 25 ülkedeki rekabetçi ulusal etkinlikler yoluyla seçilecek. Başvuru süreci hakkında daha fazla bilgi edinmek için, ulusal yönlendirme komitesine başvurun.
Resources
- Biyolüminesan hakkında iki erişilebilir makale:
- Douglas P, Garley M (2010) Chemistry and light. Science in School 14: 63-68
- Judson O (2015) Luminous life. National Geographic
- Biyolüminesan hakkında ilgi çekici ve bilgilendirici bir animasyon
- Okyanus biyolüminesansının olağanüstü güzelliğini kutlayan müzikli atmosferik bir video
- Luminolun nasıl yapıldığı ile ilgili kısa bir video
- Luminol’un nasıl yapıldığını gösteren uzun bir video
Institutions
Science on StageReview
Biyolüminan binlerce yıldır insanlarda hayranlık uyandırmıştır ve özelliklede okyanus araştırma projeleri başta olmak üzere, araştırmaların popüler konusu olmaya devam etmektedir. Organizmalar tarafından ışık üretimine yol açan kimyasal reaksiyonlar, biyokimyaya mükemmel bir örnektir. Bu makalede anlatılan pratik etkinlik, öğrencileri eğlendirmek ve bilimsel tartışmaları sağlamak için faydalıdır.
Marie Walsh, Limerick Teknoloji Enstütüsü, Irlanda





