Oyundan son teknoloji biyolojiye: Yapay zeka ve protein katlanma sorunu
Oyunlarda insanları yenmek için geliştirilen yapay zeka sistemleri gibi, yapay zeka protein işlevinin sırlarını çözmeye nasıl yardımcı olabilir?

Devegiller, dayanıklılığı ve faydalarıyla ünlü hayvanlardır. Şaşırtıcı bir şekilde, sıra dışı antikorları da aynı derecede etkilidir ve günümüzde tıp biliminde devrim yaratmaktadır.
2024 yılı, Birleşmiş Milletler tarafından Uluslararası Devegiller Yılı olarak ilan edildi. Alpakalar, develer ve lamalar gibi devegiller, en zorlu çevrelerde bile hem ulaşım aracı ve hem de süt, et ve lif kaynağı olarak önemli roller oynar. Belki bir hayvanat bahçesinde bir alpakayı (tüylü lama) okşamış ya da tatilde bir deveye binerek sallantılı bir yolculuk yapmış olabilirsiniz. Peki, bu uzun bacaklı, uzun boyunlu, sakin görünümlü tüylü canlıların bilimin ilerlemesine de önemli katkılar sağladığını biliyor muydunuz?

Konvansiyonel antikorlar fare, köpek ve insan gibi memelilerin bağışıklık hücreleri (B hücreleri) tarafından üretilen Y şeklindeki proteinlerdir. Antikorların biyolojik işlevi, virüsler, bakteriler ve parazitler gibi mikroplardan gelen yabancı proteinlere özel olarak bağlanmak ve böylece enfeksiyonlara karşı koruma sağlamaktır. Bununla birlikte, antikorlar aynı zamanda önemli araştırma araçlarıdır ve hatta hastalıkları tedavi etmek için ilaç olarak kullanılırlar, çünkü özellikle istenen herhangi bir hedefe bağlanan antikorlar geliştirmek mümkündür.
Geleneksel yani konvansiyonel antikorlar dört protein zincirinden oluşan Y şeklinde proteinlerdir: iki özdeş ağır ve iki özdeş hafif zincir (Şekil 2). Bu zincirler iki (hafif) veya dört (ağır) globüler protein bölümünden oluşur (Şekil 2’deki turkuaz şekiller). Antikorların hafif ve ağır zincirlerinin üst kısımları birlikte hedefi yakalayabilen ‘el’ gibi bir bağlanma bölgesini oluşturur. Bu elin şekline bağlı olarak, belirli bir antikor sadece belirli bir şekli yakalayabilir. Başka bir deyişle, antikorlar hedeflerini benzersiz bir şekilde tanıyarak ve moleküler cırt-cırt gibi ona bağlanarak spesifik tanıma gerçekleştirir.
Otuz yılı aşkın bir süre önce bir grup Belçikalı araştırmacı, devegillerin de antikorların daha küçük bir versiyonunu ürettiklerini keşfederek bilim dünyasını şaşırttı. [1] Bu antikorlar yalnızca iki ağır zincirden oluşur ve hafif zincir içermez. Bilim insanları daha sonra, bu ‘yalnızca ağır zincirli’ develere ait antikorların el bölgesini ayrı olarak üretebileceklerini keşfettiler ve böylece daha da küçük bir versiyon olan nanoantikor (nanobodiler) elde ettiler (Şekil 2). [2,3]
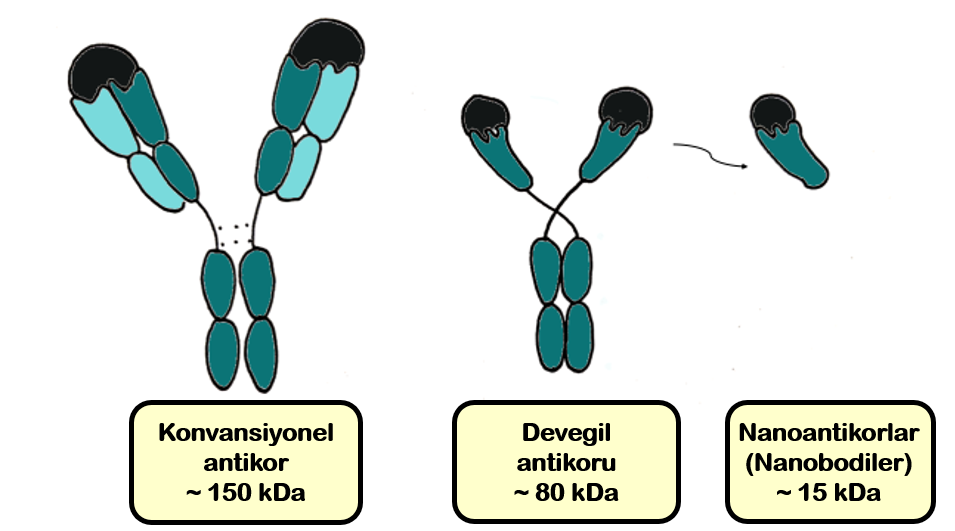
Bu küçük nanoantikor elleri, hedeflerine tıpkı antikorlar gibi güçlü ve hassas bir şekilde bağlanabilir. Konvansiyonel antikorlarla karşılaştırıldığında, nanoantikorlar daha stabil olup, sıcak, asidik veya alkali koşullarda işlev gösterebilir ve kolayca bozulmazlar. [3] Küçük boyutları (2.5 × 4.0 × 3.0 nm) [2] nedeniyle, çok daha büyük antikorların erişemediği yerlere kolayca sızabilirler. Nanoantikorların hedef tanıma için kullandığı ‘parmaklardan’ biri, geleneksel antikorlarda bulunanlardan bazen daha uzun olup, bu sayede diğer proteinlerin derin ceplerine girebilir. Nanoantikorlar suda çözünebilen yapıya sahiptir, bu da araştırma ve klinik uygulamalarda önemli bir özelliktir. Kan dolaşımında taşınabilme yetenekleri, vücut boyunca dağılmalarına yardımcı olur. Son olarak, küçük oldukları için, serbest duran nanoantikorlar böbrekler tarafından hızla kan dolaşımından filtrelenir, bu da potansiyel yan etkilerini azaltır. Genel olarak nanoantikorların, bulundukları hayvanlarla ortak özellikleri vardır; kararlı yapıları ile dünyanın en zorlu koşullarının olduğu çöllerde hayatta kalabilen develigillerde bulunmaları! Nanantikorların benzersiz özellikleri, hem araştırma hem de tıpta çeşitli uygulamalar için potansiyel olarak faydalı olmalarını sağlar.
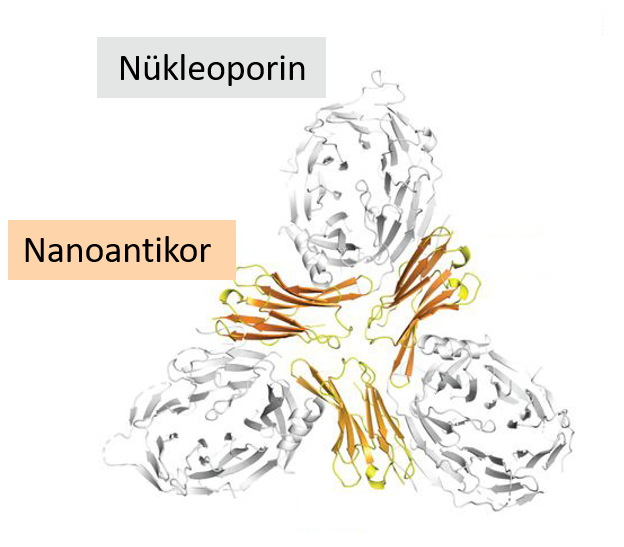
Nanoantikorlar, araştırmalarda faydalı araçlar haline gelmiştir. Nanoantikorların özellikle yaygın bir kullanım alanı, protein gibi biyomoleküllerin yapısını incelediğimiz yapısal biyoloji dalıdır. Protein yapılarının belirlenmesinde kullanılan çok yararlı bir yöntem X-ışını kristalografisidir; bu yöntem, protein kristallerine X-ışınları gönderilmesini içerir. Bu teknik, tüm protein moleküllerinin düzenli bir şekilde paketlendiği düzgün kristaller gerektirir. Ancak, birçok protein esnek olduğu ve hafifçe farklı formlar (konformasyonlar) alabildiği için düzenli kristallerin elde edilmesi sıklıkla zorlaşır. Bir nanoantikor, hedef proteini belirli bir formda kilitleyerek protein kristallerinin oluşumuna yardımcı olan bir ‘şaperon’ görevi görebilir (Şekil 4).[4]
İlk nanoantikor ilacı olan Cablivi, 2018 yılında edinilmiş trombotik trombositopenik purpura (aTTP) adı verilen nadir ve hayatı tehdit eden bir kan pıhtılaşma bozukluğunu tedavi etmek için onaylandı. aTTP’de, von Willebrandt faktörü adı verilen bir protein, kan trombositleriyle etkileşime girdiğinde büyük kümeler oluşturur, bu da şiddetli kan pıhtılaşmasına yol açar. Cablivi nanoantikoru, von Willebrandt faktörüne bağlanıp, onun trombositlerle olan tehlikeli etkileşimini engelleyecek şekilde tasarlanmıştır. Şu anda, bu ilaç bu ölümcül hastalığı tedavi etmek için hastanelerde kullanılmaktadır.[5] Japonya’da kullanılan daha yeni bir ilaç olan Ozoralizumab, eklemlerinde romatoid artrit olan kişilerde büyük sorunlar yaratan, inflamasyon yapan tümör nekroz faktörü alfa (TNFα) adlı insan proteinine bağlanır ve onu bloke eder.[6] Diğer bir nanoantikor ilacı olan Envafolimab, T hücrelerine bağlanır ve onları kanser hücrelerine saldırmak için aktive eder.[7]
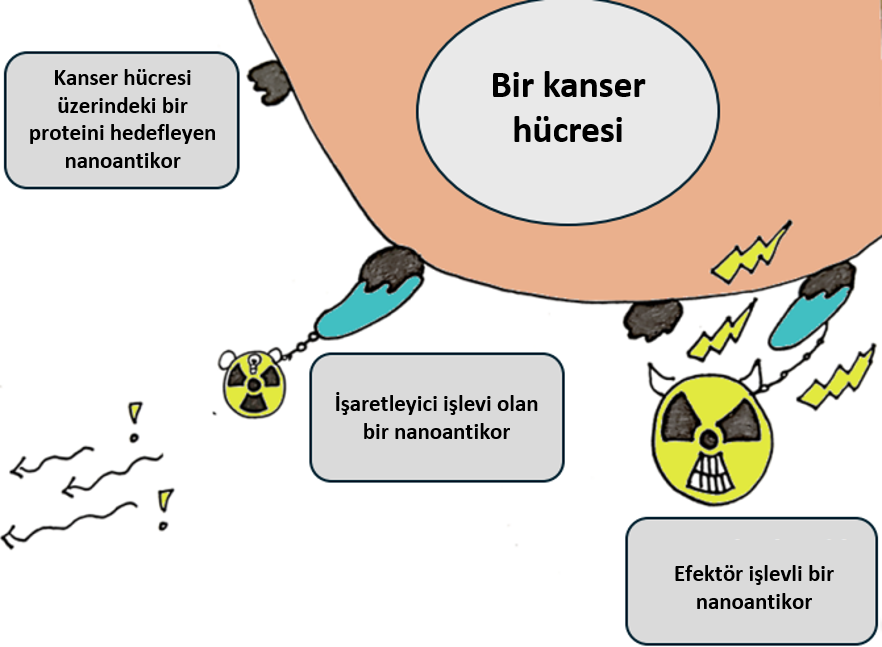
Belirtildiği gibi, nanoantikorların araştırma ve tıbbi uygulamalarda birçok kullanımı vardır. Ancak, nanoantikorların en heyecan verici özelliği, aynı zamanda diğer moleküllere kolayca bağlanabilmeleridir. Nanoantikorları, bir hedefe yönlendirmek için fonksiyonel parçacıklara bağlanabilen yapı taşları olarak düşünebiliriz. Bu parçacıklar: a) hedefin tespiti/yerinin belirlenmesine olanak tanıyacak bir işaretçi olarak hizmet edebilir veya b) bir ilaç gibi ‘etkileyici’ bir işlevi yerine getirebilir (Şekil 5).
Nanoantikorlara bağlanan radyoaktif bileşikler, kanser hücrelerinin hem dedektörü hem de yok edicisi olarak hizmet edebilir. Radyoaktif atomlar, nanoantikorlara bağlanarak, örneğin hasta insanlar gibi canlı organizmalarda tespit edilebilir hale getirilebilir. Bu radyoaktif atomlar, dokulardan kolayca geçebilen ve pozitron emisyon tomografisi (PET) kullanılarak tespit edilebilen radyasyon yayarlar. Galliyumla yapılan nanoantikor yönlendirmeli PET görüntülemesinde, radyasyon dozu son derece düşüktür (0.013 mSv);[8] buna karşılık, Birleşmiş Milletler Atomik Radyasyonun Etkileri (UNSCEAR) 2008 Raporu’na[9] göre, günlük yaşamımızdaki yıllık ortalama ışınlama dozu 2.4 mSv’dir. Minimal bir radyoaktivitesi olan galyum 68’li bileşiğe bağlı tümöre özgü nanoantikorların, hastalarda kolorektal tümörlerin ve vücudun diğer bölgelerine yayılmış kanser hücrelerinin görüntülenmesinde yararlı olduğu bulunmuştur,[7] ki bu, dedektör görevi gören modifiye edilmiş bir nanoantikor örneğidir. Daha yüksek dozlarda radyasyon, kanser hücrelerini öldürmek için de kullanılabilir, bu nedenle radyoaktif atomlara bağlı kanser hücresine özgü nanoantikorlar doğrudan tümöre radyasyon vererek yok olmasına yol açabilir. Bir çalışmada, meme kanserine özgü bir nanobodi ile bağlantılı radyoaktif lutesyum 177 atomları, 900 mSv’lik tümör hedefli toksik ışınlama dozu sağlamıştır.[10] Radyasyonu tümöre hedefleyerek, sağlıklı hücrelere verilen zararı en aza indirebilir ve böylece yan etkileri azaltabiliriz.
Dostlarımız develerin birkaç on yıl önce başlattığı nanoantikor trendi, son yıllarda devasa sıçramalarla ilerledi. Artık bir lama sürüsüne ihtiyaç duymadan herhangi bir moleküler biyoloji laboratuvarında nanoantikor geliştirmek mümkün! Nanoantikorlar artık basit mikroorganizmaların, yani bakterilerin, maya hücrelerinin ve virüslerin yardımıyla tamamen sentetik olarak oluşturulabiliyor. COVID salgını ortaya çıktığında, Avrupa Moleküler Biyoloji Laboratuvarı’ndaki (EMBL) meslektaşlarımızın, koronavirüsü etkili bir şekilde bağlayan sentetik nanoantikorlar geliştirmesi üç haftadan kısa sürdü.[11] Bununla birlikte, etkili nanoantikorların belirlenmesi sadece ilk adımdır; kliniğe gelmek için, nanoantikor bazlı ilaçlar, tıpkı diğer tıbbi ürünler gibi, insan hastalarda güvenlik ve etkinliklerini sağlamak için güçlü klinik öncesi hayvan testlerinden ve klinik çalışmalardan geçmelidir. Artık yapay zeka kullanarak nanoantikor bağlayıcılarını belirleme çabaları bile var,[12] bu çok işlevli proteinlerin üretimini daha da kolaylaştırabilecek bir yaklaşım. Ne yazık ki, sentetik nanoantikorlar genellikle aşılanmış develerden elde edilenler kadar iyi performans göstermiyor ve optimum aktivite için daha fazla ayarlama yapılması gerekiyor. Hala öğrenecek çok şey var!
Genel olarak, nanoantikorlar kolayca modifiye edilebilen ve diğer moleküllere bağlanabilen çok yönlü araçlardır ve modifiye edilmiş nanoantikorlar araştırmacılara ve hastalara birçok yönden yardımcı olabilir. Keşfedildiklerinden bu yana, nanoantikorlar dünyanın dört bir yanındaki araştırmacılara yenilikçi çözümler geliştirmeleri için ilham kaynağı oldular. Belki bir gün SİZİN de aklınıza bir nanoantikorun, yani bu muhteşem moleküler cırt cırtın, tam da ihtiyacınız olan şey olacağı bir araştırma veya tedavi fikri gelebilir.
[1] Hamers-Casterman C et al. (1993) Naturally occurring antibodies devoid of light chains. Nature 363: 446–448. doi: 10.1038/363446a0
[2] Kunz S et al. (2023) NANOBODY® molecule, a Giga medical tool in nanodimensions. International Journal of Molecular Sciences 24: 13229. doi: 10.3390/ijms241713229
[3] Jin BK et al. (2023) NANOBODIES®: A review of diagnostic and therapeutic applications. International Journal of Molecular Sciences 24: 5994. doi: 10.3390/ijms24065994
[4] Cheloha RW et al. (2020) Exploring cellular biochemistry with nanobodies. The Journal of Biological Chemistry 295: 15307–15327. doi: 10.1074/jbc.REV120.012960
[5] Canadian Agency for Drugs and Technologies in Health (2022) Executive Summary. Clinical Review Report: Caplacizumab (Cablivi). Indication: Indicated for the treatment of adults with acquired thrombotic thrombocytopenic purpura (aTTP) in combination with plasma exchange (PEX) and immunosuppressive therapy. Available from: https://www.ncbi.nlm.nih.gov/books/NBK567591/
[6] Tsumoto K, Takeuchi T (2024). Next-generation anti-TNFα agents: The example of ozoralizumab. BioDrugs: Clinical Immunotherapeutics, Biopharmaceuticals and Gene Therapy 38: 341–351. doi: 10.1007/s40259-024-00648-3
[7] Cui C et al. (2024). Model-informed drug development of envafolimab, a subcutaneously injectable PD-L1 antibody, in patients with advanced solid tumours. The Oncologist 29: e1189–e1200. doi: 10.1093/oncolo/oyae102
[8] Li Let al. (2023) Immuno-PET of colorectal cancer with a CEA-targeted [68 Ga]Ga-nanobody: from bench to bedside. European Journal of Nuclear Medicine and Molecular Imaging 50: 3735–3749. doi: 10.1007/s00259-023-06313-1
[9] The United Nations scientific committee on the effects of atomic radiation (2008) Sources of ionizing radiation. UN Publications. ISBN: 978-92-1-142274-0
[10] D’Huyvetter M et al. (2014) Targeted radionuclide therapy with a 177Lu-labeled anti-HER2 nanobody. Theranostics 4: 708–720. doi: 10.7150/thno.8156
[11] Custódio TF et al. (2020) Selection, biophysical and structural analysis of synthetic nanobodies that effectively neutralize SARS-CoV-2. Nature Communications 11: 5588. doi: 10.1038/s41467-020-19204-y
[12] Bennett NR et al. (2024). Atomically accurate de novo design of single-domain antibodies. bioRxiv: the preprint server for biology. doi: 10.1101/2024.03.14.585103
Bu makale, 11-14 yaş arası öğrencilere immünoloji ve biyoteknolojinin en yeni konularından biri olan nanoantikorlara yönelik bir giriş sunmaktadır. Bu konu, bağışıklık sistemi gibi temel biyoloji müfredat konularıyla uyumludur.
Fen Bilgisi Öğretmenleri bu makaleyi tıbbın geleceği ve biyoteknolojide etik konular üzerine tartışmaları teşvik etmek için kullanabilirler.
Ayrıca bu konu, öğrencilerin eleştirel düşünme becerilerini geliştirirken temel kavramları özetlemelerine ve açıklamalarına yardımcı olan yararlı bir anlama alıştırması olarak da hizmet eder.
António Pedro Fonseca, Fen Bilgisi Öğretmeni ve Doktora Araştırmacısı, Portekiz

Oyunlarda insanları yenmek için geliştirilen yapay zeka sistemleri gibi, yapay zeka protein işlevinin sırlarını çözmeye nasıl yardımcı olabilir?
Bu yıl Nobel Kimya Ödülü tıklama (klik) kimyası dalında verildi. Kulağa basit gelen bu ismin ardındaki çarpıcı metodolojik ilerleme hakkında bilgi edinin.