Šta je hemiluminiscencija? Understand article
Prevela Sara Todorović, Biološki fakultet, Univerzitet u Beogradu. Svetleće meduze, svetlucavi svici, zabavni svetleći štapići; Emma Welsh predstavlja nam predivni i misteriozni svet hemilunimiscencije.

Slika dobijena od Erik Solheim;
Izvor slike: Wikimedia
Commons
Svici, meduze i svetleći štapići – jedni lete, jedni žive duboko u okeanu, dok drugi obezbeđuju zabavu u noćnim klubovima. Šta im je zajedničko? Odgovor je – intrigantne hemijske reakcije koje proizvode svetlost.
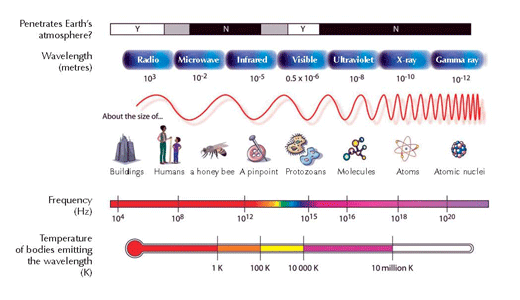
Hemiluminiscencija je proizvodnja svetlosti kroz hemijsku reakciju. Dve hemikalije reaguju i formiraju ekscitovani (visoko-energetski) intermedijer, koji se raspada otpuštajući deo svoje energije u vidu fotona svetlosti (pogledajte rečnik za sve izraze koji su podebljani) da bi dostigli svoje osnovno stanje (pogledajte Sliku 1, ispod).
A + B -> AB* -> Produkti + Svetlost
Ekscitovani
intermedijer
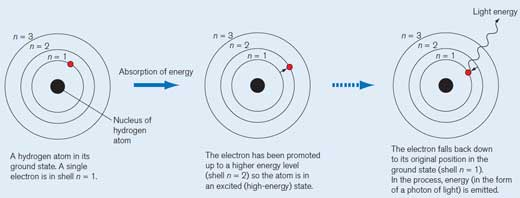
Atom vodonika u osnovnom stanju. Samo je jedan elektron u njegovom omotaču (ljusci) n = 1. Svaki omotač ima sopstveni nivo energije.
Kada atom vodonika absorbuje kvantum (definisanu količinu) energije, pomera se na viši energetski nivo (ljuska n = 2) i sada je u ekscitovanom (visoko-energetskom) stanju. Ovo označavamo zvezdicom (*) pored molekula.
Elektron se vraća nazad u svoju prvobitnu poziciju u osnovnom stanju (ljuska n = 1). Tokom tog procesa, paket energije (foton) otpušta se u vidu elektromagnetne emisije. Talasna dužina zavisi od količine energije. Ako je talasna dužina u okviru spektra vidljive svetlosti, tranzicija elektrona će biti praćena emitovanjem svetlosti određene boje. Talasna dužina određuje boju (pogledajte Sliku 2, ispod)
Slika dobijena od Chemistry Review
Hemiluminiscentne reakcije uglavnom ne otpuštaju mnogo toplote, jer se umesto toga energija otpušta u vidu svetlosti. Luminol stvara svetlost kada reaguje sa oksidujućim sredstvom; hemija ove reakcije je prikazana u Odeljku 1.
Odeljak 1: Luminol, hemikalija koja svetli u mraku
Otpuštanje fotona svetlosti iz molekula luminola je prilično komplikovan proces koji se odvija u više stupnjeva. U osnovnom (alkalnom) rastvoru, luminol se nalazi u ravnoteži sa svojim anjonom, koji ima naelektrisanje (šaržu) od – 2. Anjon može postojati u dve forme (ili tautomera), sa dve negativne šarže delokalizovane ili na atomima kiseonika (enolni oblik) ili na atomima azota (keto-oblik; pogledajte Sliku 3, ispod).
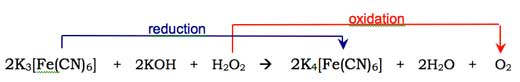
Molekularni kiseonik (O2) creaguje sa enolnim oblikom luminolovog anjona i oksiduje ga u ciklični peroksid. Potrebni kiseonik dobija se iz redoks reakcije (one u kojoj se dešavaju i redukcija i oksidacija) koja uključuje vodonik peroksid (H2O2), kalijum hidroksid i (na primer) kalijum heksacijanoferat(III) (K3[Fe(CN)6], atakođe poznat kao kalijum fericijanid). Heksacijanoferat(III) jon ([Fe(CN)6]3-) redukuje se u heksacijanoferat(II) jon ([Fe(CN)6]4-, dajući kalijum ferocijanid, K4[Fe(CN)6]), dok se dva atoma kiseonika iz vodonik peroksida oksiduju iz oksidacionog stanja – 1 do 0:
Ciklični peroksid se zatim raspada i daje 3-aminoftalat (3-amino-1,2-benzendikarboksilna kiselina) u ekscitovanom stanju, zajedno sa molekulom azota (N2) – pogledajte Sliku 3, ispod. Ova reakcija dekompozicije je favorizovana zato što je molekul cikličnog peroksida veoma nestabilan i reakcija uključuje raskidanje nekih slabih veza. Takođe je favorizovana zbog rasta entropije (neuređenosti) usled oslobađanja molekula gasa. Kada se ekscitovani 3-aminoftalat vrati u osnovno stanje, oslobađa se foton plave svetlosti.
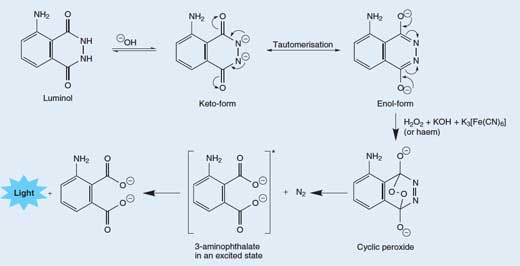
Tautomeri su molekuli sa istom molekulskom formulom, ali različitim rasporedom atoma ili veza. Dva tautomera mogu biti interkonvertovana; uvijene strelice pokazuju kretanje elektrona koje dovodi do promene iz jedne u drugu formu. Kliknite na sliku da biste je uvećali
Slika dobijena od Chemistry Review
Hemiluminiscencija u forenzici
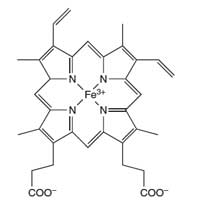
hemoglobinu
Atom gvožđa (Fe) u centru
porfirinskog prstena katališe
reakciju luminola
Slika dobijena od Chemistry
Review
Forenzičari koriste reakciju luminola da bi otkrili krv na mestima zločina. Smeša luminola u razblaženom rastvoru vodonik peroksida naprska se po mestu na kojem forenzičari sumnjaju da postoji krvi. Gvožđe prisutno u hem jedinici hemoglobina (pogledajte Sliku 4) u krvi ponaša se kao katalizator u reakciji opisanoj u Odeljku 1. Prostorija mora biti u mraku i ukoliko je krv prisutna moći će da se zapazi plavi sjaj u trajanju od otprilike 30 sekundi. Forenzički istražitelji mogu snimiti ovaj sjaj koristeći fotografski film, koji može biti korišćen kao dokaz na sudu za prisutnost krvi na mestu zločina. (Za dalje informacije o forenzici, pogledajte Wallace-Müller, 2011.
S obzirom na to da se gvožđe ponaša kao katalizator, potrebno je materije samo u tragovima, dakle samo mala količina krvi dovoljna je da dâ pozitivan rezultat. Ovo znači da je moguće otkriti čak i krv nevidljivu golim okom.

zločina
Slika dobijena od How Stuff
Works
Jedna od mana korišćenja luminola jeste ta što reakcija može biti katalizovana i drugim hemikalijama koje mogu biti prisutne na mestu zločina, na primer, legurama koje sadrže bakar, nekim sredstvima za čišćenje kao što je izbeljivač, pa čak i hren. Pametni kriminalci mogu očistiti krv izbeljivačem koji će uništiti dokaze o prisutnoj krvi, međutim izbeljivanje tepiha upozorilo bi na prethodni zločin. Urin takođe sadrži malu količinu krvi koja može biti dovoljna za katalizu reakcije luminola. Jednom kada je luminol upotrebljen na mestu zločina, može onemogućiti druge testove na tom mestu. Pa ipak, uprkos ovim manama, forenzičari i dalje koriste luminol kao sredstvo za rešavanje zločina.
U noćnom klubu
radi. Kliknite na sliku da
biste je uvećali
Slika dobijena od Chemistry
Review
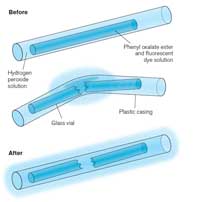
Kada prelomite svetleći štapić i kada počne da svetli, svetlo koje se vidi jeste primer hemiluminiscencije (pogledajte Sliku 5). Svetleći štapići sastoje se od plastične cevčice koja sadrži smešu sa difenil oksalatom i farbom (koja daje svetlećem štapiću njegovu boju). Unutar plastične cevčice nalazi se manja staklena cevčica koja sadrži vodonik peroksid. Kada se plastična cevčica savije, unutrašnja staklena cevčica puca i oslobađa se vodonik peroksid što dovodi do hemijske reakcije koja oslobađa svetlost (pogledajte Odeljak 2). Boja svetla koju svetleći štapić proizvodi zavisi od farbe koja je korišćena (pogledajte Odeljak 3).
Hemiluminiscentne reakcije, kao one u svetlećim štapićima, zavise od temperature. Reakcija se ubrzava kako temperature raste – lomljenjem vašeg svetlećeg štapića u toploj vodi oslobodiće se fantastičan sjaj, ali neće trajati onoliko koliko bi trajao na sobnoj temperaturi. Obrnuto, brzina rekacije se usporava na nižoj temperaturi; upravo zbog ovoga, nakon čuvanja svetlećeg štapića u zamrzivaču nekoliko sati, on može jarko svetleti ponovo kada se izvadi i zagreje, duže nego što bi svetleo inače. Reakcija se ne zaustavlja potpuno u zamrzivaču, ali usporena je toliko da se sjaj gotovo i ne vidi.
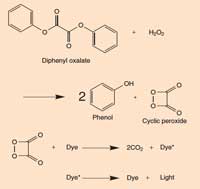
Odeljak 2: Hemija svetlećih štapića
uvećali
Slika dobijena od Chemistry
Review
Kada difenil oksalat regauje sa vodonik peroksidom (H2O2), oksiduje se i daje fenol i ciklični peroksid. Peroksid reaguje sa molekulom boje i daje dva molekula ugljen dioksida (CO2) a u toku procesa elektron u moleklulu boje prelazi u ekscitovano stanje. Kada se ekscitovani (visoko-energetski) molekul boje vrati u svoje osnovno stanje, foton svetlosti biva otpušten. Reakcija zavisi od pH vrednosti. Kada je rastvor blago alkalan, reakcija proizvodi jaču svetlost.
Bezbedonosno upozorenje
Fenol je otrovan, ako vaš svetleći štapić curi, vodite računa da se tečnost ne nađe na vašim rukama; ako se ipak nađe, operite ih odmah sapunom. Pogledajte takođe Science in School opšte bezbedonosno upozorenje.
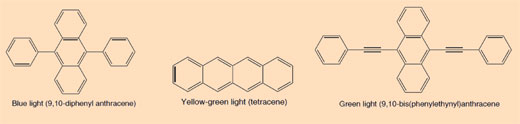
Odeljak 3: Šta svetlećim štapićima daje različitu boju?
Boje koje se koriste u svetlećim štapićima su konjugovana aromatična jedinjenja (areni). Stepen konjugacije ogleda se u različitoj boji svetla emitovanog kada se elektron vrati iz ekscitovanog u osnovno stanje.
Živi svetleći štapići

Slika dobijena od Terry Priest;
Izvor slike: Flickr
Da li ste ikada šetali plažom noću i videli iskre svetlosti oko vaših nogu? Ili bili na selu noću i videli svice kako lete okolo? Ovo su primeri bioluminiscencije i oko 90% živih bića koja žive duboko u moru ispoljava ovaj neobični fenomen. Ovi organizmi evoluirali su tako da proizvode svetlost jer ona ima mnoštvo korisnih funkcija. Svetlenje se može iskoristiti kao mamac za hvatanje plena, kao kamuflaža ili da bi privukli potencijalne jedinke za parenje. Neke bakterije čak koriste bioluminiscenciju da bi komunicirale.
Izraz “svetleći crv” opisuje larve nekoliko vrsta insekata, uključujući svice; neke od njih svetle da bi oterale predatore, dok druge vrste koriste svoj sjaj da privuku plen. Postoje i vrste lignji i rakova koje ispuštaju oblake bioluminiscentne tečnosti da bi zbunile predatore i sebi omogućile bekstvo. Stvorenja koja žive duboko u okeanu evoluirala su na način da proizvode uglavnom plavo ili zeleno svetlo zato što se dobro prenosi kroz morsku vodu. Ovo se dešava zato što plava svetlost ima kraću talasnu dužinu od crvene, što znači da se teže absorbuje od strane čestica iz vode.
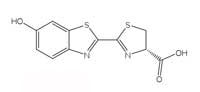
kod svitaca. Kliknite na sliku
da biste je uvećali
Slika dobijena od Chemistry
Review (structure)
Bioluminiscentne reakcije koriste ATP adenozin trifosfat) kao izvor energije. Struktura molekula koji proizvode svetlost razlikuje se od vrste do vrste, ali svima je dato opšte ime luciferin. Struktura luciferina svitaca prikazana je na Slici 6, levo. Kada svici svetle, luciferin se oksiduje i stvara se ekscitovani kompleks koji se potom vraća u osnovno stanje otpuštajući pritom foton svetlosti, baš kao i kod hemiluminiscentnih reakcija luminola opisanih u Odeljku 1. Pa ipak, svici ne koriste vodonik peroksid i kalijum heksacijanoferat(III) da bi oksidovali luciferin; umesto toga oni koriste molekularni kiseonik i enzim luciferazu (ovo je takođe opšti naziv – luciferaze se razlikuju od vrste do vrste).

meduzi Aequorea victoria
Slika dobijena od Typoform /
the Royal Swedish Academy of
Sciences (RSAS)
Luciferaza
Luciferin + O2 → Oksiluciferin + Svetlost
Izvedeni su brojni eksperimenti u cilju proučavanja ekvorina, proteina koji se može naći u određenim meduzama, koji proizvodi plavu svetlost uz prisustvo kalcijuma (pogledajte Shaw, 2002, i Furtado, 2009) i stoga se može koristiti u molekularnoj biologiji za merenje količine kalcijuma u ćelijama. Neki naučnici došli su do drugih ideja za korišćenje bioluminiscencije u budućnosti, na primer za stvaranje Božićnog drveća koje će moći da svetli samo od sebe. Da li se vi možete setiti još neke potencijalne primene ovog neverovatnog prirodnog fenomena?
Rečnik
Anjon: atom (ili grupa atoma) koji nosi negativni elektricitet.
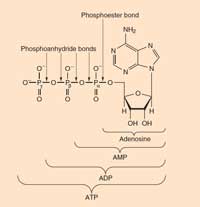
uvećali
Slika dobijena od Chemistry
Review
ATP: adenozin trifosfat nalazi se u svim poznatim oblicima života. Primarna je enrgetska valuta u ćelijama. ATP se formira iz ADP-a (adenozin difosfata) i fosfata tokom energetski bogatih reakcija (kao što je oksidacija glukoze) i raskida se (na ADP i fosfat) oslobađajući energiju za pokretanje energetski nepovoljnih reakcija.
Bioluminiscencija: Stvaranje svetlosti od strane živih organizama. Bioluminiscencija može poticati od absorpcije svetla (fluorescencija ili fosforescencija, na primer kod mnogih riba koje žive u morskim dubinama) ili od hemijske reakcije (hemiluminiscencija, ne primer kod svitaca).
Katalizator: Supstanca koja čini da se reakcija odvija brže, ali ne podleže trajnim hemijskim promenama tokom reakcije (na primer ne potroši se tokom reakcije). Katalizator radi tako što obezbeđuje alternativni način za odvijanje reakcije koji ima nižu energiju.
Hemiluminiscencija: Tip luminiscencije u kome se elektroni ekscituju hemijskom reakcijom, na primer kao u reakciji sa luminolom opisanoj u Odeljku 1.
Konjugovani: Konjugovani sistemi uglavnom nastaju u hemiji kada postoje dvostruke veze jedna do druge. Atomi u konjugovanim sistemima povezani su kovalentnim vezama i imaju naizmenično jednostruke i višestruke veze (uglavnom dvostruke, mada su i trostuke moguće u konjugaciji). Alkeni su ravni molekuli; konjugovani sistemi moraju uvek biti planarni da bi bila moguća delokalizacija elektrona kroz sistem. Svi molekuli boje u Odeljku 3 su primeri konjugovanih jedinjenja.
Kovalentne veze: Veze između dva atoma koje dele par elektrona.

delokalizovani u
konjugovanom sistemu
Slika dobijena od Chemistry
Review
Delokalizovani: Kada molekuli imaju konjugovane veze, elektroni mogu slobodno da se kreću kroz ceo konjugovani sistem. Ovi elektroni su delokalizovani elektroni. Elektroni u benzenovom prstenu su delokalizovani, zbog toga su sve ugljenik-ugljenik veze iste dužine.
Fluorescencija: Tip luminiscencije u kome su elektroni ekscitovani svetlošću, na primer u sigurnosnim markerima na novčanicama.
Luminiscencija: Proizvodnja svetlosti, uglavnom na nižim temperaturama, na primer hemijskom reakcijom ili električnom energijom. Inkandescencija je, suprotno, stvaranje svetlosti pri visokim temperaturama.
Fosforescencija: Isto što i fluorescencija, ali sjaj traje duže (prema nekim definicijama, preko 10 nanosekundi), na primer kao na nalepnicama koje svelte u mraku.
Zahvalnost
Originalna verzija ovog članka objavljena je u Chemistry Review i reprodukovana je zahvaljujući sa ljubaznoj dozvoli izdavača, Philip Allan. Za pretplatu na Chemistry Review, časopis za učenike hemije od 16-19 godina, posetite: www.philipallan.co.uk/chemistryreview
References
- Furtado S (2009) Painting life green: GFP. Science in School 12: 19-23.
- Shaw A (2002) Genetic chess by the light of a jellyfish. Chemistry Review 12(1): 2-5
- Wallace-Müller K (2011) The DNA detective game. Science in School 19: 30-35.
Resources
- Za neke eksperimente sa luminolom, pogledajte web prezentaciju Declan Fleming-a za starije učenike, sve o hemiluminiscenciji luminola: www.chm.bris.ac.uk/webprojects2002/fleming/experimental.htm
- Da naučite o drugim vrstama svetlosti u hemiji, pogledajte:
-
Douglas P, Garley M (2010) Chemistry and light. Science in School 14: 63-68.
-
Review
Ovaj članak nudi način za motivaciju učenika za razumevanje hemijskih reakcija. Iako možda nisu zainteresovani da saznaju zašto svetleći štapić svetli u mraku, sigurno će biti voljni da saznaju kako svici ili meduze proizvode svetlo, ili da otkriju kako se detektuje krv na mestima zločina. Ovaj članak se može koristiti ili kao uvod u hemijske reakcije ili za davanje atraktivnih primera redoks reakcija a takođe i za ilustrovanje enetgetskih nivoa u ljusci atoma.
Ovaj članak može biti adaptiran za različite starosne grupe i za različite predmete i teme. Za učenike od 14-15 godina, može biti korišćen za učenje hemije (atomska struktura i kretanje elektrona između ljuski, uvod u hemijske reakcije) ili biologije (biolouminiscencija). Za ovu starosnu grupu, nastavnik bi morao da pojednostavi informacije iz ovog članka i izostavi detalje reakcija. Za učenike od 16 -18 godina, članak bi mogao da se koristi za podučavanje hemije (redoks reakcije, katalizatori, uticaj temperature na brzinu reakcije, uticaj pH na reakciju i kovalentne veze), fizike (elektromagnetni spektar i fotoni) ili genetike (genetski inženjering). Prikladna pitanja za razumevanje teksta uključuju:
- Šta je hemiluminiscencija?
- Za šta forenzičari koriste hemiluminiscenciju?
- Objasnite neke biološke funkcije bioluminiscencije.
- Zašto biste trebali da čuvate svetleće štapiće u zamrzivaču kada ih ne koristite?
- Kako biste mogli da napravite božično drvo koje samo svetli?
Ana Gil, Španija