Lumina vie: chimia bioluminescenţei Teach article
Tradus de Mircea Băduţ. Daţi strălucire lecţiilor de chimie folosind bioluminescenţa.

Pentru imagine mulţumim lui
Chris Favero; sursa imaginii:
Flickr
Manifestările bioluminescente constituie una dintre minunile lumii naturale. Frumuseţea pură a luminilor din dansul aerian al licuricilor, sau strălucirea valurilor albastre cauzate de planctonul din ocean, au fascinat oamenii de milenii. Deşi încă găsim încântare vizuală în astfel de manifestări, acum suntem capabili să înțelegem chimia care stă la baza acestora – şi chiar o putem adapta pentru a fi utilizată în laborator sau în practică.
O multitudine de organisme, de la insecte, peşti şi moluşte, la bacterii şi plancton, pot face lumină – lucru ştiut de mii de ani. Autorul roman Pliniu-cel-Bătrân descria un crustaceu comestibil, Pholas dactylus, care emitea lumină atunci când era mâncat. Tot din însemnările lui Plinius aflăm şi despre o ciupercă de copac, Omphalotus olearius, care produce incandescenţă pe timp de noapte.
Dar poate că cele mai spectaculoase manifestări de bioluminescenţă provin de la planctonul dinoflagelat, care produce valurile albastre strălucitoare văzute uneori pe suprafața oceanului. Forme mai exotice de bioluminescență se găsesc în adâncurile oceanului; acolo unde nu ajunge deloc lumină de la soare, multe specii şi-au confecţionat propria lumină. Admirabil este peștele-pescar, care foloseşte o lumină suspendată pe propriul craniu pentru a ademeni prada până chiar în dreptul dințiilor săi.

Photinus pyralis
Pentru imagine mulţumim lui
Terry Priest; sursa imaginii:
Flickr
Bioluminescenţa – lumina produsă de oragnismele vii – este prezentă adesea în natură, dar ce avantaje aduce ea speciei care o produce? De fapt, sunt mai multe avantaje, precum:
- Aposematismul (aparenţa de toxicitate) – pentru a părea necomestibil prădătorilor potenţiali. Exemple: licuricii Photinus ignitus şi Lucidata atra.
- Apărare – pentru a speria pradătorii prin emiterea unui impuls luminos în apropiere. Exemplu: mictofidele (peşte-lanternă).
- Curtarea – pentru a comunica înainte sau în timpul împerecherii. Exemplu: licuricii.
- Momeală – pentru a atrage prada potenţială la sursa de lumină. Exemplu: peştele-pescar.
- Camuflaj – pentru a ajuta animalul să se confunde cu mediul înconjurător. După cum se poate vedea, un animal marin va arăta mai închis pe fundalul apei luminoase de la suprafaţă, astfel că producând propria lumină îl va ajuta să se ascundă de predători potenţiali. Exemplu: calmarii, precum Abralia verany.
Culori strălucitoare
În natură, bioluminescenţa produce diferite culori, însă cele mai răspândite sunt albastrul, verdele şi galbenul. Culoare distinctă pe care o specie o emite depinde de mediul în care aceasta a evoluat. Emisia albastră are loc de obicei în adâncimile oceanului, lumina verde se întâlneşte la speciile trăind dealungul liniei de coastă marină, iar galbenul (şi vernilul) este tipic în apele dulci şi la speciile terestre.
Care sunt procesele chimice care produc de fapt bioluminescența? Și cum se obțin diferitele culori – albastru, verde, galben?
Din punct de vedere chimic, cele mai multe fenomene de bioluminescență se datorează reacțiilor de oxigenare: oxigenul reacţionează cu substanţele numite luciferine, iar aceasta produce energie sub formă de lumină. Reacțiile sunt catalizate de enzime denumite luciferaze. În acest proces, luciferinele se oxigenează, devinind oxiluciferine. După cum arată tabelul 1, luciferinele folosite de diferitele specii vii și oxiluciferinele care rezultă din reacţie pot fi destul de variate din punct de vedere chimic.
|
Specia bioluminescentă |
Luciferina |
Oxiluciferina |
|---|---|---|
|
Dinoflagelatele |
Luciferina dinoflagelată C33H3806N4Na2 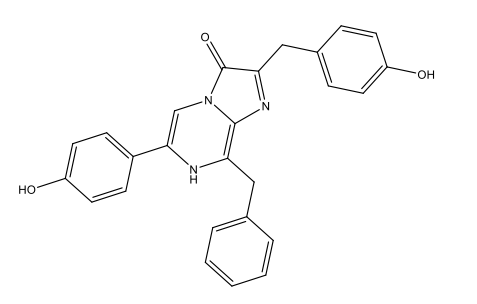 |
 |
|
Calmarii, anumiţi creveţi, anumiţi peşti |
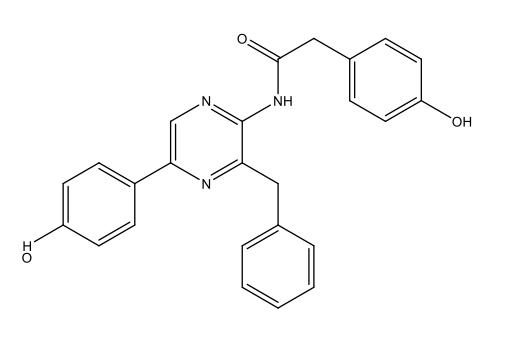
Celenterazina C26H2103N3  |
 |
|
Licuricii |
Luciferina licuriciului C11H8N2O3S2 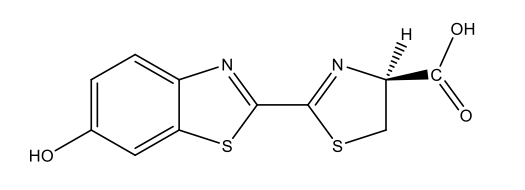 |
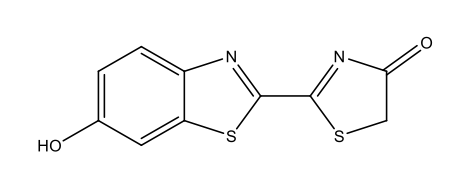 |
Aceste reacții sunt foarte eficiente, aproximativ 98% din energia implicată fiind eliberată ca lumină. Aspectul este uimitor dacă facem comparaţia cu eficiența becului tradițional cu incandescență, care poate scădea până la 2%, şi care pierde multă energie sub formă de căldură.
Așa cum se poate observa la diferite specii, anumite luciferine pot produce lumină având mai multe culori (vedeţi tabelul 2). De asemenea, anumite substanțe suplimentare emițătoare de lumină, sau fluorofori, pot schimba culoarea luminescenței. Meduza Aequorea victoria conține un astfel de fluorofor, cunoscut sub numele de ‘proteina verde fluorescentă’ (GFP). GFP absoarbe lumina albastră produsă prin reacția inițială și o re-emite la o lungime de undă mai mare, ca lumină verde, astfel încât meduza produce o bioluminescență verzuie.
|
Luciferina |
Luminescenţa maximă (nm) |
Culoarea aproximativăw1 |
|
|---|---|---|---|
| Luciferina licuriciului | 560 (at pH=7.1) | Verde |
 |
| 615 (at pH=5.4) | Portocaliu |
 |
|
| Luciferina bacteriană | 490 | Turcuaz |
 |
| Luciferina dinoflagelată | 474 | Albastru |
 |
| Celenterazina | 450-480 as an anion | Albastrui spre turcuaz |
 |
| 400 in the –COOH form | Purpuriu |
 |
|
În ultimele decenii, sistemul particular al bioluminescenței a găsit o utilizare importantă în cercetarea științifică: gena care codifică GFP este acum folosită ca “etichetă” genetică pentru a urmări anumite proteine şi pentru a descoperi când sunt exprimate anumite gene. Pentru că GFP strălucește verde în lumină albastră sau ultra-violetă, este foarte ușor de detectat (vedeţi Furtado, 2009). Această cercetare a fost considerată atât de importantă încât a primit Premiul Nobel pentru chimie în 2008w2.
Din fericire, este destul de uşor să replicăm în laborator tipul de reacţie chimică care generează bioluminescenţă, aşa cum ne arată şi activitatea şcolară descrisă mai jos:
Activitate didactică: bioluminescenţa în laborator
În această lecţie, elevii pot vedea o reacție de luminescență având loc atunci când se amestecă reactivii chimici. Ingredientul cheie este luminolul, o substanță sintetică chemoluminescentă, care produce o strălucire albastră când reacționează chimic. Cu toate că reacțiile luminolului și a luciferinei sunt diferite – reacția de oxidare a luminolului este catalizată de fericianura de potasiu, ci nu de o enzimă (pentru mai multe detalii, vedeţi Welsh, 2011) – rezultatul este același: luminescența.
Partea finală a activităţii de laborator trebuie să se desfăşoare într-o locaţie întunecoasă, pentru a putea evidenţia lumina.
Materiale
- 1 g luminol (5-amino-2,3-dihidroftalazină-1,4-dione) C8H7N3O2
- 50 ml hidroxid de sodiu (NaOH) soluţie 10%
- 50 ml cianură ferică de potasiu (K3[Fe(CN)6]) soluţie 3%
- Aproximativ 0,5 g cianură ferică de potasiu (K3[Fe(CN)6]), solidă
- 3 ml apă oxigenată (peroxid de hidrogen) (H2O2), soluţie 30%
- Apă distilată
- Pahare gradate
- Pâlnie
- Pâlnie
- Mensure
Procedura de lucru
Măsuri de siguranţă:
se recomandă participanţilor să poarte ochelari de protecţie, halat de laborator şi mănuşi de protecţie. O atenţie specială se va acorda manipulării soluţiei de 30% peroxid de hidrogen, deoarece aceasta reacţionează violent în prezenţa anumitor catalizatori. Închideţi sticla de îndată ce aţi scos cei 3 ml de soluţie necesari în experiment.
Consultaţi şi recomandările generale de siguranţă ale revistei Science in School.
- Într-un pahar gradat dizolvaţi 1 gram de luminol în 450 mililitri de apă distilată.
- Adăugaţi 50 ml de soluţie hidroxid de sodiu 10% şi amestecaţi.
- Luaţi 50 ml din soluţia rezultată şi adăugaţi-o peste 350 ml de apă distilată în alt pahar. Aceasta va fi de acum Soluţia A.
- Într-un al treilea pahar, amestecaţi 50 ml de soluţie de cianură ferică de potasiu 3% cu 350 ml de apă distilată şi cu 3 ml de soluţie peroxid de hidrogen 30%. Aceasta va fi Soluţia B.Pour equal amounts of Solutions A and B into separate cylinders.
- Turnaţi cantităţi egale din Soluţiile A şi B în mensure separate.
- Puneţi cinaură ferică de potasiu într-un balon şi puneţi pâlnie la acest balon.
- Mutaţi balonul într-o locaţie întunecoasă.
- Trunaţi Soluţiile A şi B în balon în acelaşi timp, şi priviţi ce se întâmplă.
Se va produce pe loc o încântătoare luminescenţă de culoare albastră!
- Eliminarea deşeului: După încheierea experimentului se va încălzi soluția finală într-o hotă până când volumul său ajunge la 1/8 din cantitatea inițială, apoi se varsă soluția rămasă în rezervorul de reziduuri confecţionat din metal greu.
Ce s-a întâmplat?
Oxidarea luminolului are loc în câteva etape.
- În timpul preparării Soluţiei A (pasul 2), luminolul reacţionează cu baza (OH–):
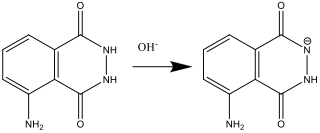
- Când se prepară Soluţia B (pasul 4), peroxidul de hidrigen se descompune şi formează radicalul anion de superoxid O2.-. Această reacţie este catalizată de ionul de hexacianoferat (III).
- Când Soluţiile A şi B se amestecă (pasul 8), luminolul este oxidat de anionul de hexacianoferat (III), formând un radical anion:
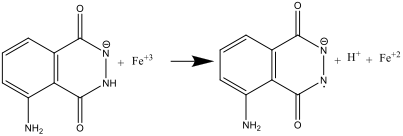
Deci ionul hexacianoferat are un dublu rol: el catalizează formarea anionului radical de superoxid, O2. , dar şi oxidează luminolul într-un radical anion. Fierul trebuie să fie într-o formă complexă, precum [Fe(CN)6] 3, pentru a preveni precipitarea de Fe(OH)3 în mediul puternic alcalin.
- Anionul radical de luminol reacţionează cu anionul radical de superoxid, O2.-:
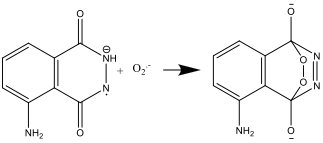
- Compusul rezultat este instabil şi se descompune producând azot dar şi o formă ionizată de aminoftalat:
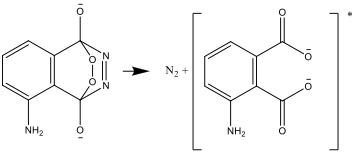
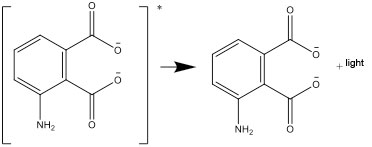
- Compusul ionic se transformă apoi şi ajunge într-o formă stabilă prin emiterea unei diferenţe de energie sub formă de lumină:
Întrebări pentru dezbatere
- În reacţia luminolului, de unde provine energia emisă sub formă de lumină?
- Care este rolul ferocianurii de potasiu? În reacţiile de luminescenţă naturală, ce substanţă joacă acest rol?
- Care substanţă este responsabilă de oxidare în reacţia luminolului? Este la fel în cazul fenomenului natural?
Extensie
Există o mulţime de informaţii disponibile despre bioluminescenţă (vedeţi secţiunea de resurse pentru exemple). Elevii pot continua această lecţie cu cercetări proprii.
De exemplu:
- Aplicări ale bioluminescenţei în natură. Găsiţi cât mai multe motive pentru care bioluminescenţa este o adaptare utilă. Pentru ficare tip de adaptare identificaţi câteva specii care beneficiază de ea.
- Chimia bioluminescenţei. Aflaţi despre câteva reacţii specifice de chemoluminescenţă care au loc în natură. Cât de asemănătoare sunt ele cu reacţia luminolului?
- Culorile bioluminescenţei. Căutaţi informaţii despre cum se produc culorile.
- Evoluţia bioluminescenţei. A evoluat în mai multe etape sau doar într-una?
- Folosirea luminolului în investigaţii criminalistice. Aflaţi cum este folosit luminolul în analizele judiciare şi despre chimia acestei utilizări (vedeţi şi Welsh, 2011).
Studiem chimia cu Pliniu-cel-Bătrân
Activitatea aceasta face parte dintr-un proiect interdisciplinar mai amplu, pus la punct cu elevi de 14-15 ani pentru a explora tehnici străvechi. Pliniu-cel-Bătrân (23-79 e.n.) a fost scriitor roman şi naturalist, iar enciclopedia sa, Naturalis Historia, a reunit multe dintre cunoştiinţele ştiinţifice ale vremii. În această activitate didactică am început fiecare subiect discutând un pasaj din Naturalis Historia şi apoi am încercat să recreem experimentele descrise în acel text sau am realizat experimente similare.
În acest fel elevii au pornit de la aceeași stare pre-științifică ca Pliniu și, prin munca de laborator și prin discuții, au dobândit cunoștințe științifice moderne pe fiecare dintre subiectele studiate. Procesul a fost motivaţional chiar și pentru elevii mai puţini entuziaşti.
Alte activități în cadrul proiectului includ sintetizarea indigoului (Farusi, 2012),recrearea de parfumuri antice (Farusi, 2011), ), prepararea de hipercuburi de sticlă cu acid boric, și prepararea cernelii de fier-tanin (Farusi, 2007).). Întregul proiect a fost prezentat pe Scena Festivalului Internațional de Ştiinţăw3 iîn Copenhaga, Danemarca, în 2011.
References
- Farusi G (2007) Monastic ink: linking chemistry and history. Science in School 6: 36-40
- Farusi G (2011) Smell like Julius Caesar: recreating ancient perfumes in the laboratory. Science in School 21: 40-46
- Farusi G (2012) Indigo: recreating Pharaoh’s dye. Science in School 24: 40-46
- Furtado S (2009) Painting life green: GFP. Science in School 12: 19-23
- Welsh E (2011) Ce este chemoluminescenţa? Science in School 19: 62-68
Web References
- w1 – O unealtă simplă pentru convertirea unei lungimi de undă în nanometrii pentru culorilee RGB sau pentru culorile exprimate hexazecimal este disponibilă pe web-site-ul Academo, care constituie o colecţie de resurse educaţionale.
- w2 – Un cont accesibil pentru Premiul Nobel pentru Chimie din 2008 acordat lui Osamu Shimomura, Martin Chalfie şi Roger Y Tsien, este disponibil pe web-site-ul Premiului Nobel
- w3 – Ştiinţa pe scenă este o reţea de evenimente locale, naţionale şi internaţionale pentru profesori, lansat în 1999 de către EIROforum, editorul publicaţiei Science in School. La fiecare eveniment naţional, o delegaţie de profesori este selectată pentru a-şi reprezenta ţara la festivalul internaţional ‘Science on Stage’. Pe durata festivalului internaţional aproximativ 350 de profesori de şcoli gimnaziale şi liceale din 25 de ţări îşi pun cele mai inovative idei educative în ateliere, în spectacole şi în târguri didactice.Următorul festival internaţional se va ţine pe 29 iunie – 2 iulie 2017, la Debreţin, Ungaria. Participanţii vor fi aleşi prin evenimente competiţionale derulate în 25 de ţări. Pentru a afla mai multe informaţii despre procesul de aplicare la festivalul ‘Ştiinţa pe scenă’, contactaţi comitetul naţional de coordonare.
Resources
- Două articole accesibile despre (bio)luminescenţă:
- Douglas P, Garley M (2010) Chemistry and light. Science in School 14: 63-68.
- Judson O (2015) Luminous life. National Geographic.
- O animaţie despre bioluminescenţă fermecătoare şi instructivă.
- Un video-clip atmosferic celebrând extraordinara frumuseţe a bioluminescenţei oceanice.
- O secvenţă video arătând cum se face luminolul.
- Un video mai lung arătând cum se face luminolul.
Institutions
Science on StageReview
Bioluminescența a fascinat oamenii de mii de ani și continuă să fie un subiect popular de cercetare, în special în proiecte de explorare oceanică. Reacţiile chimice care conduc la producerea luminii de către organisme vii sunt un exemplu deosebit de biochimie. Lucrarea de laborator descrisă în acest articol este utilă pentru implicarea elevilor și pentru provocarea de discuții științifice.
Marie Walsh, Institutul de Tehnologie Limerick, Irelanda





