Moștenirea întunecată a lui van Gogh Understand article
Tradus de Nadia Bucurenci. Galbenul strălucitor din tablourile lui van Gogh se transformă într-un maro murdar. Andrew Brown ne dezvăluie cum explică asta tehnicile sofisticate de raze X puse la dispoziţie de European Synchrotron Radiation Facility din Grenoble, Franţa.
Stilul original al lui Vincent van Gogh (1853-1890), care a influenţat puternic dezvoltarea picturii moderne, are ca punct central atât exuberantele trăsături de penel cât şi culorile, vibrante şi adesea ireale, care transmit emoţii şi crează atmosferă. Datorită pigmenţilor de nouă generaţie din secolul 19, van Gogh a putut crea, de exemplu, nuanţele bogate de galben folosite în faimoasele tablouri Floarea Soarelui. Aceste nuanţe frapante, folosite în multe dintre lucrările lui, conţineau unul dintre aceşti pigmenţi noi, numit galben de crom. Din păcate, după mai mult de 100 de ani de când a fost aşternut de pensula lui van Gogh, galbenul de crom s-a întunecat vizibil ajungând, în unele cazuri, la un maro opac; fenomenul a suscitat interesul unui grup de cercetători.

Pentru imagine, multumim the Van Gogh Museum, Amsterdam

Pentru imagine, multumim the Van Gogh Museum, Amsterdam

Pentru imagine, multumim Acacia217; provenienţa imaginii: Wikimedia Commons

Pentru imagine, multumim the Van Gogh Museum, Amsterdam
O echipă internaţională condusă de Koen Janssens de la University of Antwerp, Belgia, consideră că modificările chimice ale galbenului de crom (PbCrO4 · xPbO) induse de expunerea la lumina ultravioletă (UV) sunt responsabile de alterarea culorii (Monico et al., 2011). Încă de la inventare s-a ştiut ca pigmentul se întunecă sub acţiunea luminii solare. Cauza este reducerea cromului de la Cr(VI) la Cr(III), aşa cum au demonstrat studii din anii ‘50 (vezi Figura 1, mai jos). Totuşi, până acum, mecanismul exact a rămas necunoscut şi produşii de degradare nu au fost caracterizaţi.
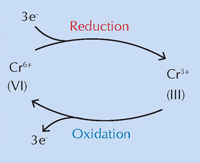
Pentru imagine, multumim Nicola Graf
Tuburi de vopsea istorice
Pentru a aborda aceste necunoscute, echipa lui Janssens a început prin a colecta probe din tuburile de vopsea apaţinând unui contemporan al lui van Gogh, pictorul flamand Rik Wouters (1882-1913). Unele tuburi conţineau vopsea galben de crom pură, în timp ce altele conţineau vopsea cu o nuanţă de galben mai deschisă, obţinută prin amestecarea galbenului de crom cu o substanţă albă. Cercetătorii au îmbătrânit artificial probele la lumină UV, aşteptându-se la o modificare a culorii după câteva luni. Spre surpriza lor, după numai trei săptămâni, suprafaţa vopselei galben deschis devenise maronie. Probele pure s-au modificat mai puţin, comparativ, sau deloc. ”Eram uimiţi”, spune Janssens.

Identificând proba cea mai susceptibilă de a suferi reacţia chimică fatală, echipa a supus-o unor analize sofisticate bazate pe raze X. Cea mai mare parte a experimentelor s-a făcut la European Synchrotron Radiation Facility (ESRF)w1 din Grenoble, Franţa; s-au folosit două tehnici, XRF şi XANES, pentru a detecta, cu mare sensibilitate, distribuţia spaţială şi starea de oxidare a elementelor selectate din probele de vopsea (vezi caseta).
Analizele au dezvăluit că înnegrirea stratului de suprafaţă al pigmentului era legată de reducerea cromului din galbenul de crom de la Cr(VI) la Cr(III); aceasta era în concordanţă cu observaţiile făcute în cazul vopselelor industriale pe bază de cromat de plumb. In plus, produsul de degradare conţinând Cr(III) a fost identificat pentru prima oară ca fiind Cr2O3 · 2H2O, mai cunoscut ca pigment verde viridian. Dar cum poate fi explicată coloraţia maro din experimentele făcute prin prezenţa unui colorant verde ? Oamenii de ştiinţă presupun că cromul redus din verdele viridian se formează în cursul oxidării componentului uleios din vopsea. Tocmai această formă oxidată a uleiului, împreună cu amestecul de verde şi resturi de colorant galben, poate sta la baza colorației maro.
Folosind tehnicile cu raze X, cercetătorii au putut să demonstreze şi că vopseaua amestecată, de nuanţă mai deschisă, conţine compuşi cu sulf. Ei conchid că aceşti compuşi sunt cumva implicaţi în reducerea cromului, ceea ce explică de ce probele de vopsea pură se înnegresc mai puţin, comparativ.
Radiografie cu raze X a lui van Gogh

(View of Arles with Irises).
Clicați pe imagine pentru a o
mări
Pentru imagine, multumim the
Van Gogh Museum, Amsterdam
După descoperirea reacţiilor chimice care au loc în probele de vopsea studiate, cercetătorii au încercat să afle dacă înnegrirea suprafeţei probelor de vopsea galbenă luate din două picturi ale lui van Gogh, Vedere din Arles cu Irişi (View of Arles with Irises) (1888) şi Malurile Senei (Bank of the Seine) (1887), poate fi atribuită aceluiaşi fenomen.
Pentru a cartografia reacţiile chimice din zona aflată la interfaţa dintre stratul de suprafaţă înnegrit şi stratul de vopsea galbenă nealterat de dedesubt, a fost folosită spectroscopia XRF. Au fost înregistrate spectre XANES în anumite puncte din aceste zone. Rezultatele le-au reflectat pe cele din experimentul anterior: forma redusă a cromului, Cr(III), a fost găsită în stratul înnegrit, sugerând că prezenţă lui este responsabilă de coloraţia maro. Mai mult, Cr(III) nu era distribuit uniform, ci apărea în locurile unde existau compuşi conţinând sulfaţi şi bariu.
Din punct de vedere chimic, aceste zone seamănă cu probele de vopsea galben deschis din experimentul anterior, susţinând concluzia cercetătorilor privitoare la implicarea compuşilor cu sulf în reducerea cromului (vezi ecuaţia mai jos). Van Gogh a amestecat pulberi conţinând asemenea compuşi cu galben de crom pentru a obţine, datorită culorii lor albe, nuanţe mai deschise, esenţiale pentru crearea scenelor strălucitor de luminoase caracteristice unei anumite perioade din viaţa sa.
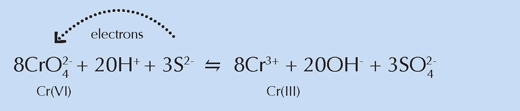
Pentru imagine, multumim Nicola Graf
O întrebare importantă rămîne: cum acţionează concret, lumina UV, presupusul iniţiator al reacţiei ? Foarte simplu, ea furnizează reactanţilor energia necesară pentru depăşirea barierei energiei de activare, permiţând reacţiei să aibă loc (vezi Figura 6, mai jos).
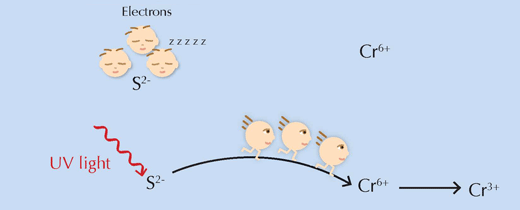
Pentru imagine, multumim Nicola Graf
Ce se poate face?
Echipa lui Janssens a descoperit mecanismul chimic care stă la baza înnegririi picturilor lui van Gogh. Dar putem noi folosi aceste cunoştinţe pentru a salva opera artistului ? Ella Hendriks de la Van Gogh Museumw3 din Amsterdam, Olanda, are îndoieli: ”Lumina ultravioletă… este deja filtrată în muzeele moderne. Picturile sunt expuse într-un mediu controlat ca să se conserve în cele mai bune condiţii.” Parte din ceea ce constituie un mediu controlat este menţinerea unei temperaturi scăzute în muzeu. Ca regulă generală, o încălzire cu 10°C creşte viteza de reacţie cu un factor de 2-4, iar reducerea cromului nu face excepţie de la această regulă.
Deci, dacă nivelul UV şi temperatura sunt deja controlate, ce se poate face mai mult pentru picturile lui van Gogh ? Există o alternativă mai drastică: decât să încetinim procesul de degradare să încercăm, mai curând, să-l inversăm. ”Următoarele experimente sunt deja în curs”, spune Janssens. ”Evident, vrem să înţelegem care sunt condiţiile care favorizează reducerea cromului şi dacă există vreo şansă să readucem coloranţii din picturi la starea originală.”w4
Deşi soluţia ideală ar fi să întoarcem timpul înapoi în acest fel, Janssens este de acord că este puţin probabil să putem readuce coloranţii modificaţi la culoarea originală. Cu toate acestea, studiile oamenilor de ştiinţă ne asigură că facem tot posibilul pentru a conserva picturile lui van Gogh, şi sperăm că generaţiile viitoare vor putea preţui opera acestui mare artist.
Studierea artei cu un sincrotron
Caracterizarea chimică a lucrărilor artistice preţioase poate fi complicată. Pentru analiză pot fi luate numai cîteva probe foarte mici, constituite, cel mai adesea, dintr-un amestec complex de diverse componente în stări de agregare heterogene. Pentru a depăşi aceste dificultăţi, cercetătorii folosesc tehnici bazate pe raze X. Cu cât razele X au putere şi precizie mai mare, cu atât este mai bună calitatea analizei. Cele mai puternice raze X disponibile sunt cele produse de sincrotronw2 (vezi Figura 2, mai jos). În acest studiu, probele de vopsea au fost analizate la ESRF prin două tehnici spectroscopice: XRF şi XANES.
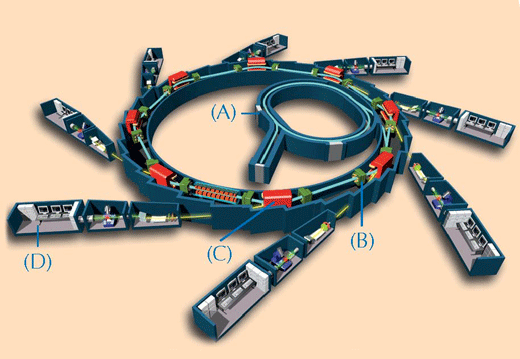
Pentru imagine, multumim EPSIM 3D / JF Santarelli, Synchrotron Soleil; provenienţa imaginii: Wikimedia Commons
XANES
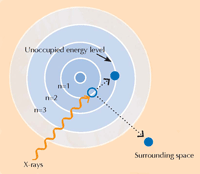
Spectroscopia XANES se bazează pe fizica absorbţiei razelor X. Atomii unui anumit element absorb razele X în mod caracteristic. Prin analiza spectrului de absorbţie a razelor X, care este reprezentarea absorbţiei razelor X de către o anumită probă (axa Y) în funcţie de energia razelor X (axa X), se pot identifica elementele componente din probă. Spectrele de absorbţie de raze X de înaltă rezoluţie se înregistrează, de obicei, în anumite domenii de energie (denumite XANES) care sunt apropiate de limita de absorbţie (absorption edge) a elementului de interes (vezi Figura 3, mai jos, şi 4). Asemenea spectre detaliate arată în ce stare de oxidare este elementul de interes. Această informaţie este extrem de importantă pentru cercetători.
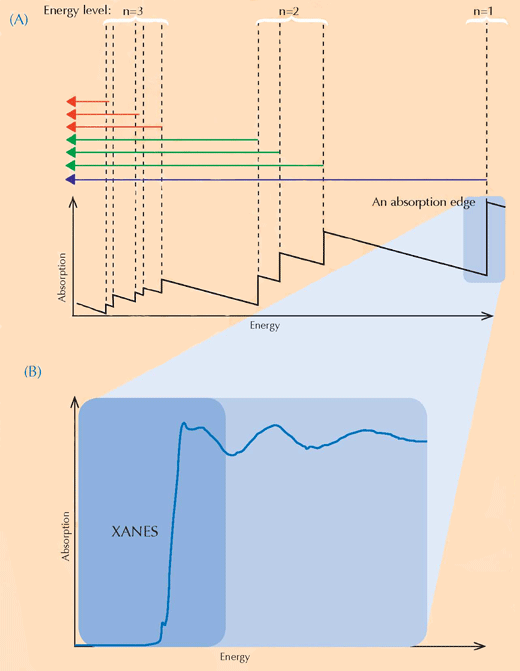
Pentru imagine, multumim Atenderhold; provenienţa imaginii: Wikimedia Commons (B) O limită de absorbţie în detaliu. Dacă mărim o limită de absorpţie aparent netedă, descoperim că este formată din mai multe proeminenţe care corespund mai multor mici absorbţii succesive. Regiunea liniei principale (umbrită cu albastru) din limita de absorbţie se numeşte ‘X-ray Absorption Near-Edge Structure’ (XANES, dreptunghiul albastru) şi corespunde electronilor care fac tranziţia spre nivelele de energie libere din apropierea nivelului pe care l-au părăsit. Regiunea XANES a fost folosită de cercetătorii care au analizat picturile lui van Gogh, pentru că furnizează informaţii despre starea de oxidare a atomilor din probă: atomii în stări diferite de oxidare conţin număr diferit de electroni (vezi Figura 1, mai sus): Acest fapt modifică valoarea nivelurilor energetice şi, în consecinţă, spectrele XANES
Pentru imagine, multumim M Blank: provenienţa imaginii; Wikimedia Commons
Pentru imagine, multumim Nicola Graf
XRF
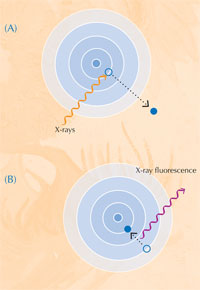
Când absorb raze X, atomii intră într-o stare de excitare instabilă. Când revin la o stare mai stabilă, ei emit raze X secundare, proces numit fluorescenţă de raze X (vexi Figura 5). Tiparul fluorescenţei de raze X (XRF) produsă de o probă individuală, numit spectru XRF, poate fi folosit pentru a cartografia distribuţia elementelor într-o arie dată. Spre deosebire de XRF, XANES poate fi efectuat numai pe un punct izolat din probă. Combinând informaţiile obţinute prin XRF şi XANES, autorii şi-au putut forma o imagine detaliată a reacţiilor chimice care au loc în probele de vopsea.
Pentru imagine, multumim Nicola Graf
Știința în artă
Care este părerea dumneavoastră ? Trebuie folosită ştiinţa pentru a opri degradarea operelor de artă, sau chiar pentru readucerea lor la starea originală ? Sau ravagiile timpului trebuie acceptate si chiar apreciate ca mărturii istorice ?
References
- Monico L et al. (2011) Degradation process of lead chromate in paintings by Vincent van Gogh studied by means of synchrotron X-ray spectromicroscopy and related methods. 2. Original paint layer samples. Analytical Chemistry 83: 1224-1231. doi: 10.1021/ac1025122
Web References
- w1 – European Synchrotron Radiation Facility (ESRF) este un institut de cercetare internaţional care utilizează fotoni pentru studii de avangardă. ESRF este membru al EIROforum, editorul Science in School. Pentru mai multe informaţii, vizitaţi: www.esrf.eu
- w2 – Pentru mai multe detalii privind utilizarea radiaţiei sincrotronului în cercetare:
- Capellas M, Cornuéjols D (2006) Shipwreck: science to the rescue! Science in School 1: 26-29.
- Capellas M (2007) Recovering Pompeii. Science in School 6: 14-19.
- w3 – Pentru a afla mai multe despre Vincent van Gogh şi opera sa, vizitaţi excelentul site web al Muzeului Van Gogh: www.vangoghmuseum.nl
- O secţiune a sitului web al muzeului conţine chiar resurse didactice pentru cursul primar sau gimnazial: www.vangoghmuseum.nl/vgm/index.jsp?page=110&lang=en
- w4 – Pentru a asculta un interviu cu Koen Janssens despre cercetările sale asupra picturilor lui van Gogh, difuzat de BBC Radio 4: www.bbc.co.uk/programmes/b00yjs49
- w5 – CLEAPSS este un organ consultativ din Marea Britanie care acordă sprijin în educaţia ştiinţifică şi tehnologică pe subiecte privind securitatea şi sănătatea în muncă, evaluarea riscurilor, surse şi utilizări ale substanţelor chimice, organismelor vii şi echipamentelor. Pentru mai multe informaţii: www.cleapss.org.uk
- Pentru recomandări de securitate cu privire la utilizarea plumbului, cromului şi compuşilor lor, a se vedea fişele tehnice de protecţia muncii pentru elevi, care pot fi descărcate gratuit de aici: http://www.cleapss.org.uk/free-publications/general-publications
Resources
- Imagini şi un desen animat prezentând investigarea probelor istorice de vopsea pot fi găsite la: www.vangogh.ua.ac.be
- Pentru a afla mai multe despre ştiinţa conservării operelor de artă:
- Leigh V (2009) The science of preserving art. Science in School 12: 70-75.
Institutions
Review
Acest articol face o conexiune reuşită între ştiinţă, artă şi studiile de conservare a operelor de artă. Tehnicile sofisticate folosite de oamenii de ştiinţă au evidenţiat modificări chimice ale pigmenţilor, apărute la zeci de ani după ce picturile lui Van Gogh au fost terminate.
Articolul este o modalitate utilă de a demonstra elevilor că există întotdeauna o explicaţie ştiinţifică pentru modificările suferite de artefacte în timp. Cea mai indicată utilizare ar fi ca material didactic în lecţiile de chimie şi pentru elevii între 16 şi18 ani. Articolul ar putea fi folosit, de asemenea, pentru a preda anumite subiecte din chimie, cum ar fi oxidarea şi reducerea.
Pentru a stimula înţelegerea noţiunilor de chimie care stau la baza cercetării, elevilor li se pot pune următoarele întrebări:
- Lucrările oamenilor de stiinta descrise în acest articol arată că ionii de sulfură pot fi speciile chimice responsabile de reducerea cromului. Scrieți separat ecuaţiile de reducere a cromatului de plumb (PbCrO4) de către H2S şi PbS, compuşi care conţin ioni sulfură . Sugestie: compuşii Cr(VI) sunt agenţi oxidanţi.
- Oamenii de știință sugerează că sursa ionilor sulfură ar putea fi compușii care conțin sulfat din vopseaua utilizată de van Gogh. Încercaţi să vă gândiţi la alte modalităţi prin care picturile ar putea fi expuse la ioni de sulfură.
- Bijuteriile de argint se înnegresc în timp în contact cu aerul. Scrieţi ecuaţia reacţiei responsabile de acest fenomen. Reţineţi că nu este vorba despre o simplă reacție de substituție.
Pentru a arăta că, expus la ioni sulfură, cromatul de plumb se închide la culoare, se poate face următoarea experiență în clasă:
- Sintetizați cromat de plumb într-un recipient prin adăugarea unei sări de plumb solubile, cum ar fi acetatul de plumb(II), Pb(CH3COO)2sau azotatul de plumb(II), Pb(NO3)2, tla un volum egal de soluție de cromat de potasiu, K2CrO4. Sunt suficiente soluţii diluate (~ 0,03 M).
- Se formează imediat un precipitat galben de cromat de plumb. Se filtrează lichidul rezidual folosind o pâlnie şi hârtie de filtru. Într-o hotă cu tiraj, se usucă cu grijă precipitatul cu un uscător cu aer, asigurându-ne că nu se usucă complet.
- Se prepară o soluţie apoasă diluată de hidrogen sulfurat (H2S) prin dizolvarea a 50 mg de sulfură de sodiu (Na2S) în 90 ml de apă.Adăugaţi soluţia rezultată la 10 ml acid clorhidric (HCl, 0,1 M). Se agită amestecul.
- Umpleți un balon de cauciuc cu aer şi conectaţi-l la un vas Drechsel mic care conține câţiva mililitri din soluţia diluată de hidrogen sulfurat (vezi imaginea de mai jos). Îndreptaţi fluxul de aer rezultat, care conține hidrogen sulfurat, spre suprafaţa precipitatului de cromat de plumb.
- Precipitatul va deveni instantaneu maro. Ați simulat şi accelerat, cu mai multe ordine de mărime, procesul de înnegrire observat în picturile lui van Gogh.
Notă de protecţia muncii: Toate sărurile solubile de plumb sunt toxice, cromaţii solubili sunt toxici (peste 0,003 M) şi sunt suspectați de a fi cancerigeni. Cromatul de potasiu poate provoca sensibilizare şi/ sau ulceraţii la contactul cu pielea. Există puţine dovezi că cromatul de plumb este cancerigen. El poate fi dăunător şi pentru copiii nenăscuţi, deci nu ar trebui utilizat în cazul în care profesoara sau oricare dintre studente sunt, sau ar putea fi, însărcinate. Hidrogenul sulfurat este un gaz toxic, cu un miros foarte neplăcut.
Efectuaţi experimentul de mai sus într-o hotă cu tiraj şi purtaţi ochelari de protecţie şi mănuşi. Dispuneţi de toţi reactivii în conformitate cu reglementările locale privind securitatea şi sănătatea în muncă. A se vedea, de asemenea, Science in School notă generală de protecția muncii. V-ar putea fi de folos consultarea fişelor CLEAPSS de securitate a muncii pentru elevi, pentru crom şi plumbw5.
Vladimir Petruševski, Fosta Republică Iugoslavă a Macedoniei






