O legado de escurecimento de Van Gogh Understand article
Traduzido por António Daniel Barbosa. Os amarelos brilhantes das pinturas de van Gogh estão a tornar-se em castanhos desagradáveis. Andrew Brown revela como técnicas sofisticadas de raio-X, cortesia da European Synchrotron Radiation Facility em Grenoble, França podem explicar essa…
Juntamente com as suas pinceladas entusiásticas, a escolha de Vicent van Gogh (1853-1890) de cores vibrantes e muitas vezes irrealistas para transmitir o estado de espírito e sentimento foram centrais para o seu estilo único, que teve uma influência poderosa no desenvolvimento da pintura moderna. A nova geração de pigmentos do século XIX tornou possível a van Gogh criar, por exemplo, os inestimáveis amarelos usados no seu célebre quadro Os Girassóis. Estes tons marcantes, usados em muito do seu trabalho, continham um destes novos pigmentos, designado por amarelo cromado. Infelizmente, mais de 100 anos após ter deixado o pincel de van Gogh, o amarelo cromado em alguns casos escureceu visivelmente para um castanho menos notável, um fenómeno que mereceu recentemente o interesse de um grupo de cientistas.

Imagem cortesia de Museu Van Gogh, Amesterdão

Imagem cortesia de Museu Van Gogh, Amesterdão

Imagem cortesia de Acacia217; Fonte da Imagem: Wikimedia Commons

Imagem cortesia de Museu Van Gogh, Amesterdão
Uma equipa internacional liderada por Koen Janssens da Universidade de Antuérpia, Bélgica, acredita que as modificações químicas do amarelo cromado (PbCrO4 · xPbO), devido a exposição à luz ultravioleta (UV), são responsáveis por estas transformações cromáticas (Monico et al., 2011). O escurecimento do pigmento à luz solar é conhecido desde a sua invenção. Estudos nos anos cinquenta demonstraram que é causado pela redução do crómio de Cr(VI) a Cr(III) (ver Figura 1, abaixo). No entanto, até este momento, o mecanismo exacto era desconhecido e os produtos da degradação não se encontravam caracterizados.
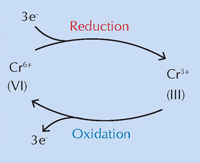
Imagem cortesia de Nicola Graf
Tubos de tinta históricos
Para abordar estes aspectos desconhecidos, a equipa de Janssens começou por recolher amostras de tubos de tinta que pertenciam ao contemporâneo de van Gogh, o pintor Flamengo Rik Wouters (1882-1913). Alguns dos tubos continham uma tinta amarelo cromado não misturada, enquanto outros continham tinta de uma tonalidade mais clara de amarelo, formada através da mistura de amarelo cromado com uma substância branca. Os investigadores envelheceram artificialmente as amostras por exposição a luz UV, esperando observar uma modificação na cor após alguns meses. Para sua surpresa, em apenas três semanas, uma fina camada superficial da tinta amarela mais clara escureceu significativamente para um castanho chocolate. Comparativamente, as amostras não misturadas sofreram pouca ou nenhuma modificação. “Nós ficamos impressionados”, declarou Janssens.

Tendo identificado a amostra mais susceptível de sofrer uma reacção química fatal, a equipa sujeitou-a a uma análise sofisticada baseada em raio-X. Muito do trabalho foi executado no European Synchrotron Radiation Facility (ESRF)w1em Grenoble, França, onde duas técnicas, XRF e XANES, foram usadas para detectar, com extrema sensibilidade, a distribuição espacial e o estado de oxidação dos elementos seleccionados nas amostras de tinta (ver caixa).
As análises revelaram que o escurecimento da fina camada de superfície do pigmento estava relacionado com a redução do crómio no amarelo cromado de Cr(VI) a Cr(III); esta observação está de acordo com o que foi observado em tintas industriais à base de cromato de chumbo. Além disso, o produto de degradação contendo Cr(III) foi identificado pela primeira vez como sendo Cr2O3 · 2H2O, mais conhecido como pigmento verde de óxido de crómio. Mas como pode a presença de um pigmento verde explicar a presença da coloração castanha observada nas experiências dos investigadores? Os cientistas suspeitam que o crómio reduzido no verde de óxido de crómio é formado durante a oxidação do componente do óleo da tinta. É esta forma oxidada do óleo, juntamente com a mistura de verde e qualquer pigmento amarelo remanescente, que poderá ser a raiz da coloração castanha.
Através da utilização de técnicas de raio-X, os investigadores foram igualmente capazes de demonstrar que a tinta de mistura com tonalidade mais clara continha compostos sulfurosos. Concluíram que estes compostos estavam de alguma forma envolvidos na redução do crómio, explicando por que havia um escurecimento inferior relativo nas amostras de tinta que não foram misturadas.
Fazer brilhar o feixe de raio-X em van Gogh

Clique na imagem para
ampliar
Imagem cortesia de Museu Van
Gogh, Amesterdão
Tendo descoberto a química da reacção em amostras isoladas de tinta, os cientistas procuraram determinar se o escurecimento da camada superficial da tinta amarela retirada de dois quadros de van Gogh, Vista de Arles com Lírios (1888) e Margem do Sena (1887), pode ser atribuído ao mesmo fenómeno.
A espectroscopia XRF foi usada para mapear a química da região que abrange a interface ente a camada superficial escura e a camada amarela inalterada subjacente da pintura. Espectros XANES foram recolhidos em pontos específicos dentro destas regiões. Os resultados espelharam os obtidos nas experiências anteriores: a forma reduzida do crómio, Cr(III), foi encontrada na camada superficial escura, sugerindo que a sua presença nesse local era responsável pela coloração castanha. Além disso, o Cr(III) não se encontrava distribuído de forma uniforme, mas surgia nos locais onde também se encontravam compostos contendo sulfato e bário.
Quimicamente, estas regiões assemelhavam-se às amostras de tinta amarela de tonalidade clara da experiência anterior, apoiando as conclusões dos investigadores de que os compostos sulfurosos estavam envolvidos na redução do crómio (ver a equação abaixo). Devido à sua coloração branca, van Gogh misturou pós contendo esses compostos com o amarelo cromado para criar os tons mais suaves que eram fundamentais para criar as cenas iluminadas características de um certo período da sua vida.
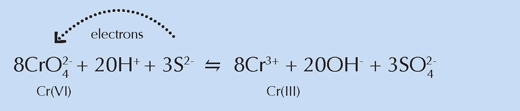
Uma questão importante permanece: de que forma funciona de facto o suposto causador desta reacção, a luz UV? De uma forma bastante simples, ela fornece aos reagentes a energia necessária para ultrapassar a barreira da energia de activação, permitindo que a reacção prossiga (ver Figura 6, abaixo).
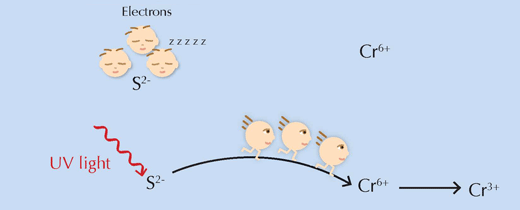
Imagem cortesia de Nicola Graf
O que pode ser feito?
A equipa de Janssens tem exposto a química que está subjacente ao escurecimento das pinturas de van Gogh. Mas será possível usar este conhecimento para salvar o trabalho do artista? Ella Hendriks do Museu Van Goghw3 em Amesterdão, Holanda, tem as suas dúvidas: “A luz ultravioleta… é já filtrada nos museus modernos. Nós apresentamos as pinturas num ambiente controlado para mantê-las nas melhores condições possíveis”. Parte do que constitui um ambiente controlado traduz-se na manutenção de baixas temperaturas no museu. Como regra geral, um aumento de 10ºC aumenta a velocidade de uma reacção por um factor de 2-4, e a redução do crómio não é excepção.
Se os níveis de UV e as temperaturas são já controladas, o que pode mais ser feito pelas pinturas de van Gogh? Existe uma alternativa mais radical: em vez de diminuir o processo de degradação, tentar reverte-lo totalmente. “As nossas próximas experiências estão já a ser preparadas”, afirma Janssens. “Obviamente, nós pretendemos perceber quais as condições que favorecem a redução do crómio e se existe alguma esperança de reverter os pigmentos ao seu estado original nas pinturas.”w4
Apesar de retroceder os efeitos do tempo desta forma ser a solução extrema, Janssens admite que a perspectiva de reverter o pigmento alterado à sua cor original é actualmente pouco provável. Apesar disso, o trabalho dos cientistas oferece-nos confiança de que estamos a fazer tudo o que podemos para preservar as pinturas de van Gogh e esperamos que as gerações futuras possam apreciar o que este grande artista alcançou.
O estudo da arte com um síncrotron
A caracterização química de obras de arte preciosas pode ser problemática. Só é possível retirar algumas amostras muito pequenas para análise e estas frequentemente consistem numa mistura de compostos complexos em estados de matéria heterogéneos. Para superar estes desafios, os cientistas usam técnicas que se baseiam em raio-X. Quanto mais potentes e precisos os raios-X forem, melhor será a qualidade das análises. Os raios-X mais potentes disponíveis são produzidos por uma fonte síncrotronw2(ver Figura 2, abaixo). Neste estudo, duas técnicas espectroscópicas no ESRF foram usadas nas amostras de tinta: XRF e XANES.
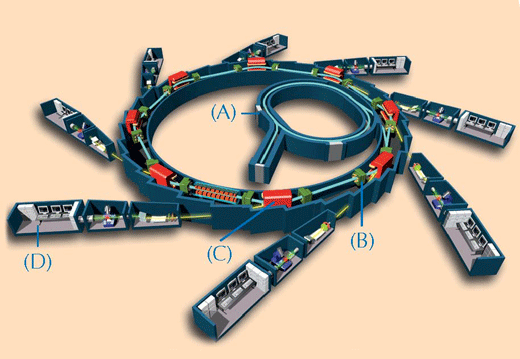
Imagem cortesia de EPSIM 3D / JF Santarelli, Synchrotron Soleil; Fonte da Imagem: Wikimedia Commons
XANES
A espectroscopia XANES baseia-se na física de absorção de raio-X. Os átomos de um elemento específico absorvem raios-X de uma forma característica. Através da observação do espectro de absorção de raio-X, que consiste no padrão de absorção de raio-X de uma amostra específica (eixo Y) em relação à gama de energia dos raios-X (eixo X), é possível, desta forma, identificar os elementos constituintes de uma amostra. Espectros de absorção de alta resolução são habitualmente recolhidos em regiões específicas de energia (designadas por XANES) que são próximas do limiar de absorção de um elemento de interesse (ver Figuras 3, abaixo, e 4). Esses espectros detalhados podem mostrar em que estado de oxidação se encontra um elemento de interesse. Esta informação foi de grande utilidade para os investigadores.
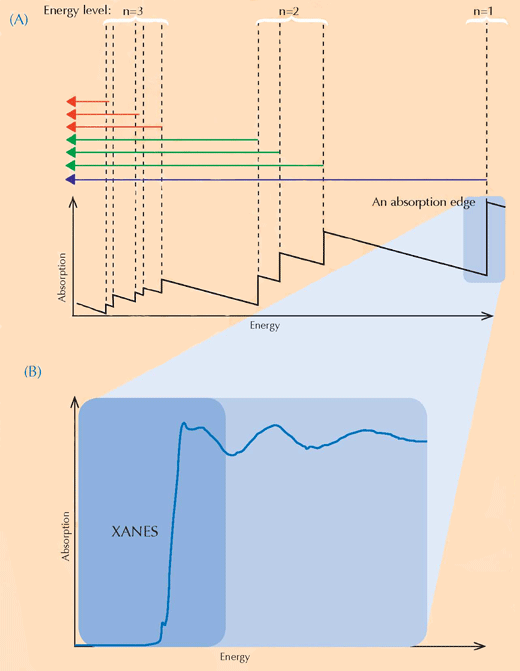
Imagem cortesia de Atenderhold; Fonte da Imagem: Wikimedia Commons (B) Um limiar de absorção em detalhe. Quando ampliamos um limiar de absorção aparentemente liso, descobrimos que este é composto por diversas marcas mais pequenas relacionadas com absorções correspondentemente mais pequenas. A região no limiar principal (sombreado a azul) do limiar de absorção é designado por Estrutura Fina de raio-X próxima do Limiar de Absorção (XANES, a caixa azul) e corresponde a electrões que fazem transições para níveis de energia não ocupados próximos daqueles que deixam. A região XANES foi usada por cientistas que analisaram as pinturas de van Gogh porque esta técnica pode fornecer informação sobre o estado de oxidação dos átomos na amostra: átomos que têm diferentes estados de oxidação contêm diferentes números de electrões (ver Figura 1, acima). Isto altera o valor dos seus níveis de energia e, desta forma, os seus espectros XANES
Imagem cortesia de M Blank; Fonte da Imagem; Wikimedia Commons
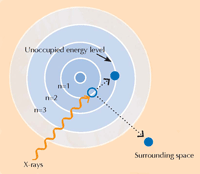
Imagem cortesia de Nicola Graf
XRF
Quando absorvem raios-X, os átomos entram num estado excitado instável. Quando regressam ao estado fundamental, emitem raios-X secundários num processo designado por fluorescência de raio-X (ver Figura 5). O padrão de fluorescência de raio-X (XRF) produzido por uma amostra específica, designado por espectro XRF, pode ser usado para mapear a distribuição de elementos ao longo de uma área específica. Em contraste, XANES só pode ser executada num ponto isolado na amostra. Através da combinação da informação obtida por XRF e XANES, os autores foram capazes de formar um retrato detalhado da química das amostras de tinta.
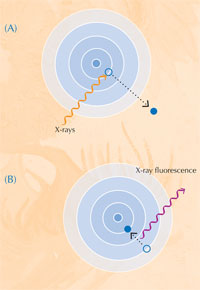
Imagem cortesia de Nicola Graf
Ciência na arte
O que pensa você e os seus alunos? Deve a ciência ser usada para parar a degradação de obras de arte importantes, ou mesmo reverte-las ao seu estado original? Ou devem os estragos do tempo serem aceites e mesmo apreciados como evidências históricas?
References
- Monico L et al. (2011) Degradation process of lead chromate in paintings by Vincent van Gogh studied by means of synchrotron X-ray spectromicroscopy and related methods. 2. Original paint layer samples. Analytical Chemistry 83: 1224-1231. doi: 10.1021/ac1025122
Web References
- w1 – O European Synchrotron Radiation Facility (ESRF) é um instituto de investigação internacional dedicado a ciência de ponta utilizando fotões. O ESFR é um membro do EIROforum, o editor da Science in School. Para saber mais, visitar: www.esrf.eu
- w2 – Para mais detalhes sobre como a radiação síncrotron é usada na investigação, consultar:
- Capellas M, Cornuéjols D (2006) Shipwreck: science to the rescue! Science in School 1: 26-29.
- Capellas M (2007) Recovering Pompeii. Science in School 6: 14-19.
- w3 – Para saber mais sobre Vincent van Gogh e a sua obra, consulte o excelente website do Museu Van Gogh: www.vangoghmuseum.nl
- Uma secção do website do museu também contem recursos didácticos para escolas primárias e secundárias: www.vangoghmuseum.nl/vgm/index.jsp?page=110&lang=en
- w4 – Para escutar uma entrevista com Koen Janssens sobre a sua investigação relacionada com as obras de van Gogh, transmitida na BBC Radio 4, consultar: www.bbc.co.uk/programmes/b00yjs49
- w5 – CLEAPSS é um serviço de consultadoria que fornece apoio ao ensino de ciência e tecnologia em assuntos de saúde e segurança; avaliação de risco; fonte e uso de químicos; e seres vivos e equipamento. Para mais informações, consultar: www.cleapss.org.uk
- Para conselhos de segurança sobre o uso de chumbo, crómio e os seus compostos, consultar as folhas de segurança para estudantes, que podem ser descarregadas gratuitamente aqui: http://www.cleapss.org.uk/free-publications/general-publications
Resources
- Imagens e animações sobre a investigação de tubos de tinta históricos podem ser encontradas em: www.vangogh.ua.ac.be
- Para saber mais sobre a ciência de preservação de obras de arte, consultar:
- Leigh V (2009) The science of preserving art. Science in School 12: 70-75.
Institutions
Review
Este artigo une de uma forma agradável a ciência com a arte e os estudos de conservação. As técnicas sofisticadas usadas pelos cientistas demonstram modificações químicas nos pigmentos, que ocorreram muitas décadas após as pinturas de van Gogh terem sido terminadas.
O artigo é uma forma útil de demonstrar aos alunos que existe sempre uma explicação científica para os artefactos se modificarem ao longo do tempo. Seria usado da forma mais conveniente como apoio ao ensino nas aulas de química e para estudantes entre os 16-18 anos. O artigo pode também ser usado para ensinar tópicos de química específicos, como a oxidação e a redução.
Para desenvolver a compreensão dos alunos da química subjacente à investigação, podem ser colocadas as seguintes questões:
- O trabalho dos cientistas descrito neste artigo demonstra que os iões sulfureto podem ser as espécies químicas responsáveis pela redução do crómio. Escreve equações em separado para a redução do cromato de chumbo (PbCrO4) pelos compostos contendo sulfureto H2S e PbS. Sugestão: Compostos de Cr(VI) são agentes oxidantes.
- Os cientistas sugerem que compostos contendo sulfato nas tintas usadas por van Gogh podem ser uma fonte de iões sulfureto. Tenta pensar em outras formas pelas quais as pinturas podem ser expostas a iões sulfureto.
- Jóias contendo prata escurecem ao longo do tempo em contacto com o ar. Escreve as equações das reacções responsáveis por este fenómeno. Nota que esta não é simplesmente uma reacção de deslocamento.
Para mostrar que o cromato de chumbo escurece quando exposto a iões sulfureto, a seguinte experiência pode ser demonstrada na sala de aula:
- Sintetize cromato de chumbo num gobelé pela adição de um qualquer sal de chumbo solúvel em água, como o acetato de chumbo(II), Pb(CH3COO)2, ou nitrato de chumbo(II), Pb(NO3)2, a um igual volume de uma solução de cromato de potássio, K2CrO4. Soluções diluídas (~ 0.03M) serão suficientes.
- Um precipitado amarelo de cromato de chumbo formar-se-á instantaneamente. Filtre o líquido residual usando um funil e um papel de filtro. Seque o precipitado gentilmente com um secador numa hotte, assegurando que não seca completamente.
- Prepare uma solução aquosa diluída de ácido sulfídrico (H2S) dissolvendo 50 mg de sulfureto de sódio (Na2S) em 90 ml de água. Adicionar a solução resultante a 10 ml de ácido clorídrico (HCl, 0.1 M). Agitar a mistura.
- Encha um balão de borracha com ar e ligue-o a uma pequena garrafa Drechsel de vidro contendo alguns mililitros da solução diluída de ácido sulfídrico (ver a imagem abaixo). Aponte o fluxo resultante de ar contendo o gás sulfureto de hidrogénio para a superfície do precipitado de cromato de chumbo.
- O precipitado irá tornar-se castanho instantaneamente. Terá simulado e acelerado o processo de escurecimento observado nas pinturas de van Gogh em muitas ordens de magnitude.
Nota de segurança: Todos os sais solúveis de chumbo são tóxicos e os cromatos solúveis são tóxicos (acima de 0.003 M) e suspeita-se que sejam carcinogénicos. O cromato de potássio pode causar sensibilização e/ou úlceras após contacto com a pele. Existem evidências limitadas que o cromato de chumbo seja carcinogénico. Também pode causar danos a nascituros, pelo que não deve ser usado se a professora ou alguma aluna esteja, ou possa estar, grávida. O sulfureto de hidrogénio é um gás tóxico com um odor desagradável.
Execute a experiencia supracitada numa hotte e use óculos de segurança e luvas. Elimine todos os produtos químicos de acordo com as regras de segurança locais. Veja também as notas gerais de segurança. da Science in School. Poderá considerar útil consultar as folhas de segurança para estudantes do CLEAPSS sobre crómio e chumbow5.
Vladimir Petruševski, Antiga República Jugoslava da Macedónia






