Ce este chemoluminescenţa? Understand article
Tradus de Mircea Băduţ. Meduze luminescente, licurici, beţe amuzant-luminoase; Emma Welsh prezintă frumoasa şi misterioasa lume a chemoluminescenţei.

Pentru imagine, multumim Erik
Solheim; Sursa imaginii:
Wikimedia Commons
Licuricii, meduzele şi beţele luminoase – unele zboară, altele trăiesc în adâncurile oceanului, iar altele furnizează divertisment în cluburile de noapte. Care este legătura dintre ele? Răspunsul stă în anumite reacţii chimice care produc lumină.
Chemoluminescenţa constă în producerea de lumină printr-o reacţie chimică. Două substanţe chimice reacţionează şi ajung într-o stare intermediară excitată (de energie ridicată), care se echilibrează eliberând energie sub formă de fotoni de lumină (pentru cuvintele îngroşate vedeţi glosarul de termeni de la finalul articolului), ajungându-se astfel într-o stare de echilibru (vedeţi ma jos Figura 1).
A + B -> AB* -> Produşi + Lumină
Excitat
intermediar
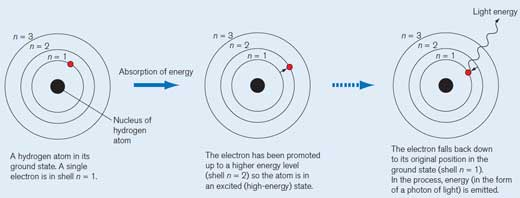
Un atom de hidrogen în stare de echilibru neutru. Are un singur electron pe stratul n = 1. Fiecare strat electronic are propriul nivel energetic.
Când atomul de hidrogen absoarbe o cuantă de energie (o anume cantitate discretă de energie), el trece într-o stare de energie superioară (stratul n = 2) aflându-se într-o stare excitată (energie înaltă). Marcăm cu un asterisc (*) molecula pentru a semnala acest fapt.
Electronul revine pe în poziţia sa iniţială de echilibru stabil (respectiv pe stratul n = 1). În acest proces, se emite o mică cantiate de energie (un foton) sub formă de radiaţie electromagnetică. Lungimea de undă a energiei emise depinde de cantitatea de energie eliberată. Dacă lungimea de undă se află în spectrul vizibil, atunci tranziţia electronului va fi percepută ca o lumină de o anumită culoare. Lungimea de undă determină culoarea (vedeţi mai jos Figura 2)
Pentru imagine, multumim Chemistry Review
Pentru imagine, multumim NASA
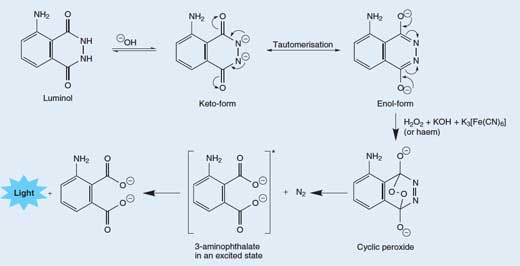
De obicei reacţiile chemoluminescente nu eliberează căldură tocmai pentru că energia este eliberată sub formă de lumină. Luminolul produce lumină când reacţionează cu un agent oxidant; reacţia chimică este prezentată în Caseta 1.
Castea 1: Luminolul – o substanţă luminând în umbră
Eliberarea unui foton de lumină dintr-o moleculă de luminol se realizează într-un proces realtiv complex, în mai multe stadii. Într-o soluţie bazică (alcalină), luminolul se află în echilibru cu anionii săi, care poartă sarcina -2. Anionii pot exista în două forme (tautomeri), cu cele două sarcini negative delocalizate fie pe exogen (forma de enol) fie pe azot (forma ketol; precum în Figura 3 de mai jos).
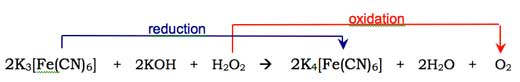
Molecula de oxigen (O2) se combină cu forma de enol a anionului de luminol, oxidând-o într-un peroxid ciclic. Oxigenul necesar este produs între reacţie redox (adică o reacţie în care se realizează atât reducere cât şi oxidare) implicând peroxidul de hidrogen (H2O2), hidroxidul de potasiu şi (de examplu) hexacianoferatul de potasiu (III) (K3[Fe(CN)6], cunoscut şi ca ferocianida de potasiu). Ionul de hexacianoferat(III) ([Fe(CN)6]3->) se reduce în ionul de hexacianoferat(II) ([Fe(CN)6]4-, rezultând ferocianida de potasiu, K4[Fe(CN)6]), iar cei doi atomi de oxigen din peroxidul de hidrogen sunt oxidaţi din starea “-1” în starea “0”:
Peroxidul ciclic se descompune apoi în aminoflatat-3 (3-amino-1,2- acid benzenodicarboxilic) într-o stare excitată, împreună cu molecula de azot (N2) – vedeţi Figura 3, mai jos. Această reacţie de descompunere este favorizată deoarece molecula de peroxid ciclic este foarte instabilă, iar reacţia presupune ruperea unor legături slabe. Este de asemenea favorizată datorită creşterii entropiei (dezordinii) determinată de eliberarea unei molecule de gaz. Când aminoftalatul-3 revine în starea de echilibru, se eliberează un foton de lumină albastră.
Pentru imagine, multumim Chemistry Review
Chemoluminescenţa în medicina legală
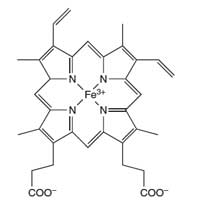
prostetică, hemul, din
hemoglobină
Atomul de fier (Fe) din
centrul inelului porfirin
catalizează reacţia
luminolului
Pentru imagine, multumim
Chemistry Review
Specialiştii în investigaţii judiciare folosesc reacţia luminolului pentru a detecta urme de sânge la locul crimelor. Un amestec de luminol într-o soluţie diluată de peroxid de hidrogen este pulverizată pe suprafaţa unde specialiştii caută existenţa urmelor de sânge. Fierul prezent în (componenta prostetică, hemul, din) hemoglobina din sânge (vedeţi Figura 4) acţionează ca un catalizator în reacţia descrisă în Caseta 1. Încăperea trebuie să fie întunecată, iar dacă acolo sunt urme de sânge, se va observa o strălucire albastră ce durează aproximativ 30 de secunde. Investigatorii judiciari pot înregistra fotografic această luminescenţă, ceea ce – în procesul judiciar – poate constitui dovada privind prezenţa sângelui la locul faptei. (Pentru a afla mai multe despre ştiinţa investigaţiilor judiciare vedeţi în bibliografie Wallace-Müller, 2011.
Deoarece fierul acţionează ca un catalizator, el este folosit doar pentru a detecta urme, fiind deci suficientă o cantitate mică de sânge pentru a produce rezultate pozitive. Aceasta înseamnă că sângele poate fi detectat chiar dacă urmele nu sunt vizibile cu ochiul liber.

unei crime
Pentru imagine, multumim How
Stuff Works
Un dezavantaj al folosirii luminolului este că reacţia poate fi catalizată şi de alte substanţe chimice existente la locul faptei, de exemplu de aliajele de cupru, de anumite soluţii de spălare, precum decolorantul, sau chiar de către hrean. Infractorii versaţi ar putea şterge urmele de sânge cu înălbitor, ceea ce distruge dovada sângelui, însă decolorarea covorului poate alerta mai rapid în privinţa faptei criminale. Urina conţine de asemenea mici cantităţi de sânge, care pot fi suficiente pentru a cataliza reacţia luminolului. După ce a fost realizat un test cu luminol, acel loc nu mai poate fi investigat din nou. Totuşi, în ciuda dezavantajelor sale, luminolul este încă folosit de investigatorii judiciari ca unealtă pentru a rezolva infracţiunile violente.
În cluburile de noapte
un băţ luminos. Clicați pe
imagine pentru a o mări
Pentru imagine, multumim
Chemistry Review
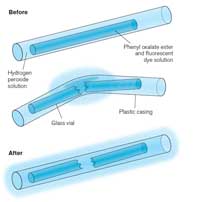
Când activaţi un băţ luminos, el începe să strălucească, iar lumina produsă este un exemplu de chemoluminescenţă (vedeţi Figura 5). Beţele luminoase sunt compuse dintr-un tub de plastic etanş conţinând un amestec de difenil-oxalat şi un colorant (care va determina culoarea băţujlui luminos). În interiorul tubului de plastic există un mic tub de sticlă conţinând peroxid de hidrogen. Când tubul exterior este îndoit, tubuleţul interior se sparge, eliberând peroxidul de hidrogen şi demarând reacţia chimică ce produce lumină (vedeţi Caseta 2). Culoarea luminii este determinată de colorantul din băţul luminos (vedeţi Caseta 3).
Chemiluminescence reactions, such as those in glow sticks, are temperature-dependent. The reaction speeds up as the temperature rises – snapping your glow stick in hot water will produce a fantastic glow, but it will not last as long as it would at room temperature. Conversely, the reaction rate slows down at low temperature; this is why keeping your glow stick in the freezer for several hours can allow the stick to glow brightly again when it is removed and warmed up, long after it would otherwise have stopped glowing. The reaction does not stop completely in the freezer, but it does slow down so that the glow is barely detectable.
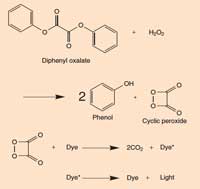
Caseta 2: Chimia beţelor luminoase
mări
Pentru imagine, multumim
Chemistry Review
Când difenil-oxalatul reacţionează cu peroxidul de hidrogen (H2O2), el se oxidează şi rezultă fenolul şi un peroxid ciclic. Peroxidul reacţionează apoi cu molecula colorantului şi rezultă două molecule de dioxid de carbon (CO2) iar în acest proces un electron al moleculei de colorant este adus într-o stare excitată, de energie înaltă. Când molecula excitată revine la starea de echilibru, neutră, se emite un foton de lumină. Reacţia este dependentă de pH: dacă soluţia este uşor alcalină, reacţia produce o lumină mai strălucitoare.
Avertizare de siguranţă
Fenolul este toxic, astfel că dacă băţul luminos prezintă scurgeri evitaţi atingerea lichidului; dacă totuşi se întâmplă contact, spălaţi imediat cu apă şi săpun. Vedeţi şi nota privind măsurile generale de protecţie din Science in School.
Caseta 3: Ce determină culoarea din beţele luminoase?
Coloranţii folosiţi în beţele luminoase sunt componente aromatice conjugate (arene). Gradul de conjugare (din acea hidrocarbură aromată) este reflectat în culoarea distinctă a luminii emise când electronul revine din starea excitată în starea neutră/iniţială.
Beţe luminoase vii

Pentru imagine, multumim
Terry Priest; Sursa imaginii:
Flickr
V-aţi plimbat vreodată pe plajă noaptea şi aţi văzut scânteieri de lumini primprejurul picioarelor? Sau aţi fost la ţară noaptea şi aţi văzut licurici prin aer? Acestea sunt exemple de bioluminescenţă, iar aproximativ 90% din vietăţile din adâncurile mării dovedesc acest straniu fenomen. Aceste organisme au evoluat astfel încât produc lumină cu diverse utilizări. Strălucirea poate funcţiona ca o momeală pentru pradă, ca un camuflaj, sau pentru a atrage potenţialul partener de împerechere. Unele bacterii folosesc bioluminescenţa pentru a comunica.
Termenul “viermi luminoşi” descrie larva unor specii de insecte, inclusiv licuricii; unele dintre ele ilumineazã pentru a alunga prădătorii, altele pentru a-şi ademeni prada. Există specii de calmar şi de crustacee care pot elibera în apă nori de lichid bioluminescent pentru a confuza atacatorii şi pentru a putea fugii nestingheriţi. Creaturile trăind în adâncurile oceanului au evoluat astfel încât produc în principal lumină albastră sau verde, aceasta transmiţându-se mai bine prin apa de mare. Lumina albastră are lungimea de undă mai scurtă decât lumina roşie, fiind deci mai puţin absorbită de particulele din apă.
licuriciului. Clicați pe imagine
pentru a o mări
Pentru imagine, multumim
Chemistry Review (structure)
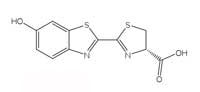
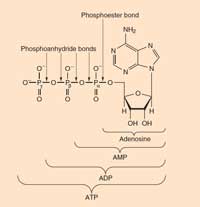
Reacţiile bioluminescente folosesc ATP (trifosfatul de adenozină) ca sursă de energie. Structura moleculelor producătoare-de-lumină variază de la o specie la alta, dar toate poartă numele de luciferine. Structura luciferinei licuriciului este prezentată în Figura 6, în stânga. Când licuriciul luminează, luciferina este oxidată pentru a produce un complex biochimic excitat, care va emite un foton când revine în starea neutră, similar reacţiei chemoluminescente deschise în Caseta 1. Totuşi, licuricii nu folosesc peroxid de hidrogen şi nici hexaciaonoferat de potasiu pentru a oxida luciferina; în schimb ei utilizează molecula de oxigen şi o enzime numită luciferază (şi acesta este un nume generic – luciferazele diferă de la o specie la alta).

descoperit în meduza
Aequorea victoria
Pentru imagine, multumim
Typoform / the Royal Swedish
Academy of Sciences (RSAS)
Luciferină
Luciferină + O2 → Oxiluciferină + Lumină
O serie de experimente au cercetat ecvorinul, o proteină conţinută de anumite meduze şi care produce lumină albastră în prezenţa calciului (vedeţi Shaw, 2002, şi Furtado, 2009) astfel încât poate fi utilizată pentru a măsura nivelul calciului din celule. Alţi cercetători au adus şi alte idei privind folosirea bioluminescenţei în viitor (precum împodobirea cu lumini a bradului de Crăciun). Puteţi imagina utilizări potenţiale pentru acest uimitor feonomen natural?
e in the future, for example self-illuminated Christmas trees. Can you think of any other exciting potential uses for this amazing natural phenomenon?
Glosar
Anion: Un atom (sau un grup de atomi) care poartă o sarcină electrică negativă.
mări
Pentru imagine, multumim
Chemistry Review
ATP: Trifosfatul de adenozină se găseşte în toate formele vii cunoscute. Este un fel de monedă energetică în celule. ATP-ul se formează dintr-o moleculă de ADP (difosfat de adenozină) şi una de fosfat prin reacţii moi (precum oxidarea glucozei), şi se descompune înapoi (în ADP şi fosfat) pentru a elibera această energie cu scopul de genera reacţii nefavorabile.
Bioluminescenţă: Producerea de lumină de către oragnisme vii. Bioluminescenţa poate rezulta prin amplificarea luminii absorbite (fluorescenţă sau fosforescenţă, precum în cazul multor peşti de mare adâncime) sau printr-o reacţie chimică (chemoluminescenţă, precum în cazul licuricilor).
Catalizator: O substanţă care face ca o reacţie să aibă loc mai rapid, dar care nu determină o modificare chimică permanentă pe durata reacţiei (adică nu este folosită în reacţia propriu-zisă). Catalizatorii ajută prin aceea că asigură o rută alternativă pentru reacţia care este săracă în energie.
Chemoluminescenţa: Un tip de luminescenţă în care electronii sunt excitaţi printr-o reacţie chimică, precum reacţia luminolului descrisă în Caseta 1.
Conjugat: Sistemele conjugate apar în principal în chimie când există alăturate legături duble. Atomii dintr-un sistem conjugat sunt ţinuţi împreună prin legături covalente and have alternating single and multiple bonds (mainly double bonds, but triple bonds are also capable of being in conjugation). Alkenes are flat; conjugated systems must always be planar to allow delocalizarea electronilor din întregul sistem. Moleculele de colorant din Caseta 3 sunt exemple de compuşi conjugaţi.
Legături covalente: Legături chimice între doi atomi prin punerea în comun a unei perechi de electroni.

benzen sunt delocalizaţi
într-un sistem conjugat
Pentru imagine, multumim
Chemistry Review
Delocalizat: Când moleculele au legături conjugate, electronii sunt liberi să se mişte prin întregul sistem conjugat. Aceştia sunt referiţi ca electroni delocalizaţi. Electronii dintr-un inel benzenic sunt delocalizaţi, şi de aceea toate legăturile carbon-carbon au aceeaşi lungime.
Fluorescenţă: Un tip de luminescenţă în care electronii sunt excitaţi de lumină, de exemplu în marcajele de securitate ale bancnotelor.
Luminescenţă: Producerea luminii, de obicei la temperaturi joase, prin reacţii chimice sau prin energie electrică. (Incandescenţa, prin contrast, este lumină generată la temperaturi mari.)
Fosforescenţa: Ca şi fluorescenţa, dar strălucirea durează mai mult (conform anumitor definiţii, peste 10 nanosecunde); de exemplu, etichetele reflectorizante.
Mulțumiri
Versiunea originală a acestui articol a fost publicată în Chemistry Review şi este reprodusă aici cu permisiunea editorului, Philip Allan. Pentru a vă abona la Chemistry Review, o revistă destinată elevilor cu vârste de 16-19 ani, vizitaţi: www.philipallan.co.uk/chemistryreview
References
- Furtado S (2009) Painting life green: GFP (Pictură vie: proteina fluorescentă verde). Science in School 12: 19-23.
- Shaw A (2002) Genetic chess by the light of a jellyfish (Şah genetic cu lumina meduzei). Chemistry Review 12(1): 2-5
- Wallace-Müller K (2011) The DNA detective game (Jocul detectivului DNA). Science in School 19: 30-35.
Resources
- Pentru a afla despre câteva experimente cu luminolul, vedeţi web-site-ul lui Declan Fleming destinat chemoluminescenţei şi luminolului: www.chm.bris.ac.uk/webprojects2002/fleming/experimental.htm
- Pentru a studia despre alte tipuri de lumină în chimie, consultaţi:
-
Douglas P, Garley M (2010) Chemistry and light. Science in School 14: 63-68.
-
Review
Articolul oferă o modalitate de a motiva elevii să înţeleagă reacţiile chimice. Chiar dacă ei nu sunt curioşi să ştie cum străluceşte un băţ luminos, vor fi cu siguranţă nerăbdători să afle cum produc lumină licuriciul sau meduza, sau să descopere cum sunt detectate urmele de sânge de la locul crimelor. Articolul poate servi şi ca o introducere în reacţiile chimice, sau pentru a da exemple atractive de reacţii redox, sau pentru a ilustra nivelele energetice ale straturilor de electroni ai atomilor.
Articolul paote fi adaptat diferitelor vârste şi pentru diferite subiecte de studiu. Pentru elevii de 14-15 ani, materialul ar putea fi utilizat ca auxiliar la predarea chimiei (structura atomilor, salturile electronilor între straturi, introducere în reacţiile chimice) sau la predarea biologiei (bioluminescenţa). Pentru acest grup de vârstă, profesorul ar trebui să simplifice informaţiile din articol şi să omită detaliile reacţiilor. Pentru elevi cu vârste de 16-18 ani, articolul poate fi folosit pentru predarea chimiei (reacţii redox, catalizatori, influenţa temperaturii asupra vitezei reacţiilor, efectul pH-ului asupra reacţiilor, legăturile covalente), fizicii (spectrul electromagnetic, fotonul, structura atomului) sau geneticii (inginerie genetică). Întrebări/teme potrivite:
- Ce este chemoluminescenţa?
- Pentru ce folosesc medicii legişti chemoluminescenţa?
- Explicaţi câteva funcţii biologice ale bioluminescenţei.
- De ce ar trebui să păstrăm beţele luminoase în frigider atunci când nu le folosim?
- Cum am putea face o instalaţie de iluminat bradul de Crăciun folosind chemoluminescenţa?
Ana Gil, Spania