Mercúrio: uma solução venenosa Understand article
Traduzido por: Ana Luísa Carvalho Sigrid Griet Eeckhout do European Synchrotron Radiation Facility (Instituto Europeu de Radiação Sincrotrão) em Grenoble, França, investiga as causas da toxicidade de compostos de mercúrio – e como a radiação de raios-X ajuda a resolver o mistério.

Imagem cortesia de Mark Evans/
iStockphoto
Os metais constituem cerca de 75% dos elementos conhecidos. Podem formar ligas entre eles ou com não-metais e são usados, por exemplo, em carros, computadores, auto-estradas e pontes. A civilização foi fundada sobre os metais da antiguidade, nomeadamente ouro, prata, cobre, mercúrio, estanho, ferro e chumbo. O ouro foi descoberto cerca do ano 6000 AC e o mercúrio foi descoberto em túmulos datados de 1600 AC. Os antigos gregos usavam mercúrio em pomadas; os romanos usavam-no em cosméticos. Os metais entraram no nosso ambiente desde o início da Era Industrial, acumulando-se nos solos, em sedimentos e nas águas superficiais.
Em pequenas quantidades, muitos elementos metálicos vestigiais são relevantes do ponto de vista ecológico devido à sua importância como nutrientes ou à sua toxicidade como poluentes. Os elementos vestigiais considerados nutrientes incluem magnésio, manganês, cobre e zinco, alguns dos quais tóxicos em elevadas concentrações. Outros, incluindo elementos pesados como o mercúrio, cádmio, arsénico e chumbo, constituem uma preocupação ambiental devido à sua elevada toxicidade e ao seu uso alargado pela indústria. O mercúrio encontra-se presente no ambiente em concentrações inferiores a 0,1%, mas é extremamente tóxico porque se liga aos grupos funcionais de várias enzimas e proteínas, inibindo ou afectando negativamente funções orgânicas vitais. O mercúrio é utilizado na extracção de ouro e é encontrado em termômetros, amálgamas dentárias, termostatos, relés, interruptores, barómetros, sistemas de vácuo e outros equipamentos científicos, embora as preocupações relativamente à sua toxicidade tenham levado à redução do uso de termómetros de mercúrio nas actividades clínicas.
O mercúrio é um elemento vestigial de fontes naturais (metal nativo, Hg, e cinábrio, HgS) e antropogénicas (de origem humana). As fontes antropogénicas incluem a agricultura (fungicidas) e a metalurgia (mineração e fundição de minérios), a indústria de plásticos, eliminação de resíduos e aterros. A maior parte do mercúrio em solos, sedimentos e águas superficiais provém da queima de combustíveis fósseis. Este metal volátil pode percorrer longas distâncias na sua forma gasosa ou ligada a partículas de poeira. O mercúrio gasoso pode permanecer na atmosfera durante cerca de um ano, até se depositar na superfície terrestre por acção da chuva.

Imagem cortesia de Klaas Lingbeek
-van Kranen / iStockphoto
Uma vez depositados, os metais e metalóides (elementos com propriedades metálicas e não metálicas) passam por processos dinâmicos bio-geo-químicos num ambiente próximo da superfície, uma mistura de rocha, solo, água, ar e organismos vivos.
Os processos bio-geo-químicos afectam a forma atómica do metal (especiação) e, consequentemente, a sua solubilidade, mobilidade, bio-disponibilidade e toxicidade. Geralmente, quanto menos solúvel for uma espécie química, menos mobilidade terá, assim como terá uma menor toxicidade. Sendo assim, a transformação de espécies solúveis em formas de solubilidade reduzida, quer in situ quer em aterros após escavação, pode reduzir o impacto de metais pesados perigosos para os organismos vivos e para o ambiente.
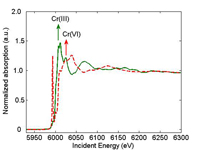
Os microrganismos podem alterar os metais através de reacções de oxidação-redução ou outras reacções químicas. Um exemplo é um outro metal pesado, o crómio hexavalente, Cr(VI), uma forma de crómio solúvel em água e muito perigosa. A ingestão de grandes quantidades de Cr(VI) pode provocar perturbações de estômago e úlceras, convulsões, danos nos rins e fígado, várias formas de cancro e mesmo a morte. O crómio trivalente, ou Cr(III), por sua vez, é um elemento essencial que favorece a utilização de açucar, proteínas e gorduras pelo corpo. O Cr(III) é insolúvel em água. A redução de Cr(VI) a Cr(III) usando microrganismos torna-o insolúvel em água, limitando a sua disponibilidade e toxicidadew1.
Este tipo de transformação pode também ocorrer no outro sentido. Nos solos, os organismos microscópicos conseguem transformar uma forma de mercúrio menos tóxica e inorgânica (não contendo carbono), numa forma orgânica e tóxica. Nesta reacção, designada metilação, um átomo, normalmente hidrogénio, é substituído por um grupo metilo (-CH3). Sendo um ião carregado positivamente, o metil-mercúrio (CH3Hg+) rapidamente se combina com aniões, tais como o cloro (Cl–), o hidróxido (OH-) ou o nitrato (NO3–).
A transformação de mercúrio num composto de metil-mercúrio produz uma forma metálica lipofílica (i.e. solúvel em gorduras), podendo atravessar as membranas das células, a barreira hemato-encefálica e a placenta. Nesta forma orgânica pode entrar na cadeia alimentar e acumular-se em peixes, em animais que comem peixe e nos humanos. Por outras palavras, a forma inorgânica, menos tóxica, de mercúrio, que seria normalmente excretada pelos organismos, é transformada numa forma orgânica, que se torna disponível e tóxica para os organismos.
Então, como é que esta forma inorgânica, menos tóxica, se transforma numa forma orgânica, tóxica? Usando radiação de sincrotrão no European Synchrotron Radiation Facility (ESRF), mais especificamente, a técnica de espectroscopia de absorção de radiação X (XAS de X-ray absorption spectroscopy, ver caixa), investigadores da Suécia e dos EUA determinaram a especiação do mercúrio, presente em matéria orgânica natural em concentrações ambientais relevantes.
Os investigadores descobriram que o mercúrio da matéria orgânica natural do solo liga-se a dois grupos de enxofre orgânico reduzido, principalmente tióis (-SH). O grupo tiol é o equivalente sulfurado do grupo hidroxilo (-OH), presente em alcoóis. As experiências laboratoriais indicam que espécies neutras de mercuro-tiol e mercuro-enxofre inorgânicas em solução determinam as velocidades de metilação. Isto significa que a ligação de mercúrio a tióis, na matéria orgânica natural, torna o elemento disponível para as bactérias metiladoras do ambiente.
O próximo passo é identificar a função que desempenham as diferentes moléculas que contêm enxofre encontradas em solos orgânicos.
O uso da técnica de XAS na caracterização da especiação de mercúrio é bastante recente. É inovadora quando comparada com os métodos bioquímicos mais antigos (de fase líquida) e é a primeira vez que se detectam tão baixas concentrações de mercúrio (0,1 grama de mercúrio por 1000 grama de solo).
É difícil decifrar a química de metais e metalóides vestigiais no ambiente, porque a matéria natural possui composição e estrutura complexas. Com o aparecimento de fontes avançadas de radiação sincrotrão, que disponibilizam técnicas de radiação X intensa e elevada resolução espacial, os investigadores conseguem detectar as formas e distribuição dos metais em sistemas heterogéneos como solos, plantas e interacções mineral-micróbio-metal. Para isso, podem aplicar-se em simultâneo três técnicas micro-analíticas. A técnica de micro-fluorescência de raios-X (ver caixa) consegue mapear as distribuições dos diferentes metais e permite a identificação de associações de metais (Figura 3). Em seguida, o espécime que contém o metal (argila ou minério) é determinado em pontos de interesse nos mapas químicos através de micro-difracção de raios-X e micro-XAS. O padrão de difracção revela a estrutura interna do material. A proporção de cada espécime no material é calculada por combinação linear dos diferentes componentes (por outras palavras, adicionando as quantidades nos espectros).
Concluindo, as técnicas de raios-X usando radiação sincrotrão são extremamente úteis na determinação das formas e distribuição dos metais em solos, sedimentos e águas superficiais. Uma vez determinada a especiação de um metal, podemos tentar limitar a sua solubilidade e bio-disponibilidade. À medida que crescem a população e economia mundiais, especialmente nos países em vias de desenvolvimento, a necessidade de metais aumenta, aumentando também a possibilidade de contaminação de solos e água. Uma vez que isto tem sérias implicações na saúde humana e na qualidade ambiental, os estudos ambientais são de extrema importância.
Técnicas de raios-X (para leitores avançados)
Para uma explicação simples sobre estas duas técnicas, ver Capellas (2007).
Espectroscopia de absorção de raios-X (XAS)
Os raios-X são radiação com energias que variam entre ~500 electrões-volt (eV) e 500 keV (1 keV é equivalente a 1000 eV).
de um elemento são usadas como
impressão digital na técnica de
fluorescência de raios-X. Quando
variamos a energia e observamos um
pico a uma determinada energia,
sabemos que o elemento respectivo
se encontra presente (Figura 2).
spectroscopia de absorção de radiação X, variamos a energia dos raios-X incidentes. Quando a energia da radiação incidente iguala a energia de ligação de um electrão próximo do núcleo (normalmente, um electrão 1s), o electrão é ejectado do átomo. O espectro de absorção de raios-X correspondente revela uma subida acentuada, também conhecida como limiar de absorção (Figura 1). A posição do limiar de absorção também é determinada pelo estado formal de oxidação. Por exemplo, o limiar de absorção do Cr(VI) ocorre a energias mais elevadas do que o do Cr(III).O electrão expulso interage com os átomos em redor, criando oscilações no espectro na proximidade do limiar. Estas oscilações fornecem informação sobre os átomos vizinhos.
Uma vez que todos os átomos possuem electrões próximos do núcleo com energias de ligação bem definidas, a técnica de XAS é específica para cada elemento. Isto significa que podemos estudar um elemento à nossa escolha (ex., mercúrio) dentro de amostras heterogéneas, tais como solos contendo matéria orgânica, micróbios, minerais, metais, etc.
O espectro de XAS é sensível ao estado formal de oxidação (que reflecte o número de electrões disponíveis para ligação a outros átomos), à química de coordenação (ex., coordenação octaédrica ou tetraédrica), e às distâncias, número de coordenação e natureza dos átomos na vizinhança imediata do elemento seleccionado.
Fluorescência de raios-X
The well-defined characteristic binding energies of an element are used as a fingerprint in the X-ray fluorescence technique. When you change the energy and you observe a peak at a particular energy, you know that the respective element is present (Figure 2).
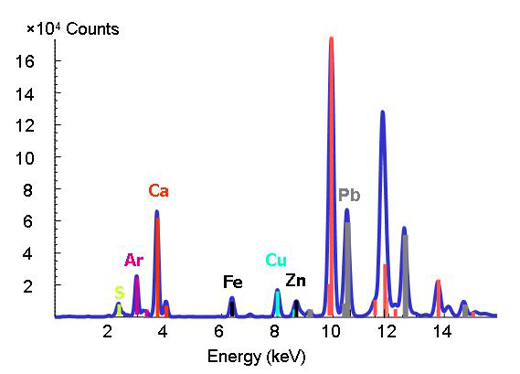
Imagem cortesia de ESRF
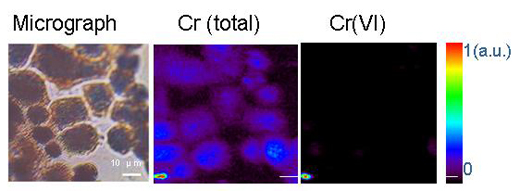
Reproduzido com permissão do Chemical Research in Toxicology (Investigação Química em Toxicologia). Copyright (2005) American Chemical Society (Sociedade Americana de Química)
References
- Capellas M (2007) Recovering Pompeii. Science in School 6: 14-19. www.scienceinschool.org/2007/issue6/pompeii
- Skyllberg U, Bloom PR, Qian J, Lin CM, Bleam WF (2006) Complexation of mercury(II) in soil organic matter: EXAFS evidence for linear two-coordination with reduced sulfur groups. Environmental Science & Technology 40: 4174-4180
- Este artigo foi escolhido entre mais de 1100 artigos em Environmental Science and Technology (Ciência e Tecnologia Ambiental) como a mais importante contribuição de 2006 para a ciência ambiental.
Web References
-
w1 –Para uma discussão sobre o elemento crómio com referência ao filme Erin Brockovich, ver:Stevens J (2007) Erin Brockovich. Science in School 4: 67-69. www.scienceinschool.org/2007/issue4/erinbrockovich/
Resources
- Uma breve explicação sobre as aplicações da radiação de sincrotrão no ESRF encontra-se em: www.scienceinschool.org/2006/issue1/maryrose#esrf
- Para informações sobre o ESRF, ver: www.esrf.eu





