Plastiki w samochodach: polimeryzacja i recycling Teach article
Tłumaczenie Katarzyna Badura. Jakie rodzaje plastików są wykorzystywane do zbudowania samochodu? W jaki sposób są one syntezowane i odzyskiwane? Marlene Rau i Peter Nentwig prezentują oba procesy opisane w projekcie „Chemia w Kontekście”.

Niko Guido / iStockphoto
Spora część nastolatków zainteresowana jest samochodami, które zawierają wiele najróżniejszych plastików: polimerów produkowanych z ropy naftowej bądź materiałów odnawialnych. Zainteresowanie samochodami można wykorzystać do wprowadzenia tematu plastików i polimerów np. w czasie lekcji chemii organicznej.
Pozwól swoim studentom przyjrzeć się kilku samochodom. Co oni już wiedzą na temat plastików wykorzystanych przy budowie tych aut? Czego chcieliby się jeszcze dowiedzieć? Mogliby kategoryzować swoje pomysły zależnie od różnych części samochodów (zobacz poniżej, Tabela 1).
Tabela 1: Wykorzystanie plastików w samochodach
- Czy plastiki powodują, że samochody są ekologicznie bardziej przyjazne? (mniejsze zużycie paliwa, odzysk elementów plastikowych)
- Przezroczyste reflektory i światła tylne
- Letnie i zimowe opony
- Silne pasy bezpieczeństwa
- Tworzywa sztuczne odporne na ciepło znajdujące się blisko silnika
- Pianki w fotelach samochodowych
Istotne jest to, że poszczególne elementy budulcowe samochodu muszą spełniać określone wymagania (np. pasy bezpieczeństwa muszą być mocne ale sprężyste), a to oznacza, że materiały, z których są produkowane muszą posiadać konkretne cechy charakterystyczne (np. materiał nie ulega łatwo rozdarciu), a więc muszą być ściśle określone (np. Poli(tereftalan etylenu)). Jeśli studenci nie dojdą do tego wniosku sami, zapytaj ich dlaczego jeden typ plastiku nie wystarczyłby do zbudowania samochodu.
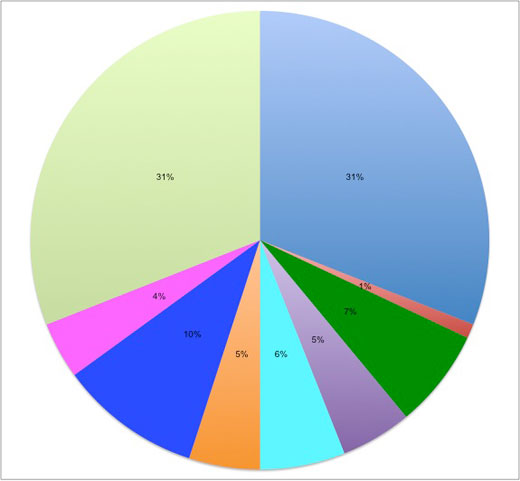
Poli(akrylonitryl-co-butadien-co-styren): 31%
Poli(tereftalan etylenu): 1%
Poliwęglan / poli(akrylonitryl-co-butadien-co-styren): 7%
Szkło akrylowe: 7%
Polipropylen: 6%
Poli(tereftalan butylenu): 5%
Polioctan: 10%
Poliwęglan: 4%
Poliamid: 31%
Zdjęcie dzięki uprzejmości Leibniz Institute for Science and Mathematics Education
Ćwiczenia przedstawione w tym artykule dotyczą dwóch zagadnień z listy przedstawionej w Tabeli 1: plastik wykorzystywany w budowie świateł tylnych oraz sposób, w jaki materiał ten jest odzyskiwany z samochodów. Każde z ćwiczeń zawiera arkusz pracy oraz zbiór potrzebnych informacji przedmiotowych. Zadania te przeznaczone są na dłuższą część lekcji (zobacz w ramce), odpowiednie dla grupy uczniów w wieku 16, którzy pracowaliby w mniejszych, dwu- lub trzyosobowych grupkach. Poświęć jedną lub dwie 45-minutowe lekcje na każde z zadań.
Projekt ‘Chemia w kontekście’
‘Chemie im Kontext’ (‘Chemia w kontekście’) jest projektem koordynowanym przez Leibniz Institute for Science and Mathematics Education na Uniwersytecie w Kilonii, w Niemczech. Pomiędzy rokiem 2002 a 2008, nauczyciele chemii, inni wykładowcy nauk ścisłych oraz przedstawiciele władz szkolnych opracowali – dla każdego stopnia i typu szkoły – zestawy do nauki chemii, łączące w sobie wymagania programowe z życiem codziennym. Przykłady środków i zaleceń dotyczących kolejnych zasobów materiałów dostępne są w interneciew1. Zestaw materiałów przygotowanych przez nauczycieli można zamówić bez ponoszenia dodatkowych kosztów, a plany czterech lekcji dostępne są bezpłatnie na stronie internetowej (wszystkie w języku niemieckim). Podręcznik oraz poradnik nauczycielski (w języku niemieckim) zostały wydane przez wydawnictwo Cornelsen.
Ten artykuł jest częścią jednego z planów lekcji. Pełny plan lekcji zawiera sześć różnych zadań, z których jedno zawarte jest w Tabeli 1.
Polimeryzacja: plastik do świateł samochodowych

szkła akrylowego
Zdjęcie dzięki uprzejmości
BASF 1998
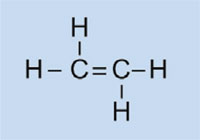
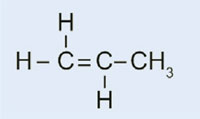
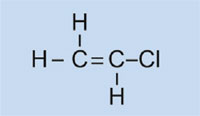
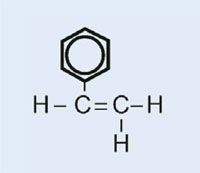
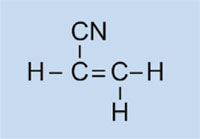
Światła samochodowe posiadają plastikowe nakładki, które pozwalają na utrzymanie ich w stanie suchym i czystym, jak również – w niektórych przypadkach – na nadanie im koloru (np. czerwone światła tylne i pomarańczowe migacze). Wykorzystywany w tym celu materiał musi być przezroczysty, jasny, kolorowy, łatwy do uformowania oraz stosunkowo twardy. W tym ćwiczeniu zajmiemy się zsyntezowaniem plastiku, który używany jest do produkcji lamp samochodowych. Będzie to poli(metakrylan metylu) zwany też PMMA.
Poli(metakrylan metylu) jest powszechnie znany jako szkło akrylowe lub plexiglas i należy do grupy plastików zwanych polimeryzatami. Do ich podstawowych cech należy fakt, że w monomerycznej jednostce podstawowej znajdują się jedno lub dwa wiązania podwójne. Pod wpływem działania wolnych rodników (cząsteczki posiadające wolne, niesparowane elektrony), jednostki te na drodze wolnorodnikowej reakcji polimeryzacji przekształcają się w długołańcuchowe makromolekuły.
Właściwości makromolekuł zależą od tego po jakiej stronie mieszczą się łańcuchy, co z kolei jest zależne od tego jakie monomery zostały użyte. Wykorzystując różne monomery do reakcji formowania polimeryzatowych plastików jesteśmy w stanie wytworzyć tworzywa sztuczne przydatne do produkcji różnych elementów plastikowych. Np. grube łańcuchy boczne w PMMA zapobiegają w trakcie tężenia substancji przed powstawaniem struktur krystalicznych, które powodowałyby rozproszenie światła. Zamiast tego, takie amorficzne plastiki są przezroczyste, co powoduje, że są idealnymi substytutami szkła: jaśniejsze, bardziej miękkie i mniej podatne na zgniecenia.
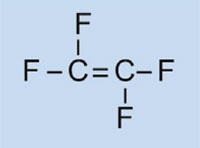
Możemy przedstawić reakcję wolnorodnikowej polimeryzacji wykorzystując jako przykład samochodowy zbiornik paliwa, który wykonany jest z polietylenu. Polietylen powstaje z monomerów etenu (etylenu, C2H4), w reakcji inicjowanej przez nadtlenek benzoilu. W momencie podgrzania do temperatury 90 °C nadtlenek benzoilu rozrywa się na dwa wolne rodniki. W momencie, gdy taki wolny rodnik zwiąże się z cząsteczką etenu, dochodzi do rozerwania obecnego w niej podwójnego wiązania, a tym samym dochodzi do powstania nowego, większego wolnego rodnika. W ten sposób rozpoczyna się reakcja łańcuchowa, która zatrzymuje się dopiero w momencie, gdy przereagują ze sobą dwa wolne rodniki.
|
Monomer |
Polimer |
|---|---|
|
Eten
|
Polieten
|
|
Propen
|
Polipropen
|
|
Chlorek winylu
|
Polichlorek winylu
|
|
Styren
|
Polistyren
|
|
Akrylonitryl
|
Poliakrylonitryl
|
|
Ester metylowy kwasu metakrylowego
|
Poli(metakrylan metylu)
|
|
Tetrafluoroetlen
|
Politetrafluoroetylen
|


Ryc. 2: Etapy procesu polimeryzacji
Zdjęcie dzięki uprzejmości Leibniz Institute for Science and Mathematics Education
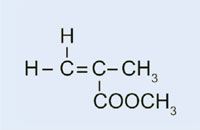
W naszym eksperymencie wykorzystaliśmy nadtlenek benzoilu by zainicjować podobny proces: zamiast wykorzystać eten do syntezy polietylenu, wykorzystamy 2-metylopropenian metylu w celu wyprodukowania poli(metakrylanu metylu)
Arkusz pracy studenta 1: synteza przezroczystego polimeru
Materiały

Zdjęcie dzięki uprzejmości
Leibniz Institute for Science
and Mathematics Education
- 2-metylopropenian metylu (znany również jako metakrylan metylu;C5H8O2)
- Nadtlenek benzoilu (C14H10O4)
- Czerwony barwnik typu Sudan
- woda
- Aceton (propanon, C3H6O)
Oprzyrządowanie dla każdej grupy
- Waga
- Palnik
- Probówka
- Zlewka
- Szkiełko zegarkowe
- Szpatułka
- Pipeta
- Aluminiowy pojemniczek po podgrzewaczu
Zasada bezpieczeństwa
Używaj rękawiczek oraz okularów ochronnych i pracuj pod wyciągiem. 2-metylopropenian metylu, nadtlenek benzoilu oraz aceton są łatwopalne; co więcej, aceton jest substancją drażniącą. Dlatego też wszystkie te substancje muszą być stosowane z dużą ostrożnością. Nadmiaru czerwonego barwnika typu Sudan nie wolno wylewać do kanalizacji.
Zapoznaj się również z generalnymi zasadami bezpieczeństwa.
Procedure
eksperymentalny
Zdjęcie dzięki uprzejmości
Leibniz Institute for Science
and Mathematics Education
- Odważ 0,2g nadtlenku benzoilu do probówki.
- Dodaj 10 ml 2-metylopropenianu metylu
- Żeby zabarwić plastik, który chcesz otrzymać, dodać odrobinę czerwonego barwnika typu Sudan (tyle, by zakryć czubek szpatułki)
- Włóż probówkę do zlewki pełnej wody o temperaturze 90 °C i całość umieść na palniku, patrz Rysunek 3, poniżej.
Reakcja będzie przebiegać około 20 minut, po których zauważysz, że roztwór zrobi się bardziej lepki. W międzyczasie zapoznaj się z informacjami znajdującymi się pod nagłówkiem ‘Polimeryzacja: plastik na światła samochodowe‘ i rozpisz mechanizm reakcji wolnorodnikowej polimeryzacji 2-metylopropenianu metylu.
- Przelej roztwór to aluminiowego pojemniczka po podgrzewaczu.
Jeśli plastik zacznie tężeć w probówce, możesz go ponownie rozpuścić dodając acetonu. Następnie możesz kontynuować eksperyment tak, jak zostało to opisane, przeznaczając więcej czasu na wyparowanie acetonu.
- Zakryj pojemniczek po podgrzewaczu szkiełkiem zegarowym tym samym utrzymując wysoką temperaturę plastiku, co przyspiesza jego tężenie.
- Pozostaw poli(metakrylan metylu) na 24h by stężał zupełnie, po czym wyciągnij go z aluminiowego pojemniczka.
How would you test the properties of your plastic and compare them to those of glass?
Odzyskiwanie plastiku z samochodów

różnych paliw; od lewej do
prawej: olej opałowy; odpady
z tworzyw sztucznych takie
jak olefiny; węgiel brunatny.
Naciśnij, żeby powiększyć
Zdjęcie dzięki uprzejmości
Leibniz Institute for Science
and Mathematics Education
W tym ćwiczeniu, uczniowie najpierw dowiedzą się w jaki sposób można odzyskać plastik z samochodów, a potem sami spróbują swoich sił w procesie odzyskiwania, przekształcając plastikową butelkę w kawałek tworzywa sztucznego.
Co się dzieje w momencie, gdy przestaliśmy korzystać z samochodu? Mogą przyjść nam na myśl stosy rdzewiejących samochodów i stare opony przeznaczone do składowania, ale tak naprawdę wiele części samochodowych jest zawracana do obiegu w celu odzyskania cennych materiałów, w szczególności metali.
Plastik samochodowy również może zostać przywrócony do obiegu w jeden z trzech sposobów: jako część, składnik chemiczny lub paliwo.
- Samochody można naprawiać wykorzystując stare części, takie jak błotniki. Wraz z upływem czasu właściwości plastiku ulegają zmianie, tym samym zmniejszając ich przydatność do ponownego użytku: np. promieniowanie słoneczne powoduje, że plastik robi się bardziej kruchy. Na szczęście, niektóre plastikowe elementy można stopić i uformować w artykuły, dla których wytyczne jakościowe są niższe, np. słupki lub ławki ogrodowe.
- Poprzez niektóre reakcje chemiczne część polimerów może zostać rozłożona na cząsteczki monomeryczne, które następnie mogą zostać wykorzystane w nowych procesach syntezy. Plastiki można wykorzystać do produkcji również innych związków wykorzystywanych w przemyśle chemicznym, np. jedna tona konkretnych plastików pozwala na uzyskanie 600 kg metanolu, który nie tylko stanowi ważny produkt dla przemysłu plastikowego, ale jest również wykorzystywany w formie paliwa jako źródło energii.
- Rozdrobniony plastik może zostać bezpośrednio wykorzystany jako paliwo, zastępując olej i węgiel, np. w elektrowni wykorzystującej materiały wtórne. Można go również wykorzystać zamiast węgla w piecowym procesie żeliwa (popatrz Ryc. 4).
Arkusz pracy studenta 2: odzysk plastiku w klasie

Zdjęcie dzięki uprzejmości
hippokrat / iStockphoto
Materials per group
- palnik Bunsena
- Statyw z siatki drucianej
- Foremki do ciastek w różnych kształtach
- Folia aluminiowa
- Nóż
- Plastikowe odpady (najlepiej butelki PET po wodzie mineralnej)
- Zestaw barwników
Zasada bezpieczeństwa
pracuj w okularach ochronnych i pod wyciągiem. Nie pozwól na bezpośredni kontakt płomieni z plastikiem. Uważaj, żeby się nie pociąć.
Zapoznaj się również z generalnymi zasadami bezpieczeństwa.
Procedura
- Użyj noża by rozdrobnić plastik na możliwe małe fragmenty.
- Wyściel dno i ścianki foremki na ciasto folią, a następnie wypełnij je rozdrobnionym plastikiem do wysokości 0,5 cm. Jeśli masz ochotę, spróbuj dodać również niewielką ilość barwnikgmx.a.
- Umieść foremki na statywie ponad palnikiem Bunsena i ogrzewaj je powoli do momentu aż plastik stopnieje.
- Gdy tylko ostygnie, wyjmij plastik z foremki i ściągnij folię.
Porównaj właściwości plastiku sprzed i po procesie odzysku. Jakie wnioski możesz wyciągnąć na temat procesu odzysku plastiku?
Wewnątrz grupy omów trzy metody odzysku opisane pod nagłówkiem ‘Odzysk plastików z samochodów‘ i porównaj możliwe zastosowania. Zastanów się nad rezultatami przeprowadzonego przez ciebie eksperymentu: jakie zastosowanie można znaleźć dla odzyskanego przez Ciebie plastiku?
Badanie plastiku promieniami Roentgena

W Europejskim Ośrodku Synchrotronu Atomowego e Grenoble (ERSF)w2 przez ponad 10 lat badano włókna wysokowydajnego plastiku typu Kevlar®. Pięć razy mocniejsze od stali, masowo identyczny Kevlar wykorzystywany jest w oponach rowerowych, ubraniach ochronnych, żaglach I linach cumowniczych.
Spora część prac prowadzonych przez ESRF na wysokowydajnych włóknach dotyczy ich morfologii skóra-rdzeń: różnic w strukturze pomiędzy warstwami zewnętrznymi, a centrum włókna. Te różnice mogą mieć duży wpływ na właściwości mechaniczne włókien, dlatego też zrozumienie morfologii skóra-rdzeń może pozwolić na dopasowanie właściwości włókien w czasie procesu ich obróbki.
W obrębie jednostki ESRF promienie Roentgena są rutynowo wykorzystywane w coraz to nowszych badaniach prowadzonych nad tymi nadzwyczajnymi materiałami, zarówno w celach akademickich jak I przemysłowych. Wynika to z faktu, iż żadne inne badania nie dostarczą tak dużej ilości informacji bez potrzeby przecinania włókien a tym samym wprowadzania potencjalnych zmian w ich wewnętrznej mikrostrukturze. Żeby uzyskać więcej informacji sprawdź Capellas Espuny, 2009.
ESRF jest członkiem EIROforumw3, wydawcy Science in School.
References
- Capellas Espuny M (2009) A new look into fibre-reinforced composite materials. ESRF News 50: 12-13. www.esrf.eu/UsersAndScience/Publications/Newsletter
Web References
- w1 – żeby dowiedzieć się więcej na temat tego projektu (po angielsku i po niemiecku) oraz ściągnąć informacje źródłowe (po niemiecku), wejdź na stronę internetową Chemii w Kontekście (Chemie im Kontext): www.chik.de
- w2 – miedzynarodowe centrum badanwcze w Grenoble we Francji, ESRF operuje wysokiej jakości promieniowaniem Roentgena, które każdego roku służy tysiącom naukowców na całym świecie. Żeby uzyskać więcej informacji wejdź na: www.esrf.eu
- w3 – Żeby downside się więcej na temat EIROforum, wejdź na: www.eiroforum.org
Resources
- Żeby dowiedzieć się więcej na temat projektu ‘Chemia w Kontekście’ zajrzyj do:
-
Parchmann I et al. (2006) Chemie im Kontext: a symbiotic implementation of a context-based teaching and learning approach. International Journal of Science Education 28(9): 1041-1062
-
Nentwig P et al. (2007) Chemie im Kontext: situated learning in relevant contexts while systematically developing basic chemical concepts. Journal of Chemical Education 84: 1439
-
- Dla odtworzenia widowiskowej wolnorodnikowej reakcji polimeryzacji etenu to polietylenu w klasie, zajrzyj do:
-
Sturm B (2009) The drama of science. Science in School 13: 29-33.
-
- Żeby dowiedzieć się więcej na temat badań prowadzonych nad nad biodegradowalnymi plastikami, zajrzyj do:
-
Bradley D (2007) Plastics, naturally. Science in School 5: 66-69.
-
Review
Chemia jest zazwyczaj uważana przez uczniów za przedmiot trudny i niebezpieczny, mimo to jesteśmy przez nią otoczeni, a co więcej odgrywa ona ważną rolę w poprawie jakości życia. Ćwiczenia przedstawione w tym artykule, wykorzystujące materiały z życia codziennego, mogą pomóc zwiększyć nie tylko powszechną akceptację chemii, ale również stopień zainteresowania pośród uczniów.
Ćwiczenia te mogą również zostać przeprowadzone na zajęciach z chemii organicznej lub biologii, żeby podkreślić istotę procesu odzyskiwania materiałów wtórnych. Pomimo tego, iż autorzy sugerują, iż uczniowie powinni mieć przynajmniej 16 lat, ćwiczenia te mogą zostać z powodzeniem przeprowadzone w obecności młodszych uczniów (wiek 14+).
Mireia Guell Serra, Hiszpania