Spektrometria w szkole: uczenie przez eksperyment Teach article
Tłumaczenie Marek Kwiatkowski. Nataša Gros, Tim Harrison, Irena Štrumbelj Drusany i Alma Kapun Dolinar przedstawiają wybrane doświadczenia wykorzystujące prosty spektrometr opracowany specjalnie dla szkół – i podają szczegółowe opisy jak przeprowadzić poszczególne doświadczenia.

Maren Beßler / Pixelio
W celu lepszego zmotywowania uczniów do uczenia się chemii przez eksperyment, wspólnie z partnerami naszego projektu opracowaliśmy zestaw doświadczeń wykorzystujących niewielki i niedrogi spektrometr skonstruowany przez jednego z partnerów (Nataša Gros). Spektrometr może być również wykorzystany jako element innych instrumentów analitycznych, np. chromatografu gazowego i cieczowego, co pozwala na dalsze rozszerzenie zakresu doświadczeń szkolnych (p. strona www projektuw1). Zainteresowane szkoły mogą wypożyczyć pewną ilość spektrometrów na życzenie.
Jak działają spektrometry
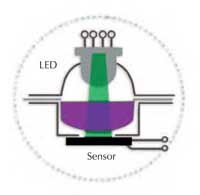
W klasycznym spektrometrze, białe światło ze źródła światła (żarówka) pada na monochromator, którego zadaniem jest wyodrębnienie światła o żądanej długości fali. Wyselekcjonowana wiązka światła przechodzi następnie przez kiuwetę pomiarową (p. Rysunek 1). Wskutek absorpcji światła przez próbkę następuje zmniejszenie intensywności natężenia światła, które jest mierzone przez detektor (absorbancja). Im bardziej intensywna barwa roztworu, tym wyższa wartość zmierzonej absorbancji.

Zdjęcie dzięki uprzejmości Nicola Graf
pomiarowa spektrometru
Spektra
Zdjęcie dzięki uprzejmości
Nataša Gros
Najczęściej stosowane kiuwety charakteryzują się długością drogi optycznej 1 cm i wymagają co najmniej 3 ml roztworu do przeprowadzenia pomiaru. Najważniejszym wymogiem stawianym przed klasycznym spektrometrem jest zapewnienie wysokiej dokładności i precyzji pomiarów absorbancji: wybór długości fali powinien być możliwie jak najbardziej dokładny, a wiązka światła możliwie jak najbardziej monochromatyczna (tzn. o wąskim zakresie długości fali). W rezultacie, budowa klasycznego spektrometru jest bardzo złożona i niezbyt oczywista dla przeciętnego użytkownika. Poza tym, takie urządzenie jest stosunkowo kosztowne.
Główny cel powstania spektrometru SpektraTM był inny: chodziło o skonstruowanie niedrogiego, przenośnego i odpornego na uszkodzenia urządzenia o prostej, intuicyjnej budowie, które umożliwiałoby minimalne zużycie odczynników chemicznych oraz stosowanie uproszczonych procedur eksperymentalnych (Gros, 2004). Spektrometr ten jest przeznaczony przede wszystkim do zastosowań edukacyjnych, zwłaszcza do wprowadzania nowych koncepcji, chociaż można go również z powodzeniem wykorzystać do jakościowych i półilościowych analiz próbek w terenie.
W skład spektrometru Spektra wchodzą dwa elementy optyczne: dioda elektroluminescencyjna emitująca światło o trzech różnych barwach oraz czujnik światła. Światło o wybranej barwie: niebieskiej (430 nm), zielonej (565 nm) lub czerwonej (625 nm) przechodzi bezpośrednio przez warstwę roztworu i pada na czujnik światła (Rysunek 2). Najważniejsze elementy przyrządu (źródło światła, komora pomiarowa i czujnik) są dobrze widoczne. Ponieważ łatwo zrozumieć jego budowę i działanie, uczniowie nie postrzegają przyrządu jako “czarnej skrzynki” (p. Rysunek 3a and b).

spektrometru Spektra. A:
źródło światła (dioda
elektroluminescencyjna);
B:komora pomiarowa; C:
miejsce pomiaru z czujnikiem
światła na spodzie. Click to
enlarge image
Zdjęcie dzięki uprzejmości
Nataša Gros

budowa spektrometru
Spektra. Przyrząd jest
bardziej zwarty, natomiast
wszystkie trzy najważniejsze
elementy są nadal dobrze
widoczne (A: źródło światła;
B:komora pomiarowa; C:
czujnik światła
Zdjęcie dzięki uprzejmości
Nataša Gros
Aby wykonać pomiary, roztwory umieszcza się z zagłębieniach tzw. blistra (płytki z polimeru z wytłoczonymi wgłębieniami o kształcie soczewki). W rezultacie do pomiarów można stosować bardzo małe objętości roztworów (0,35 ml), co pozwala na minimalizację objętości niebezpiecznych odpadów, poza tym homogenizacja próbek jest bardzo szybka. Obsługa spektrometru Spektra jest prosta i bezpieczna, nie wymaga specjalnego przygotowania laboratoryjnego oraz aparatury szklanej. Objętości roztworów są bardzo małe, do odmierzania cieczy z powodzeniem można stosować metodę kroplową.
Spektrometry można zakupić przez Internetw2. Ewentualnie, Uniwersytet w Bristoluw3(Wielka Brytania) oferuje niewielką liczbę spektrometrów do wypożyczenia nauczycielom, którzy chcieliby wypróbować doświadczenia ze swoimi uczniami lub opracować nowe praktyczne zastosowania. Dla tych, którzy preferują klasyczne spektrometry, proponujemy kolorymetry Mystrica (wykorzystujące kiuwety o normalnej objętości) o dobrej cenie i jakościw4.
Spektrometria – uczenie przez eksperyment
W ramach projektu opracowaliśmy cały szereg praktycznych ćwiczeń z zakresu spektrometrii, mając na celu pobudzić zainteresowania młodzieży naukami przyrodniczymi oraz zainspirować ewentualnych przyszłych naukowców wśród uczniów. Ćwiczenia dotyczą bardzo różnych zagadnień, np. analiza wody, fizyka światła i barwy, prawo Lamberta-Beera, równowagi chemiczne, analiza środowiska, kinetyka reakcji chemicznych i analiza żywności.
Ćwiczenia z zakresu analizy żywności dotyczą: spektrometrycznego oznaczania żelaza w próbkach suszonych ziół lub mąki; zawartości etanolu w napojach alkoholowych; zawartości glukozy w dżemach; indeksu barwy piwa; jakości sproszkowanej papryki; zawartości fosforanów w soku jabłkowym; zawartości fosforanów i azotynów w produktach mięsnych; stężenia kazeiny w serach. Inne ćwiczenia pozwala śledzić przebieg procesu fermentacji alkoholowej.
Poniżej podajemy dokładny opis procedury stosowanej do oznaczenia zawartości glukozy w dżemach. Szczegóły innych procedur analitycznych, z włączeniem ćwiczeń odpowiednich również dla szkół podstawowych, są przedstawione na stronie internetowej projektuw1. W tym samym miejscu umieszczono również instrukcje jak wykorzystać spektrometr Spektra do budowy prostego chromatografu gazowego lub cieczowego, wraz z opisami ćwiczeń opracowanych dla tych przyrządów (p. również Gros & Vrtačnik, 2005).
Spektrometryczne oznaczanie glukozy w dżemach
Istnieje wiele reakcji chemicznych, w których cukry tworzą z reagentami zabarwione produkty. Intensywność barwy zależy od wyjściowego stężenia cukru. Dlatego pomiar absorbancji próbek i odniesienie do absorbancji roztworów wzorcowych może służyć do wyznaczania stężenia cukru. Tą metodą oznacza się przede wszystkim cukry proste (zwłaszcza cukry redukujące), dla których opisano wiele reakcji barwnych, ma ona mniejsze zastosowanie do oznaczania polisacharydów (see box).
Wybór glukozy był podyktowany przede wszystkim tym, że cukry są uczniom znane – ćwiczenie odnosi się do ich bezpośrednich doświadczeń z życia codziennego. Poza tym, oznaczanie zawartości cukrów w dżemach może mieć praktyczne zastosowanie w przemyśle, np. przy kontroli jakości.
Jedną z metod oznaczania cukrów w dżemie może być hydroliza nie-redukujących cukrów (głównie sacharozy) do glukozy przy pomocy kwasu siarkowego(VI) H2SO4, zobojętnieniu próbki wodorotlenkiem sodu NaOH i reakcji powstałych redukujących cukrów prostych (np. glukoza, fruktoza) z kwasem 3,5-dinitrosalilcylowym (DNSA, zwanym również kwasem 2-hydroksy-3,5-dinitrobenzoesowym). W wyniku tej reakcji, powstają czerwono-brązowe produkty. Dalsze informacje, p. Miller (1959).
Stężenie barwnych produktów określa się mierząc absorbancję roztworu za pomocą spektrometru używając niebieskiego światła diody (430 nm). Początkowe stężenie cukru w próbkach dżemu można odczytać z krzywej kalibracyjnej sporządzonej przy pomocy roztworów o znanym stężeniu glukozy.
Aparatura i odczynniki
- Spektrometr Spektra (lub inny spektrometr)
- Kiuwety lub blistry
- Pipety
- Kolby miarowe100 ml
- Kolby stożkowe
- Probówki
- Waga
- Łaźnia wodna
- Lejek
- Sączek bibułowy
- Próbki dżemu
- Odczynnik DNSA (kwas 3,5-dinitrosalicylowy)
- Sulphuric acid (H2SO4) roztwór (ok. 2 mol/l)
- Wodorotlenek sodu (NaOH), roztwór (ok. 10%)
- Winian sodowo-potasowy (NaK(CH2OH)2(COO)2.4H2O)
- Glukoza proszek (C6H12O6)
Przygotowanie roztworów
Odczynnik DNSA: Odważ 10 g DNSA i rozpuść go w 200 ml roztworu wodorotlenku sodu NaOH o stężeniu 2 mol/l. Ogrzej roztwór intensywnie mieszając. Przygotuj roztwór 300 g winianu sodowo-potasowego w 500 ml wody destylowanej. Zmieszaj oba roztwory w kolbie miarowej o pojemności 1000 ml i dopełnij wodą destylowaną do kreski miarowej.
Dżem (cukry): Odważ 1 – 2 g dżemu w kolbie stożkowej. Dodaj 10 ml roztworu kwasu siarkowego (VI). Ogrzewaj zawartość kolby na wrzącej łaźni wodnej przez 20 minut, mieszając od czasu do czasu, aż do zakończenia hydrolizy. Ochłodź mieszaninę i ostrożnie dodaj12 ml roztworu wodorotlenku sodu. Wymieszaj i przesącz powstałą mieszaninę do kolby miarowej o pojemności 100 ml, dopełnij wodą destylowaną do kreski miarowej. Za pomocą pipety przenieś 10 ml powstałego roztworu do innej kolby miarowej 100 ml i dopełnij wodą destylowana do kreski miarowej. Wymieszaj dobrze zawartość.
Dżem (cukry redukujące): Odważ 3,0 g dżemu w kolbie stożkowej, dodaj 50 ml wody destylowanej, ogrzewaj i mieszaj przez 10 minut. Mieszaninę przesącz do kolby miarowej o pojemności 100 ml, dopełnij wodą destylowaną do kreski miarowej. Za pomocą pipety przenieś 10 ml powstałego roztworu do innej kolby miarowej 100 ml i dopełnij wodą destylowana do kreski miarowej. Wymieszaj dobrze zawartość.
Bazowy roztwór wzorcowy glukozy (15mg/ml): Odważ 1,5 g glukozy, przenieś do kolby miarowej 100 ml, dodaj wody destylowanej do kreski miarowej i wymieszaj.
Przygotowanie krzywej kalibracyjnej
- Przygotuj 5 kolb miarowych o pojemności 100 ml i oznacz je lilterami A–E. Do każdej z nich odpowiednie objętości roztworu bazowego i wody destylowanej zgodnie z Tabelą 1.
| Kolba | A | B | C | D | E |
|---|---|---|---|---|---|
| Objętość bazowego roztworu glukozy (ml) | 2 | 3 | 6 | 8 | 10 |
| Objętość wody destylowanej (ml) | 98 | 97 | 94 | 92 | 90 |
| Stężenie glukozy (mg/ml) | 0.3 | 0.45 | 0.9 | 1.2 | 1.5 |
2. Przygotuj sześć probówek i napełnij je zgodnie ze wskazówkami w Tabeli 2.
| Numer próbki | Blank | 1 | 2 | 3 | 4 | 5 |
|---|---|---|---|---|---|---|
| Wzorcowy roztwór glukozy (kolba) | N/A | A | B | C | D | E |
| Objętość wzorcowego roztworu glukozy (ml) | 0 | 1 | 1 | 1 | 1 | 1 |
| Objętość odczynnika DNSA (ml) | 1 | 1 | 1 | 1 | 1 | 1 |
| Objętość wody destylowanej | 3 | 2 | 2 | 2 | 2 | 2 |

kalibracyjne
Zdjęcie dzięki uprzejmości
Irena Štrumbelj Drusany
- Ogrzej probówki we wrzącej wodzie przez 5 minut, dzięki czemu zajdzie reakcja cukru z DNSA z utworzeniem czerwono-brązowego produktu.
- Ochłodź probówki, dodaj do każdej z nich po 6 ml wody destylowanej i dobrze wytrząśnij.
- Zmierz transmitancję powstałych roztworów używając niebieskiego światła diody (430nm).
Odczyty transmitancji z przyrządu Spektra, wyrażone w procentach, należy podzielić przez 100 aby otrzymać wartości transmitancji do dalszych obliczeń. Transmitancja jest związana z absorbancją równaniem: A = –logT. P. druga i trzecia kolumna w Tabeli 3.
Fotografia z prawej przedstawia roztwory kalibracyjne. Nawet roztwór odniesienia (woda i DNSA bez glukozy) jest intensywnie zabarwiony. Dlatego koniecznie należy mierzyć transmitancję wszystkich roztworów, również roztworu odniesienia, względem wody destylowanej. Absorbancję związaną z obecnością glukozy w próbce należy obliczyć odejmując zmierzoną wartość absorbancji próbki odniesienia od wartości absorbancji mierzonej próbki (p. kolumna czwarta Tabeli 3).
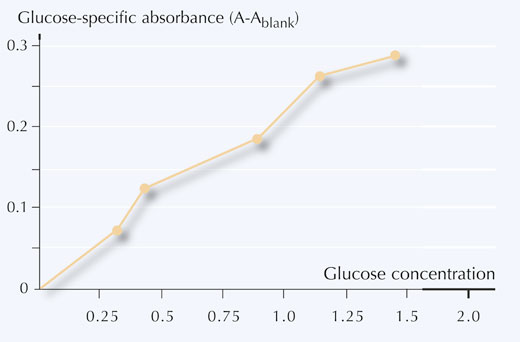
6. Narysuj wykres zależności absorbancji związanej z obecnością glukozy względem stężenia, jak przedstawiono na Rysunek 5.
Pomiary dla próbek dżemu
Próbki dżemu należy przygotować podobnie jak roztwory glukozy wykorzystane do sporządzenia krzywej kalibracyjnej.
- Dla każdego rodzaju dżemu, umieść 1 ml przygotowanego roztworu dżemu (p. “Przygotowanie roztworów”) w probówce, dodaj 1 ml odczynnika DNSA i 2 ml wody destylowanej.
- Ogrzewaj zawartość probówki we wrzącej łaźni wodnej przez 5 minut. DNSA przereaguje z cukrami zawartymi w próbce z utworzeniem czerwono-brunatnych produktów.
- Ochłodź probówki, dodaj do każdej z nich po 6 ml wody destylowanej i dobrze wytrząśnij.
- Zmierz transmitancję (T%) powstałych roztworów używając niebieskiego światła diody (430nm). Odczyty podziel przez 100 aby otrzymać T, przekształć T w A przy pomocy równania A = –logT. Oblicz absorbancję związaną z obecnością glukozy (A – Aodn).
Tabela 4 przedstawia przykładowe wartości zmierzonej transmitancji oraz absorbancję próbek.
| Próbka | Transmitancja (odczyt ze Spektra, T%) |
Absorbancja (A) |
Absorbancja związana z obecnością glukozy (A – Aodn) |
|---|---|---|---|
| 1 | 18.6 | 0.73 | 0.17 |
| 2 | 21.3 | 0.67 | 0.11 |
- Przy pomocy krzywej kalibracyjnej przekształć wartości absorbancji (A) w wartości stężenia glukozy (mg/ml) w próbkach.
Dla przykładów w Tabeli 4, wartości stężenia glukozy odczytane z krzywej kalibracyjnej wynoszą:
Próbka 1: 0.8 mg/ml
Próbka 2: 0.5 mg/ml
6. Znając stężenia glukozy w próbkach, oblicz stężenie glukozy w dżemie za pomocą następującego równania:
Masa glukozy (na 1 g dżemu) = stężenie glukozy w próbce (mg/ml) x 10 x 100 ml
gdzie
stężenie glukozy w próbce jest wartością odczytaną z krzywej kalibracyjnej
10 oznacza rozcieńczenie (p. “Przygotowanie roztworów”)
100 ml jest objętością roztworu zawierającego 1 g dżemu.
W naszym przykładzie,
Próbka 1: masa glukozy (g na 1 g dżemu) = 0,8 mg/ml x 10 x 100 ml = 0,8 g
Próbka 2: masa glukozy (g na 1 g dżemu) = 0,5 mg/ml x 10 x 100 ml = 0,5 g.
Powyższe obliczenia zakładają, że wyjściowa próbka dżemu miała masę 1 g. Jeżeli, np. próbka ważyła 2 g, liczby powyżej należy podzielić przez 2 aby otrzymać masę glukozy zawartej w 1 g próbki.
Cukry redukujące i nie-redukujące
Z chemicznego punktu widzenia, cukrami redukującymi nazywamy aldozy (np. glukozę), posiadające grupę aldehydową, która może być utleniona do grupy karboksylowej. Najpospolitszą próbą na obecność cukrów redukujących jest ogrzewanie próbki z roztworem Benedicta lub Fehlinga, zawierającym jony miedzi(II). Wytrącenie się ceglastego osadu tlenku miedzi(I) wskazuje, że zaszła redukcja.
Cukry nie-redukujące, np. sacharoza, posiadają grupy ketonowe, które nie są w stanie zredukować jonów miedzi(II).Takie cukry nie dają osadu tlenku miedzi(I) w wyniku ogrzewania z roztworem Benedicta lub Fehlinga.
Podziękowania
Autorzy składają podziękowania Europejskiej Komisji, Wydziałowi Głównemu ds. Edukacji i Kultury, za finansowanie projektu “Chemia analityczna w szkołach zawodowych – uczenie przez eksperyment II” (AnalChemVoc II, LLP-LDV-TOI-2008-SI-15), program Leonardo da Vinci.
References
- Gros N (2004) Spectrometer with microreaction chamber and tri-colour light emitting diode as a light source. Talanta 62: 143-150. doi: 10.1016/S0039-9140(03)00420-X
- Gros N, Vrtačnik M (2005) A small-scale low-cost gas chromatograph. Journal of Chemical Education 82: 291-293. doi: 10.1021/ed082p291
- Miller GL (1959) Use of dinitrosalicylic acid reagent for determination of reducing sugar. Analytical Chemistry 31: 426-428.
- This article is freely available from the website of the American Chemical Society. See: http://pubs.acs.org/doi/pdf/10.1021/ac60147a030
Web References
- w1 – Aby uzyskać więcej informacji o projekcie, patrz: www.kii2.ntf.uni-lj.si/analchemvoc2/file.php/1/HTML/experiments.htm
- w2 – Przyrząd Spektra można zakupić w Laboratorijska tehnika Burnik: www.lt-burnik.si/index.php?newlang=english
- w3 – ChemLabS w University of Bristol (www.chemlabs.bris.ac.uk) oferuje pewną liczbę spektrometrów Spektra do wypożyczenia dla nauczycieli, którzy chcieliby wypróbować doświadczenia ze swoimi uczniami lub opracować nowe praktyczne zastosowania. Zainteresowane osoby powinny się skontaktować z Timem Harrisonem (t.g.harrison@bristol.ac.uk).
- w4 – Więcej informacji na temat kolorymetrów Mystrica znajduje się na stronie: http://mystrica.com/Colorimeter.aspx. W tym miejscu znajdują się również opisy doświadczeń z wykorzystaniem kolorymetru. Doświadczenia z reakcjami enzymatycznymi wydają się szczególnie interesujące.
Review
Chemia analityczna w dużym stopniu wykorzystuje anlizę spektrometryczną, jednak profesjonalne przyrządy są kosztowne i przez to mało dostępne dla przeciętnej szkoły w wielu krajach. Niniejsza praca przedstawia spektrometr skonstruowany przez jednego z autorów, który znacznie obniża koszt analiz spektrometrycznych, sprawiając że stają się one dostępne dla każdej szkoły ponadgimnazjalnej. Strona www projektu zawiera szczegółowe opisy doświadczeń szkolnych wykonywanych przy użyciu tego spektrometru, a niniejszy artykuł przedstawia jeden z nich.
Ten artykuł rekomendowałabym jako wprowadzenie do chemii analitycznej nie tylko na lekcjach chemii, ale również biologii i ochrony środowiska, zwłaszcza dla szkół ponadgimnazjalnych, które nie posiadają dobrze wyposażonego laboratorium szkolnego. Przedstawiona koncepcja jest prosta i na tyle przyjazna, aby zachęcić nauczycieli i uczniów do wypróbowania proponowanych doświadczeń oraz opracowania nowych.
Nauczyciele mogliby wykorzystać niniejszy artykuł w dyskusji na temat metodologii spektrometrii i teorii pomiarów spektrometrycznych. Analiza doświadczalna stwarza okazję do matematycznej obróbki danych, łącząc w ten sposób chemię ze statystyką.
Artykuł ten może być również wykorzystany w ćwiczeniach kontrolnych. Na przykład:
- Na podstawie procedury wyznaczania krzywej kalibracyjnej wykorzystującej bazowy roztwór wzorcowy, uzupełnij następującą tabelę:
| Kolba | A | B | C | D | E |
|---|---|---|---|---|---|
| Objętość bazowego roztworu glukozy (ml) | 2 | 3 | 6 | 8 | 10 |
| Objętość wody destylowanje (ml) | 98 | 97 | 94 | ||
| Stężenie glukozy (mg/ml) | 0.3 | 1.2 | 1.5 |





