Un buco nel cielo Understand article
Tradotto da Monica Mauri. Venticinque anni fa, fece notizia la scoperta del buco nello strato di ozono. Come sono cambiate le cose da allora? Tim Harrison e Dudley Shallcross indagano.
La scoperta del buco
concessa da Goddard Space
Flight Center Scientific
Visualization Studio
Fu una scoperta casuale e fortunata, come ricorda Jonathan Shanklin, uno degli scopritori del buco: unitosi alla British Antarctic Surveyw1 nel 1977, aveva l’incarico di digitalizzare un cumulo di dati arretrati sulle misurazioni dell’ozono – che a quei tempi consistevano in fogli di dati manoscritti. Come si scoprì in seguito, questi includevano la decade cruciale, gli anni ’70, nel corso dei quali i livelli dell’ozono cominciarono a diminuire.
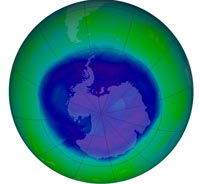
suo massimo annuale il 12
Settembre 2008, con
un’estensione di oltre 27
milioni di chilometri quadrati.
Questo, secondo la NASA, da
considerarsi un buco
nell’ozono di larghezza
moderata
Immagine gentilmente
concessa da NASA
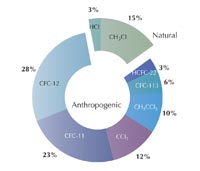
C’erano già stati crescenti timori che i clorofluorocarburi industriali (CFC) – composti organici quali il triclorofluorometano (CFCl3) e diclorodifluorometano (CF2Cl2), allora largamente utilizzati come refrigeranti, propellenti (nelle bombolette spray) e solventi – potessero distruggere lo strato di ozono. In occasione di un open day nel 1983, Shanklin aveva – per ironia della sorte – preparato un grafico per dimostrare che i dati sull’ozono di quell’anno non erano diversi da quelli risalenti a 20 anni prima. Sebbene questo fosse vero per i livelli di ozono complessivi, egli notò che i valori primaverili sembravano proprio diminuire di anno in anno. Ulteriori studi lo confermarono, e nel 1985 Shanklin ed i suoi colleghi Joe Farman e Brian Gardiner pubblicarono le loro scoperte: ad ogni primavera nell’Emisfero Australe, si spalancava un buco nello strato di ozono sopra l’Antartico, esso era probabilmente causato dai CFC, e si stava ingrandendo (Farman et al., 1985).
Quali reazioni chimiche sono alla base di questo fenomeno, è perché il buco nell’ozono è pericoloso?
L’ozono nella stratosfera
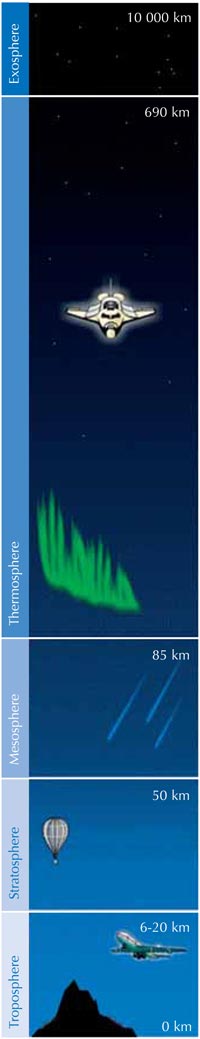
L’ozono (O3) è la forma triatomica, molto meno stabile, dell’ossigeno (O2). È un gas azzurrino presente a basse concentrazioni in tutta l’atmosfera – ed è un’arma a doppio taglio: nella troposfera (vedere sotto), l’ozono è un inquinante dell’aria che può danneggiare l’apparato respiratorio dell’uomo e degli altri animali e bruciare piante delicate. Lo strato di ozono nella stratosfera, tuttavia, è benefico, poiché impedisce alla maggior parte della dannosa luce ultravioletta (UV) emessa dal sole di raggiungere la superficie terrestre.
La velocità di formazione dell’ozono è massima nella stratosfera, il secondo strato più alto dell’atmosfera terrestre (a circa 10-50 km di altitudine; vedere l’immagine), grazie ad un meccanismo fotochimico:
O2 + hν → O• + O• λ ~ 200 nm (1)
O• + O2 + M → O3 + M (2)
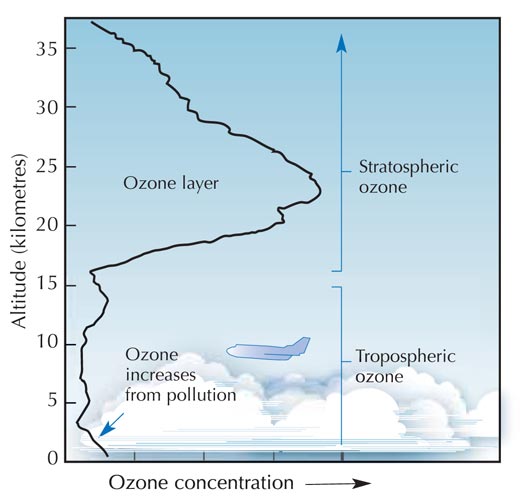
Immagine di pubblico dominio; fonte: Wikimedia Commons
Una molecola di ossigeno (O2) assorbe un fotone di luce UV (hν) con una lunghezza d’onda (λ) di circa 200 nm e si dissocia in due atomi di ossigeno (O•) (reazione 1). Ciascuno di questi può allora combinarsi con un’altra molecola di ossigeno per formare l’ozono, se la pressione (M) è abbastanza elevata (approssimativamente un millesimo di atmosfera) da stabilizzare la molecola di ozono appena formatasi (reazione 2). Maggiore è l’altitudine, più veloce è la reazione 1 (al disotto dei 20 km di quota, non ci sono fotoni a 200 nm in quanto essi sono stati tutti assorbiti dalla reazione 1). La velocità della reazione 2, tuttavia, è maggiore nelle vicinanze del suolo, dove la pressione atmosferica è più elevata. Di conseguenza, la massima quantità di ozono si forma all’incirca tra i 25 e i 30 km di altitudine (vedere il grafico).
La stratosfera ha due importanti effetti sulla la vita sulla Terra. Per prima cosa, l’ozono stesso assorbe radiazioni UV ad alta energia attorno ai 250 nm (reazione 3):
O3 + hν → O• + O2 λ ~ 250 nm ΔH = – 90 kJ mol-1 (3)
Pertanto, l’ossigeno (reazione 1) e l’ozono (reazione 3) sottraggono dall’atmosfera la maggior parte delle radiazioni UV ad onde corte tra i 200 e i 300 nm, che altrimenti sarebbero molto dannose per la vita sulla Terra.
In secondo luogo, la reazione 3 produce molto calore, e in questo modo la stratosfera risulta essere uno strato più caldo rispetto alla parte alta della troposfera (vedere l’immagine a sinistra), rendendo le condizioni meteorologiche nella troposfera meno estreme di quello che sarebbero altrimenti.
Le reazioni 2 e 3 interconvertono rapidamente gli atomi di ossigeno e l’ozono. C’è un’altra reazione lenta, tuttavia, che è nota per il fatto di distruggere sia gli atomi di ossigeno che l’ozono, cioè la reazione tra queste due specie:
O• + O3 → O2 + O2 (4)
Le reazioni 1-4 sono riassunte nel diagramma sottostante.
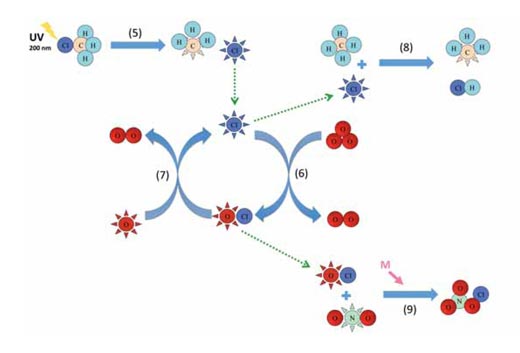
Immagine gentilmente concessa da Marlene Rau
I cicli catalitici naturali riducono i livelli di ozono
Nel 1995, Paul Crutzen, Mario Molina e F Sherwood Rowland furono insigniti del Premio Nobel per la Chimica per il loro lavoro sulla formazione e decomposizione dell’ozono nella stratosfera. Di che cosa si erano resi conto? Negli anni ’70, Crutzen e altri scoprirono l’esistenza di cicli catalitici naturali che accelerano la reazione 4 riducendo la quantità di ozono nella stratosfera (Crutzene, 1970,1971): acqua (H2O), metano (CH4), protossido di azoto (N2O) e clorometano (CH3Cl) vengono rilasciati nell’atmosfera da processi biologici che hanno luogo sulla superficie terrestre, e portano alla formazione di radicali quali ossidrile (OH•), nitrossido (NO•) e cloro (Cl•), che catalizzano la decomposizione dell’ozono.

Immagine gentilmente concessa da Marlene Rau
La reazione 5 mostra come il clorometano rilascia radicali cloro nella stratosfera a causa della fotolisi, e le reazioni 6 e 7 sono un esempio di un ciclo catalitico (vedere il diagramma superiore). Le reazioni degli altri catalizzatori sono analoghe alle reazioni 6 e 7. Il clorometano viene in parte rilasciato dagli organismi sia marini che terrestri, come le macroalghe rosse, i funghi white rot e le piante superiori, per regolare i livelli di ioni cloruro nelle cellule e – dopo 30 o 40 anni – può raggiungere l’alta stratosfera (circa a 40 km di quota), dove viene scisso dalla luce solare (fotolisi):
CH3Cl + hν → •CH3 + Cl• l ~ 200 nm (5)
Il radicale libero cloro risultante (Cl•) può allora prendere parte ad un ciclo catalitico:
Cl• + O3 → ClO• + O2 (6)
ClO• + O• → Cl• + O2 (7)
Le reazioni 6 e 7 prese insieme sono in effetti equivalenti alla reazione 4, ma avvengono molto più velocemente – nel caso del ciclo del cloro/cloro monossido radicale (ClO•), circa 30 000 volte più velocemente. Allora perché questi cicli non distruggono tutto l’ozono? La risposta sta nel termine di questi cicli attraverso la formazione di molecole stabili:
Cl• + CH4 → •CH3 + HCl (8)
ClO• + •NO2 + M → ClONO2 + M (9)
Alla fine, un cloro radicale libero incontrerà una molecola di metano e reagirà per formare acido cloridrico (HCl, reazione 8). Analogamente, un cloro monossido radicale si legherà ad un diossido d’azoto radicale, formando cloronitrato (ClONO2, reazione 9) – un’altra reazione dipendente dalla pressione che quindi va meglio a quote più basse. Sia l’acido cloridrico che il cloronitrato sono molto stabili, e la rimozione del cloro e del cloro monossido radicale alla fine interrompe il ciclo catalitico.
Il rompicapo del buco dell’ozono Antartico
secondo la valutazione WMO
/ UNEP Scientific Assessment
of Ozone Depletion: 1998.
Cliccare sull’immagine per
ingrandirla
Immagine gentilmente
concessa da Andrew Ryzhkov;
fonte: Wikimedia Commons
Non molto tempo prima gli scienziati si erano resi conto che i CFC potevano innescare un analogo ciclo catalitico di degradazione dell’ozono: nel 1974, Molina e Rowland non solo avevano messo in guardia sul fatto che i livelli di CFC stavano continuando a crescere incontrollatamente, ma avevano anche predetto che i CFC avrebbero causato un’ulteriore significativa perdita di ozono a circa 40 km di altitudine (vedere Molina & Rowland, 1974). Comunque, quando il buco nell’ozono fu finalmente scoperto nel 1985, esso si trovava effettivamente a circa 40 km di altezza, sopra il Polo Sud durante la primavera dell’emisfero australe (vedere Farman et al., 1985).
Fu subito evidente che i responsabili erano i radicali liberi cloro provenienti dai CFC, ma molte domande restavano senza risposta.
Perché il buco si posizionava sopra il Polo? E se si formava sopra il Polo Sud, perché non anche sopra il Polo Nord? E perché il buco nell’ozono si trovava a 20 km di altitudine invece che a 40 km, come previsto? Dopotutto, i CFC non potevano essere decomposti dalla luce solare ad una quota tanto bassa quale quella di 20 km, poiché la densità fotonica era insufficiente. Per la stessa ragione, a questa altezza non vengono prodotti abbastanza atomi di ossigeno affinché la reazione 7 abbia luogo. Molti anni di ulteriori ricerche hanno rivelato la storia completa.

Immagine gentilmente concessa da Dudley Shallcross, Tim Harrison, Marlene Rau e Nicola Graf
Innanzitutto, i radicali liberi cloro rilasciati dai CFC, ad esempio
CFCl3 + hν → •CFCl2 + Cl• l ~ 200 nm (10)
potrebbero reagire con il metano (reazione 8) formando acido cloridrico, o con l’ozono (reazione 6) formando radicali cloromonossido, e attraverso la reazione 9 potrebbero successivamente formare cloronitrato. Questa sequenza di reazioni aumenterebbe le concentrazioni di acido cloridrico e cloronitrato a circa 40 km di altezza a livello globale.
allo spazio
Immagine di pubblico dominio;
fonte: Wikimedia Commons
Ad ogni inverno australe, il polo sud è immerso nell’oscurità per circa tre mesi. L’aria nella stratosfera sopra il Polo Sud si raffredda; senza radiazioni UV, la reazione 3 non ha luogo, così non viene rilasciato calore. L’aria scende di quota e la rotazione terrestre la fa ruotare e contemporaneamente formare un vortice, come l’acqua che scende in uno scarico. Questo vortice è così forte che l’aria esterna non può entrarvi, e l’aria interna non può uscire. L’aria, che è ricca di acido cloridrico e di cloro nitrato, da 40 km di altezza viene risucchiata in questo vortice freddo e scuro.
Nel freddo estremo dell’inverno polare, l’aria in questo vortice diventa così fredda che al disotto dei -78°C (195 K) e ad un’altezza di 15-25 km, si formano nuvole stratosferiche polari di cristalli di ghiaccio di acqua e/o acido.
Il primo comportamento chimico peculiare è che l’acido cloridrico ed il cloro nitrato possono assorbire al disopra delle nuvole stratosferiche polari e subire una veloce reazione eterogenea dalla fase gassosa a quella solida, producendo acido nitrico (HNO3) che viene incorporato nei cristalli di ghiaccio, mentre il cloro (Cl2) viene nuovamente rilasciato nella fase gassosa.
HCl + ClONO2 → HNO3 + Cl2 nuvole stratosferiche polari (11)
Questa reazione può avere luogo per tutto l’inverno, se è abbastanza freddo da formare nuvole stratosferiche polari. Quando in primavera ritorna la luce del sole, ci sono molte molecole di cloro a circa 15-25 km di altitudine, che vengono scisse fotoliticamente dando luogo a radicali cloro:
Cl2 + hν → Cl• + Cl• l ~ 350 nm (12)
e successivamente radicali cloromonossido attraverso la reazione 6.
Tuttavia, durante la primavera polare, la reazione 7 (la formazione dei radicali cloro e di molecole di ossigeno a partire dai radicali cloromonossido e dai radicali ossigeno) è molto lenta, poiché sono presenti pochi atomi di ossigeno a causa della mancanza di fotoni da 200 nm a quell’altezza, e qui è dove si verifica un secondo peculiare comportamento chimico. A basse temperature, come all’interno del vortice polare – che è ancora molto freddo anche in primavera – i radicali cloro monossido possono formare un dimero, il perossido di cloro (ClOOCl):
ClO• + ClO• → ClOOCl (13)
Questo dimero è instabile a temperatura ambiente, ma si forma piuttosto velocemente a basse temperature (al disotto dei -30°C) e può essere scisso fotoliticamente:
ClOOCl + hν → Cl• + O2 + Cl• l ~ 300 nm (14)
Così, anche se la reazione 7 non può avvenire, la reazione 14 fornisce un modo per rigenerare i radicali liberi cloro con l’aiuto della luce, ed il ciclo catalitico dell’impoverimento dell’ozono può iniziare veramente ora che la luce solare è tornata.
In che modo questo differisce dai cicli catalitici naturali che abbiamo osservato prima- perché c’è una rimozione totale dell’ozono ad alcune altitudini in questo vortice? Per prima cosa, la reazione 8 (che rimuove i radicali cloro e può terminare il ciclo) è molto lenta alle basse temperature che si trovano nel vortice, e quindi inefficace. In secondo luogo, tutto di diossido di azoto richiesto per la reazione 9 (che potrebbe allo stesso modo terminare il ciclo, attraverso la formazione di ClONO2) hè stato convertito in acido nitrico durante l’inverno (es, con le reazioni 9 e 11) e non è disponibile per essere rigenerato poiché non c’è un flusso (corrente) ascendente nel vortice (alla base del vortice, l’aria fluisce dal Polo Sud all’Equatore, dove si verifica il flusso ascendente). Pertanto il ciclo prosegue incontrollato e distrugge tutto l’ozono a quel livello. Infine, senza l’ozono, la reazione 3, che altrimenti riscalderebbe questa regione, non si verifica, e così il vortice dura fino a primavera, aggravando il buco nell’ozono.

ad Asker, Norvegia
Immagine di pubblico dominio;
fonte: Wikimedia Commons
L’unica ragione per la quale il buco dell’ozono è più grave sopra il Polo Sud che sul Polo Nord è che le temperature primaverili nella stratosfera sopra il Polo Nord sono leggermente più elevate di quelle sopra il Polo Sud, poiché dalle medie alle elevate latitudini dell’Emisfero Nord ci sono più catene montuose che cambiano le dinamiche dei flussi atmosferici, e di conseguenza ci sono meno nuvole stratosferiche polari.
Infine, nella tarda primavera, il flusso di aria ricca di ozono proveniente dall’alto riscalda il vortice attraverso la reazione 3, permettendogli finalmente di rompersi. Poiché allora diventa nuovamente possibile lo scambio con altre parti dell’atmosfera, il buco dell’ozono viene riempito da ozono proveniente dall’aria circostante.
In certi anni, il buco nell’ozono sopra l’antartico si è ingrandito tanto da raggiungere l’Australia, Nuova Zelanda, Cile e Argentina, ingrandendosi fino a 1.5 volte l’estensione degli USA; e quando il buco nell’ozono si rompe, l’aria impoverita di ozono viene trasportata verso le aree vicine (e popolate), compreso il Sudafrica. Per le popolazioni di questi paesi, il buco nell’ozono costituisce una minaccia diretta alla salute. La principale preoccupazione è data dall’accresciuta esposizione ai raggi UV, che potrebbe provocare tumori della pelle e cataratte corticali oculari, come pure danni al sistema immunitario. Inoltre, dosi eccessive di radiazioni UV, danneggiano le piante e i materiali da costruzione.
I CFC e l’ozono oggi
Oggigiorno, abbiamo una buona comprensione della fisica e della chimica che governano lo strato di ozono. Una volta che il reale impatto dei CFC sulla diminuzione dell’ozono è risultato evidente, i governi hanno approvato delle norme volte a bloccare l’uso dei CFC, sostituendoli con specie alternative a più breve durata (idrofluorocarburi e idroclorofluorocarburi), che col tempo avrebbero dovuto essere a loro volta gradualmente eliminati; il Protocollo di Montreal del 1987 ed in particolare i suoi emendamenti del 1990 e 1992, che acceleravano l’eliminazione, furono un successo ambientale.
I dati più recenti dell’AGAGE (Advanced Global Atmospheric Gases Experiment)w2, che ha monitorato i livelli dei CFC e la loro sostituzione fino dal 1978, mostrano che persino i livelli atmosferici di diclorofluorometano (CF2Cl2), il CFC a vita più lunga, ora stanno diminuendo: la legislazione è stata efficace (sinistra).
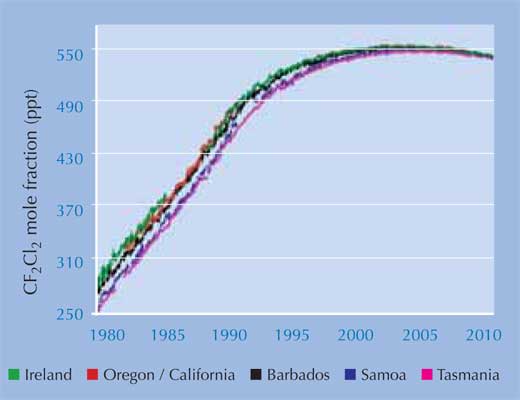
Immagine gentilmente concessa dal progetto AGAGE
strato di ozono se i CFC non
fossero stati banditi. Cliccare
sull’immagine per ingrandirla
NASA Immagine gentilmente
concessa da Goddard Space
Flight Center Scientific
Visualization Studio
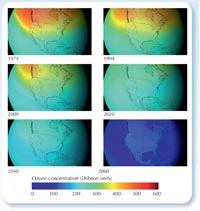
Un buco nell’ozono si forma ancora ogni primavera sopra il Polo Sud, ma le stime dicono che entro il 2050 non comparirà più, e che per il 2080 l’ozono globale ritornerà ai livelli del 1950.
Il buco nell’ozono è la conseguenza di un crescente uso dei CFC, che ebbe inizio negli anni ’30 – come qualsiasi altro gas, i CFC hanno impiegato 30-40 anni per raggiungere l’alta stratosfera, il che significa che esiste un corrispondente ritardo nei loro effetti sullo strato di ozono. Noi stiamo attualmente subendo il picco stratosferico di cloro dovuto ai più elevati livelli di utilizzo di CFC verificatisi negli anni ’80 – di conseguenza la grandezza massima che il buco nell’ozono raggiunge ogni anno dovrebbe cominciare a decrescere da qui a pochi anni.
Sebbene il recupero sia lento, abbiamo definitivamente arrestato un disastro: gli scienziati hanno calcolato che se l’uso dei CFC avesse continuato a crescere al ritmo del 3% all’anno come negli anni ’70, questo avrebbe portato ad un buco nell’ozono globale entro il 2060, con tutti i conseguenti problemi alla salute (vedere l’immagine, destra; Newman et al., 2009).
Forse la lezione più importante che possiamo imparare dal buco nell’ozono è data proprio dall’evidenza di quanto velocemente il nostro pianeta possa cambiare come conseguenza dell’impatto umano – specialmente in peggio – ma anche in meglio – e che il cambiamento è possibile se intraprendiamo delle azioni in modo concertato, efficace e veloce.
References
- Crutzen PJ (1970) Influence of nitrogen oxides on atmospheric ozone content. Quarterly Journal of the Royal Meteorological Society 96: 320-325. doi: 10.1002/qj.49709640815
- Crutzen PJ (1971) Ozone production rates in an oxygen-hydrogen-nitrogen oxide atmosphere. Journal of Geophysical Research 76(30): 7311-7327. doi: 10.1029/JC076i030p07311
- Farman JC, Gardner BG, Shanklin JD (1985) Large losses of total ozone in Antarctica reveal seasonal ClOx/NOx interaction. Nature 315: 207-210. doi:10.1038/315207a0
-
L’articolo è liberamente accessibile sul sito web di Nature (www.nature.com) o direttamente dal link:http://tinyurl.com/2wemxhn
-
- Molina MJ, Rowland FS (1974) Stratospheric sink for chlorofluoromethanes – chlorine atomic-catalysed destruction of ozone. Nature 249: 810-812. doi: 10.1038/249810a0
-
L’articolo è liberamente accessibile sul sito web di Nature (www.nature.com) o direttamente dal link: http://tinyurl.com/2u69cul
-
- Newman PA et al. (2009) What would have happened to the ozone layer if chlorofluorocarbons (CFCs) had not been regulated? Atmospheric Chemistry and Physics 9: 2113-2118. doi: 10.5194/acp-9-2113-2009
- Patterson L (2010) Un legame chimico: Nick Barker, un ponte tra scuola e università nel Regno Unito. Science in School 15.
- Veneu-Lumb F, Costa M (2010) Utilizzare le notizie nella classe di scienze. Science in School 15.
Web References
- w1 – British Antarctic Survey è responsabile delle attività scientifiche del Regno Unito nell’Antartico. Vedere: www.antarctica.ac.uk
w2 – L’ Advanced Global Atmospheric Gases Experiment, AGAGE, è un’iniziativa sponsorizzata dalla NASA- che, dal 1978, misura continuamente la composizione dell’atmosfera globale, compresi i CFC e la maggior parte dei gas serra non-CO2 specificati nel protocollo di Kyoto. Per avere accesso ai loro dati e per ulteriori informazioni, vedere: http://agage.eas.gatech.edu
Resources
- Sidney Chapman per primo ha dedotto il meccanismo fotolitico attraverso il quale l’ozono si forma e si degrada. Vedere:
-
Chapman S (1930) On ozone and atomic oxygen in the upper atmosphere.Philosophical Magazine Series 7 10(64): 369-383.
-
- Jonathan Shanklin, uno degli scienziati che hanno scoperto il buco nell’ozono, ha pubblicato le sue riflessioni 25 anni dopo la scoperta:
-
Shanklin J (2010) Reflections on the ozone hole. Nature 465: 34-35. doi: 10.1038/465034a
-
Scaricate gratuitamente l’articolo qui, oppure abbonatevi oggi aNature : www.nature.com/subscribe
-
- Nature ha pubblicato anche una raccolta di articoli, alcuni dei quali consultabili gratuitamente, che hanno migliorato la nostra conoscenza della stratosfera e dello strato di ozono, o raccontato la storia della sua scoperta. Vedere: www.nature.com/nature/focus/ozonehole
- La pagina dell’Ozone Hole Watch della NASA offre mappe storiche dell’ozono, fatti sull’ozono, ed una galleria multimediale correlate all’ozono, una collezione di moduli didattici su argomenti correlati all’ozono, e molto altro. Vedere: http://ozonewatch.gsfc.nasa.gov
- L’Università di Cambridge, UK, ha realizzato un tour virtuale del buco nell’ozono, della sua storia e dei suoi aspetti scientifici. Il tour è disponibile in Inglese, Francese e Tedesco. Vedere: www.atm.ch.cam.ac.uk/tour
- I 74 scienziati che hanno partecipato alla riunione di riesame del quadro per la valutazione dell’ozono a Les Diablerets, in Svizzera, nel 2002, , hanno pubblicato20 Questions and Answers about the Ozone Layer (20 Domande e Risposte sullo Strato di Ozono), che comprendono i contributi dei cicli di attività solare ed eruzioni vulcaniche. Vedere: www.gcrio.org o utilizzare il link diretto: http://tinyurl.com/2wpvf9r
- Introduction to Atmospheric Chemistry del Professor Daniel J Jacob dell’Harvard University, che è liberamente accessibile come file PDF, contiene una sezione sull’ozono, che comprende il diagramma ‘Chronology of the ozone hole’ (chapter 10.3.3) – (Cronologia del buco dell’ozono – capitolo 10.3.3.). Vedere: http://acmg.seas.harvard.edu/people o utilizzare il link diretto: http://tinyurl.com/39vhy6a
- Ozzy Ozone è un sito web dell’United Nations Environment Programme (Programma Ambientale delle Nazioni Unite) che offre fumetti didattici, giochi, un glossario e altro – compresi dei paccheti didattici con guide per studenti ed insegnanti delle scuole sia primarie che secondarie. Tutto il materiale è disponibile in Inglese, Francese, e Spagnolo. Vedere: www.ozzyozone.org
- Il sito web The Ozone Depletion dello scienziato ed autore Rod Jenkins offre informazioni complete: www.ozonedepletion.info
- Il sito web del settore del Programma Ambientale delle Nazioni Unite “OzonAction” fornisce un’ampia collezione di dati e informazioni sull’ozono e sul Protocollo di Montreal. Vedere: www.unep.fr/ozonaction
-
È possibile consultare anche le pagine della segreteria del Programma Ambientale delle Nazioni Unite “Ozono”, in Inglese, Francese e Spagnolo: http://ozone.unep.org
-
- La NASA offre due video online degli sviluppi dell’atmosfera sopra l’Artico, registrati dal satellite Upper Atmosphere Research Satellite (UARS).
-
È possibile osservare l’aumento della concentrazione di cloronitrato nel febbraio./marzo 1993. Vedere www.nasaimages.org o utilizzare il link diretto: http://tinyurl.com/2w6wgh4
-
Questo video mostra la formazione di nuvole stratosferiche polari. Vedere www.nasaimages.org o usare il link diretto www.nasaimages.org o utilizzare il link diretto:http://tinyurl.com/33dfn6e
-
- Inoltre, la NASA ha pubblicato le immagini di una stagione nell’esistenza del buco nell’ozono. Vedere: www.nasa.gov/vision/earth/lookingatearth/25TOMSAGU.html
Review
Il buco nell’ozono è un problema di attualità di livello mondiale, e troverete questo articolo veramente utile per addentrarvi nell’argomento. I processi chimici coinvolti sono descritti dettagliatamente. Durante le lezioni di chimica, questo articolo può essere utilizzato per spiegare le strutture atomiche e i legami chimici, i radicali liberi, i cicli catalitici, e l’influenza della luce e della temperatura sulle reazioni chimiche.
Per le lezioni di Scienze della Terra, l’articolo potrebbe essere impiegato nella trattazione dei seguenti argomenti:
- L’influenza dell’atmosfera sul clima
- I processi biologici che avvengono sulla superficie terrestre e che influiscono sugli organismi marini.
- Morfologia della Terra e distribuzione delle catene montuose sulla superficie terrestre
- Il cambio delle stagioni, l’inclinazione assiale della Terra e la rotazione
Esiste l’opportunità di effettuare lavori interdisciplinari collegando chimica e scienze della Terra. È possibile affrontare i seguenti argomenti:
- La distribuzione geografica degli organismi che producono sostanze chimiche attive nei cicli catalitici naturali. Dove vivono questi organismi? Quali sostanze chimiche producono?
- La composizione chimica dell’atmosfera e la sua influenza sul clima. Da quali gas è composta l’atmosfera? In che modo le proprietà dell’atmosfera determinano le condizioni climatiche sulla superficie terrestre, e qual è la differenza con gli altri pianeti?
L’articolo potrebbe anche costituire il punto di partenza per una lezione su come la scienza venga riportata nei media. Gli studenti potrebbero confrontare questo articolo con quelli della stampa generalista: questi ultimi forniscono una visione equilibrata della questione, menzionando sia i fattori chimici che quelli naturali che portano alla formazione del buco nell’ozono? Nel complesso, minimizzano o enfatizzano il fenomeno? Perché? Per ignoranza dei giornalisti, per strategia politica, o entrambi? Per ulteriori idee per l’utilizzo delle news nell’insegnamento delle scienze, vedere Veneu-Lumb & Costa (2010).
Infine, il testo è utilizzabile anche come base per un esercizio di comprensione. Si possono porre le seguenti domande:
- Perché questo argomento è attualmente una questione molto dibattuta?
- Qual è il ruolo dei fattori naturali nella crescita del buco nell’ozono? E cosa ne dite del fattore umano?
Teresa Celestino, Italia





