Moleculaire gastronomie in het scheikundelokaal Teach article
Vertaald door Piet Das. Alginaatbolletjes zijn bruikbaar in de scheikundelessen en in de moleculaire gastronomie.
Moleculaire gastronomie is een nieuwe trend in de haute cuisine, met chef-koks die hun gasten nieuwe en vreemde culinaire ervaringen voorzetten met behulp van vloeibare stikstof, gels en schuim. Een van de technieken die steeds bekender wordt is het gebruik van alginaatbolletjes die verschillende vruchtensappen en smaakstoffen bevatten. Zelfs als je niet frequent Michelin-sterrenrestaurants bezoekt, kunt je deze bolletjes in “bubble tea” zijn tegengekomen.
“Bubble tea”, oorspronkelijk uitgevonden in Taiwan in de jaren 1980, sloeg enkele jaren geleden over uit Oost-Azië naar westerse landen. Het bestaat uit een op thee gebaseerde drank die ook gelei-, tapioca of alginaatbolletjes bevat, gevuld met vruchtensap of siroop.
Het maken en onderzoeken van het gedrag van alginaatbolletjes kan fascinerend zijn en kan in onderzoekend leren worden gebruikt bij natuurwetenschappen.
In dit artikel, geven we suggesties hoe alginaatbolletjes kunnen worden gebruikt om verschillende wetenschappelijke concepten aan te leren, en presenteren daarbij wetenschappelijke verschijnselen op een esthetische manier. We introduceren hoe je alginaatbolletjes kunt maken en geven drie voorbeeldexperimenten die elk kunnen worden uitgevoerd in één lesuur: een zuur-base reactie, chemo-luminescentie met redox scheikunde en thermische convectie met een thermochroom effect.
De vorming van alginaat bolletjes
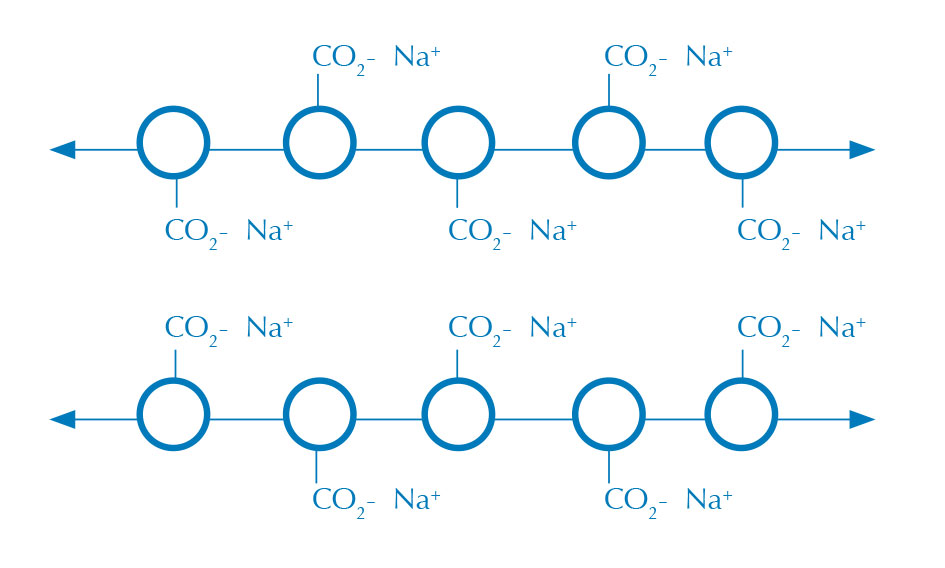
NaCl oplossing (geen
crosslinking)
Afbeelding met dank aan
Nicola Graf
Alginaat bolletjes worden gevormd wanneer een waterige alginaatoplossing (figuur 1) in contact komt met een oplossing die calciumionen bevat, waardoor een membraan van calciumalginaat wordt gevormd waar de twee oplossingen bij elkaar komen (figuur 2). Alginaat is een lang polysacharide dat ge-crosslinked wordt in de aanwezigheid van een tweewaardig kation, zoals calcium, waarbij een in water onoplosbare gel ontstaat.
Materialen
- 2 g natriumalginaat (Na(C6H806))
- 100 mL gedestilleerd water
- 10 mL 0,5% calciumchloride (CaCl2) of een 1% calciumlactaatoplossing (Ca(C3H5O3)2
- Twee bekerglazen van 250 mL
- Druppelpipet of lepel
- Glazen roerstaafje of ander roerstaafje
- Zeef of lepel
Werkwijze
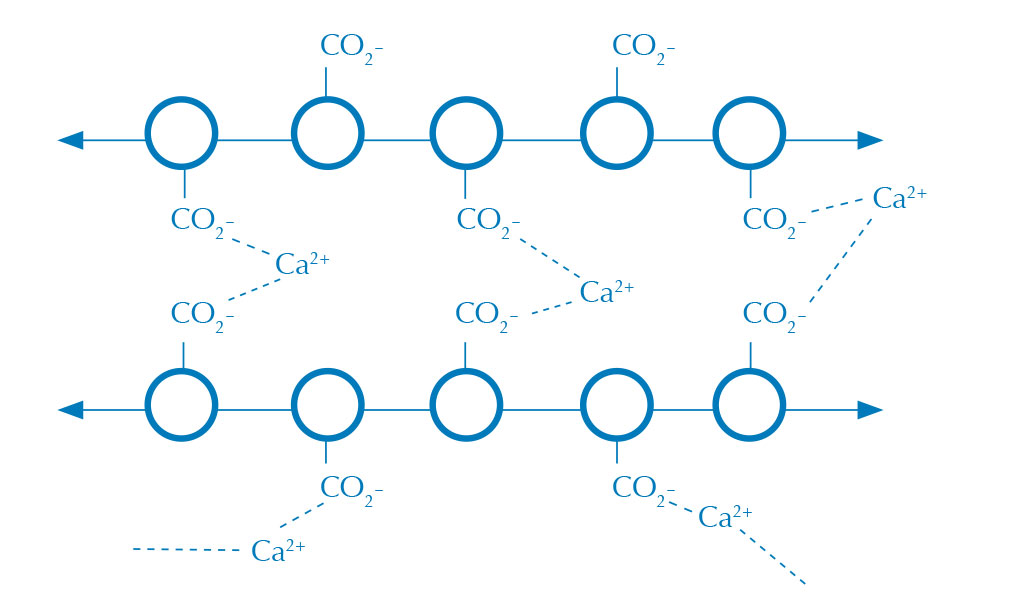
in CaCl2 (met crosslinking)
Afbeelding met dank aan
Nicola Graf
- Meng het alginaat en het water in een van de bekerglazen
- Wacht tenminste 15 minuten tot alle alginaat is opgelost.
- Giet de calciumionenoplossing in het andere bekerglas.
- Druppel de alginaatoplossing bij de calciumionenoplossing met een pipet of een lepel. Roer de calcium-oplossing om te voorkomen dat de alginaat bolletjes aan elkaar kleven.
- Als de bolletjes stevig zijn kun je ze uit de calciumionenoplossing verwijderen met een lepel of een zeef.
Als de vloeistoffen met elkaar in aanraking komen, wordt een gelatineus calciumalginaat gevormd, dat de alginaatoplossing in bolletjes inkapselt. Als andere verbindingen ook worden toegevoegd aan de alginaatoplossing, zoals smaakstoffen, kleurstoffen of indicatoren, worden die ook ingekapseld.
Zuur-base bolletjes
Materialen
- 2 g natriumalginaat
- 500 mL gedestilleerd water
- 10 mL 0,5 mL calciumchloride- of 1% calciumlactaatoplossing
- Drie 250 mL bekerglazen
- Druppelpipet of lepel
- Glazen roerstaafje of ander roerstaafje
- Zeef (optioneel)
- Indicatoroplossing
- Verschillende zuren en basen
Werkwijze
- Volg de Werkwijze hierboven voor het maken van alginaat bolletjes, maar doe een zuur-base indicator bij de alginaatoplossing net voor het toevoegen van het alginaat aan de calciumoplossing.
- Verwijder de bolletjes en doe ze in een bekerglas met daarin de rest van het gedestilleerde water.
- Let op de kleur van de bolletjes.
- Voeg systematisch verschillende zuren en basen toe aan het water en noteer hoe de kleur van de bolletjes verandert.
Hoewel de indicatoroplossing in de bolletjes zit kunnen door het alginaatmembraan hydroxide- of waterstofionen (gehydrateerde protonen) uitgewisseld worden tussen de inhoud van de bolletjes en de omringende vloeistof. Verandering van de pH van de omringende vloeistof door toevoeging van een zuur of een base zal daarom de pH van de vloeistof in de bolletjes veranderen, en daardoor verandert de indicator van kleur.
In de klas kunnen technische indicatoren worden gebruikt; thuis kunnen pH-gevoelige extracten van rode kool of radijsschil gebruikt worden.
Lichtgevende bolletjes
Alginaat bolletjes kunnen worden gebruikt om het verschijnsel luminescentie te illustreren, door simpel een luminescente verbinding aan de alginaatoplossing toe te voegen voordat de bellen worden gevormd. Een eenvoudige manier om dit te doen is riboflavine (vitamine B2) te gebruiken, die fluoresceert onder Uv-licht. Hoewel je pure riboflavine kunt gebruiken, kun je het ook halen uit een voedingsmiddel zoals instant custardpoeder waar het in zit.
Materialen
Riboflavine extraheren (optioneel):
- Een pakje instant custard poeder met daarin riboflavine (ook bekend als E101)
- 200 mL Gedestilleerd water
- Bekerglas
- Roerder
- Trechter met filtreerpapier
Lichtgevende bolletjes maken:
- Twee spatelpuntjes riboflavinepoeder (C17H20NaO6)
- 2 g natriumalginaat
- 100 mL water
- 10 mL 0,5 calciumchoride- of 1% calciumlactaatoplossing
- Twee bekerglazen van 250 mL
- Druppelpipetje of lepel
- Glazen roerstaafje of andere roerder
- Zeef (optioneel)
- UV bron
- 15-20 mL verzadigde natriumdithionietoplossing (Na2S2O4)
- 15-20 mL waterstofperoxide (20%-35%)
Werkwijze
- Om de riboflavine uit het instant custardpoeder te extraheren doe je ongeveer 8 g poeder in 200 mL water. Roer goed gedurende ongeveer 10 minuten en filtreer.
- Volg de Werkwijze voor het maken van alginaatbolletjes, maar doe de riboflavine bij de alginaatoplossing net voor de bolletjesvorming.
- Schijn UV licht op de bolletjes die zich vormen. Ze zouden moeten fluoresceren, waarbij ze een geel-groen licht uitstralen.
- Zet het UV licht uit en de bolletjes zullen stoppen met fluoresceren.
- Zet het licht weer aan.
- Doe de natriumdithioniet bij het bekerglas met daarin de alginaat bolletjes. Je zou moeten zien dat de luminescentie wordt uitgeschakeld, doordat het natriumdithioniet door het membraan van de alginaat bolletjes gaat waardoor de riboflavine binnenin vermindert.
- Doe er waterstofperoxide bij om de riboflavine te oxideren, waardoor de luminescentie weer aan gaat.
Thermische bolletjes
Een thermochrome inkt aan de alginaatoplossing toevoegen kan helpen om het fenomeen van convectie te illustreren. In Japan wordt een speciale thermo-inkt verkocht op basis van krisatlviolet lacton (en niet te verwarren met de thermo-inkten die gebruikt worden in thermoprinters) om warmteverschijnselen te illustreren bij natuurkunde.
Materialen
- 2 g natriumalginaat
- 100 mL gedestilleerd water
- 10 mL 0,5% calciumchloride- of 1% calciumlactaatoplossing
- Twee bekerglazen van 250 mL
- Druppelpipetje of lepel
- Glazen roerstaafje of andere roerder
- Zeef
- 3-5 mL thermochromische inkt
- Hittebestendig bekerglas gevuld met water
- Warmtebron
Werkwijze
- Maak de bolletjes zoals hierboven beschreven, maar doe de inkt bij de alginaatoplossing net voordat de bolletjes zich vormen.
- Zet de gevormde bolletjes in een hittebestendig bekerglas met water.
- Verhit het bekerglas totdat de bolletjes omhoog gaan.
De alginaat bolletjes laten bewegen om convectie te laten zien: ze gaan omhoog doordat ze minder dicht worden bij verwarmen en vervolgens door koelen zakken ze terug naar beneden doordat ze weer dichter worden. Tegelijkertijd zullen de alginaat bolletjes van kleur veranderen, waaruit blijkt dat convectie wordt samenhangt met temperatuurverandering.
Met dank aan
Een deel van dit werk werd gefinancierd door het Teaching Enquiry with Mysteries Incorporated (TEMI) project. (Peleg et al., 2015), ondersteund door de Europese Unie uit hoofde van het 7e kaderprogramma voor onderzoek Financiering “Wetenschap in de maatschappij” onder subsidieovereenkomst No. 321.403.
References
- Peleg R et al. (2015) The magic sand mystery. Science in School 32: 37-40.
Resources
- Om meer te leren over moluculaire gastronomie, zie:
- Davies E (2014) From methional to fried chicken. Science in School 30: 44–48.
- Om meer aan de weet te komen over bolletjesvorming in de moleculaire gastronomie, zie: www.molecularrecipes.com/spherification-class/basic-spherification
- Een video die laat zien hoe je een eetbare water ‘fles’ uit alginaat kunt maken is te vinden op: www.youtube.com/watch?v=YLjzsfgk198
- Video’s van de hier beschreven experimenten zijn te vinden op het TEMI YouTube kanaal. Zie: www.youtube.com/channel/UC62-j3UpwF-Z5yh84umnxIQ
- Bekijk de Chemistry World website voor een podcast over natriumalginaat.
- Een Duitstalige beschrijving van het gebruik van bolletjes voor onderzoekend leren, waarbij de TEMI filosofie gevolgd wordt kan worden gedownload van de website van het TEMI team van de Universiteit van Bremen, Duitsland. Zie: www.chemiedidaktik.uni-bremen.de/temi/index.html. Een Engelse vertaling zal binnenkort worden gepubliceerd in Book of Science Mysteries op de TEMI website: www.teachingmysteries.eu
- Bolletjesvorming kan worden gebruikt bij vele andere experimenten. Voor een activiteit waarbij ‘algen ballen’ worden gebruikt om de bijvoorbeeld fotosynthese te verkennen, zie: www.saps.org.uk of gebruik de directe link: http://tinyurl.com/qxwcafa
- Het merendeel van de chemische stoffen en apparatuur die je nodig hebt voor deze onderzoeken zijn gemakkelijk ye vinden bij reguliere natuurwetenschappelijke onderwijsleveranciers. Als u een leverancier van de Japanse thermochrome inkt niet kunt vinden, moet het mogelijk zijn om thermochrome slurries te kopen voor waterig gebruik bij gespecialiseerde kleurstoffabrikanten zoals SpecialFX & Coatings in het Verenigd Koninkrijk. Zie: www.sfxc.co.uk
Review
Onze nieuwsgierigheid wordt altijd aangetrokken door veranderingen van kleur, positie, vorm en licht. Het gebruik van dergelijke veranderingen in ons onderwijs kunnen onze leerlingen helpen om meer van natuurwetenschappen te genieten. De eerste en tweede activiteiten zullen geschikt zijn voor leerlingen van 15-16 jaar, terwijl de derde activiteit, waarbij convectie en luminescentie, ook geschikt zal zijn voor jongere studenten, van 11-14 jaar oud.
Na de practica kan de leraar vragen waarom bolletjes werden gebruikt, wat leidt tot een discussie over schei- en natuurkundige eigenschappen van materie.
Enrico Capaccio, Istituto Superiore S Bellarmino, Montepulciano (Siena), Italië





