Il gioco dei numeri: l’estensione della tavola periodica Understand article
Tradotto da Monica Menesini. Fino a pochi secoli fa, era opinione comune che il mondo fosse costituito solo da aria, acqua, terra e fuoco. Da allora gli scienziati hanno scoperto 118 elementi, e sono alla ricerca del 119esimo.

concessa da Jim Mikulak;
fonte dell’immagine:
Wikimedia Commons
Nei laboratori europei dell’era spaziale i ricercatori stano collaborando per scoprire nuovi elementi. Se ci riusciranno, entreranno a far parte del club di scienziati che hanno riscritto la tavola periodica.
Gli antichi greci possono essersi sbagliati riguardo al fatto che esistano solo quattro elementi – aria, acqua, terra e fuoco – ma avevano sicuramente ragione nel ritenere che gli elementi fossero gli ingredienti di tutto ciò che ci circonda, legati gli uni agli altri per formare composti e mescolati insieme in proporzioni differenti. Ma mentre i composti esistono in infinite varietà, gli elementi sono molto più semplici, e finora se ne conoscono solo 118w1. Scoprirne uno nuovo è una grande sfida.
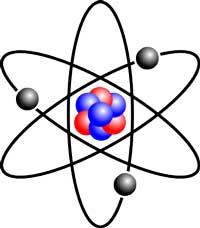
Immagine gentilmente
concessa da Halfdan; fonte
dell’immagine: Wikimedia
Commons
Gli atomi, i mattoni che costituiscono la materia, sono tutti formati dagli stessi, semplici costituenti: minuscole particelle chiamate protoni e neutroni, e ancor più minuscoli elettroni che si muovono intorno ad essi. Il numero di protoni di un atomo – il suo numero atomico – definisce la natura dell’elemento. Un atomo di ossigeno, per esempio, ha otto protoni, otto neutroni (generalmente) e otto elettroni, mentre l’elemento più pesante puo avere più di cento particelle di ciascun tipo.
* * *
Il chimico russo Dmitri Mendeleev non conosceva queste particelle quando, nel 1869, organizzò gli elementi in una tabella basata sul loro peso atomico. Ben presto si accorse che era presente uno schema di base: in particolare le colonne raggruppavano insieme elementi con proprietà sorprendentemente simili. Per esempio potassio, rubidio e cesio, tre metalli che regiscono violentemente con l’acqua, erano disposti uno sopra l’altro.
All’inizio la tavola di Mendeleev era piena di caselle vuote: tra lo zinco e l’arsenico, per esempio, sembrava mancassero due elementi. Ma Mendeleev fu in grado di prevedere che queste caselle vuote sarebbero state riempite con elementi ancora da scoprire, e usò la tabella per prevedere quali sarebbero state le loro proprietà. Ed ebbe ragione: le caselle vuote furono ben presto riempite da gallio e germanio.

Mendeleev, pubblicata nel
1869. Cliccare sull’immagine
per ingrandirla.
Fonte dell’immagine:
Wikimedia Commons
Con poche modifiche, la tavola predisposta da Mendeleev è diventata quella che usiamo oggi: la tavola periodicaw1, qualcosa di così fondamentale che non possiamo fare a meno di pensare che dovesse per forza essere inventata.
Negli anni seguenti, i chimici hanno cercato di riempire gli spazi vuoti: nel frattempo, hanno anche scoperto perché la tavola periodica funziona: le righe e le colonne rispecchiano la disposizione degli elettroni nei diversi elementi, e gli elettroni a loro volta determinano molte delle proprietà dell’elemento.
Nel 1945 fu riempito l’ultimo spazio vuoto della tavola. La scienza aveva finalmente scoperto tutti gli elementi? Stranamente la risposta è si e no. Tutti gli elementi che esistono sulla Terra erano stati scoperti. Ma niente vietava che nuovi elementi potessero essere creati artificialmente, attaccandoli alla fine della tavola periodica, oltre l’elemento 92, l’uranio.

Fonte dell’immagine:
Wikimedia Commons
Con lo sviluppo della ricerca atomica negli anni ’40, proprio mente venivano riempiti gli ultimi spazi vuoti della tavola periodica, una sequela di nuovi elementi sintetizzati in laboratorio iniziarono ad aggiungersi alla fine della tavola periodica, arrivando fino ai 118 elementi noti fino ad oggi. Nessuno sa quanti altri elementi potranno essere scoperti.
Quello che sappiamo invece è che sintetizzare nuovi elementi diventa sempre più difficile. Oggi per avere la probabilità di scoprirne uno c’è bisogno di un laboratorio molto attrezzato: gli elementi facili da scoprire sono già stati tutti scoperti.
* * *
Noto con il nome scioglilingua ununennio, l’elemento su cui si focalizza l’attenzione di un team internazionale probabilmente si rivelerà il più difficile da scoprire.

119, gli scienziati pensano di
sparare un fascio di atomi di
titanio su un bersaglio di
berkelio.
Immagine gentilmente
concessa da
stockphotosforfree.com
Il team, coordinato dal Centro GSI Helmoltz per la Ricerca degli Ioni Pesanti (GSI Helmholtzzentrum für Schwerionenforschung), in Germania, cioinvolge circa 20 centri di ricerca in tutto il mondo e ha l’obiettivo di sintetizzare l’elemento 119. Il metodo sembra molto semplice: sparare un fascio di atomi di titanio (numero atomico 22) su un bersaglio di berkelio (97). Sommate i due e – eureka! – otterrete 119.
Naturalmente non è così semplice.
Prima di tutto, neanche il berkelio altamente radioattivo esiste in natura: quindi deve essere sintetizzato in un reattore nucleare. Inoltre è dannatamente difficile far scontrare tra loro i due elementi.
ingrandirla.
Immagine gentilmente
concessa da Shape; fonte
dell’immagine: Wikimedia
Commons
“E’ estremamente difficile creare fasci di atomi di titanio. Per far questo, abbiamo segreti che non vogliamo condividere con altri” spiega il Professor Jon Petter Omtvedt, uno dei membri del team. “Bombarderemo il bersaglio con un flusso di 5 trilioni [5 x 1012] di atomi di titanio per secondo. La probabilità di uno scontro diretto (tra gli atomi) è molto bassa. Nelle rare occasioni in cui questa collisione avviene, gli atomi vengono dispersi o distrutti parzialmente nell’urto. Ma meno di una volta al mese riusciamo ad ottenere un atomo completo.”

del team Professor Christoph
Düllmann e Dr Alexander
Yakushev di fronte all’
apparecchiatura
sperimentale. Per mezzo di
un acceleratore di particelle,
ioni titanio sono accelerati ad
una velocità vicina a quella
della luce, dopodichè
vengono fatti passare
attraversoil tubo d’ argento
sulla sinistra e si scontrano
con un bersaglio di berkelio
(nel contenitore a strisce
gialle al centro); gli ioni di
ununennio risultanti vengono
separati dalle altre particelle,
dopodiché entrano nel
rivelatore, dove il loro
decadimento viene registrato.
Immagine gentilmente
concessa da G Otto / GSI
E’ come vincere alla lotteria comprando abbastanza biglietti da garantirsi la vincita. E’ un processo lento e inefficiente, ma è un gioco di numeri, e prima o poi ci si arriva.
Ma c’è un altro problema. Tutti gli elementi pesanti sono radioattivi: i loro atomi si spezzano in atomi più piccoli liberando radiazioni. Gli elementi più pesanti finora scoperti sono estremamente instabili. L’ununoctio (elemento 118) si decompone nel giro di millisecondi rispetto alla sua sintesi; l’ununennio potrebbe essere ancora più instabile.
Non sono pericolosi – le quantità sono così piccole che la dose di radiazioni è sicura. Ma è difficile studiare l’elemento appena sintetizzato: non puoi inserirlo in una provetta o riscaldarlo sopra un becco Bunsen, perché hai a disposizione un solo atomo alla volta e per una frazione di secondo.
La soluzione trovata dal team di ricerca è sintetizzare l’ununennio con un acceleratore di particelle, poi spararlo in un rilevatore e cercare le tracce della disintegrazione dei nuclei di ununennio – radiazioni e atomi risultanti dalla disintegrazione – piuttosto che gli stessi atomi di ununennio.
E’ una soluzione brillante, ma una delle ambizioni del team non potrà realizzarsi: quella di studiare come reagiscono gli atomi di questo esotico elemento. Ma questo probabilmente non sarà mai possibile, almeno non con le tecnologie a cui oggi possiamo pensare.
Ma se il tuo mestiere è creare nuovi elementi, vincendo di tanto in tanto il jackpot della lotteria, la parola “impossibile” potrebbe sembrare una sfida…
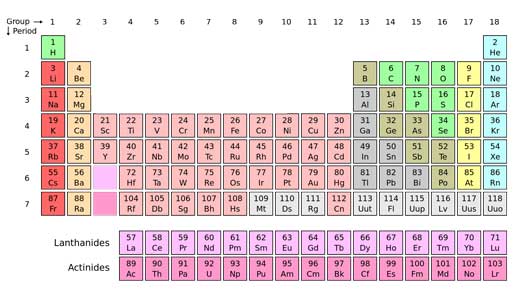
Immagine gentilmente concessa da NikNaks; fonte dell’immagine: Wikimedia Commons
Ringraziamenti
Gli editori di Science in School ringraziano il professor Christoph Düllmann del GSI Helmholtz Centre for Heavy Ion Research per il suo contributo a questo articolo.
Web References
- w1 – La International Union of Pure and Applied Chemistry (IUPAC) è l’ente che ufficialmente decide se un nuovo elemento è stato scoperto. La tavola periodica IUPAC include tutti gli elementi da 1 a 112, e gli elementi 114 e 116. Gli elemnti 113, 115, 116,117 e 118 non sono ufficialmente riconosciuti dalla IUPAC, anche se riferimenti alla scoperta di questi elementi sono presenti nella letteratura scientifica.
Resources
- Due comunicati stampa dell’Università di Oslo, Norvegia, forniscono maggiori informazioni sulla caccia all’ununennio:
- L’Università di Nottingham, UK, ha creato un sito web contenente video relativi a ciascun elemento della tavola periodica. Per una recensione del sito web, vedere:
-
Walsh M (2012) Review of the Periodic Table of Videos website. Science in School 24.
-
- Il sito web della UK’s Royal Society of Chemistry offre una versione interattiva della tavola periodica, con tutti i 118 elementi noti.
Review
Dopo un breve riassunto riguardante la nascita e lo sviluppo della tavola periodica, questo articolo prende in esame la ricerca in corso per scoprire nuovi elementi. Può essere usato nelle lezioni di chimica e di fisica, in particolare nello studio della chimica nucleare, della fisica atomica o della storia della scienza. Questo articolo può anche essere utilizzato per discutere il metodo scientifico, la velocità del progresso scientifico, le difficoltà incontrate dai ricercatori e l’utilità della ricerca di base.
La storia della scienza è un argomento che di rado viene affrontato nella scuola superiore, ma può essere molto utile per rendere la scienza più attraente per studenti, specielmente quelli più interessati alle materie umanistiche. Questo articolo può essere usato per mettere in luce i legami tra discipline scientifiche ed umanistiche.
Possibili domande di comprensione includono:
- Secondo gli Antichi Greci, quanti elementi esistevano?
- Cos è il numero atomico?
- Quanti elementi sono attualmente inseriti nella tavola periodica?
- Descrivi il metodo usato dal team per cercare di scoprire nuovi elementi. Quali sono i problemi relativi a questo metodo?
Mireia Güell Serra, Spagna





