L’ambiente intracellulare: acque non cosi’ torbide Understand article
Tradotto da Ilaria Ferlenghi. Giuseppe Zaccai, dell’Istituto Laue-Langevin (ILL), in Grenoble, Francia, descrive come lui e i suoi collaboratori hanno svelato un modo di esplorare le dinamiche dell’acqua all’interno della cellula usando dispersione di neutroni e marcatura con isotopi.

Immagine gentilmente
concessa da EdwardShtern /
iStockphoto
Paragonata ad altri liquidi l’acqua ha proprieta’ straordinarie. Cosi’ come l’acqua e’ essenziale per tutti gli esseri viventi, anche le sue proprieta’ giocano un ruolo fondamentale a livello della biologia molecolare- una disciplina che cerca di comprendere i processi vitali a livello degli atomi, delle molecole e delle loro interazioni.
L’effetto idrofobico e’ una di queste proprieta’. Esso descrive l’osservazione che, in una soluzione liquida acqua ed olio non si mescolano. Il motivo e’ che le molecole di acqua possono formare legami a idrogeno tra di loro e con altre molecole (dette idrofiliche), ma non con molecole simil-olio (dette idrofobiche) (per maggiori informazioni riguardo questo argomento vedi Cicognani, 2006). Cio’ ha conseguenze fondamentali nella biologia molecolare. L’effetto idrofobico guida la spontanea organizzazione delle molecole lipidiche nel formare le membrane che circondano le cellule. Contribuisce inoltre alla formazione della struttura tridimensionale delle proteina, dell’RNA e del DNA, favorendo il loro ripiegamento sia nascondendo le parti idrofobiche delle loro strutture dal contatto con l’acqua e sia esponendo le loro parti idrofiliche.

Zaccai at ILL
Immagine gentilmente
concessa da Giuseppe Zaccai
L’effetto idrofilico, cosi’ come viene inteso, dipende in modo critico dalle peculiari proprieta’dinamiche delle molecole dell’acqua liquida. L’implicazione di questo effetto nella formazione delle membrane e il ripiegamento macromolecolare e’ stato dedotto da esperimenti in provetta su soluzioni nelle quali l’acqua e’ chiaramente allo stato liquido. Ci sono stati suggerimenti che l’acqua, comunque, non sia nel suo stato liquido normale, ma che sia in qualche modo “addomesticata” e non si possa muovere liberamente all’interno del viscoso ambiente intracellulare, un denso brodo di proteine ed altre molecole.
E’ stato quindi molto importante misurare lo stato dinamico dell’acqua direttamente nelle cellule vive. Non e’ stato un compito facile, ma le speciali proprieta’ dei neutroni hanno aiutato gli scienziati del mio gruppo di ricerca presso l’ILLw1, cosi’ come i ricercatori presso l’Istituto di Biologia strutturale CEA-CNRS-UJFw2,a Grenoble, Francia, ad affrontare tale compito con successo.

Haloarcula marismortui
deuterata. Notare il colore
rosso degli organismi alofili,
che in ambienti naturali
colora i laghi salati e stagni
salati. E ‘a causa di
carotenoidi nelle membrane
delle cellule, che entrano
nella catena alimentare e
sono altresì responsabili, per
esempio, per il colore dei
fenicotteri rosa
Immagine gentilmente
concessa da Giuseppe Zaccai
Il primo esperimento sulle dinamiche dell’acqua applicator a cellule vive fu eseguito all’ILL su cellule di organismi che vivono nelle condizioni saline molto elevate del Mar Morto (Tehei et al., 2007). Il sale e’ utilizzato come conservante perche’ ad alte concentrazioni uccide i microorganismi. Gli organismi alofilici (amanti del sale) del Mar Morto si sono evoluti per resistere alle altissime concentrazioni saline producendo macromolecole con una marcato aumento delle superfici idrofili che. Tali superfici alterano le dinamiche dell’acqua all’interno della cellula, portando alla osservazione di una componente di “acqua lenta” che prevale nelle cellule del Mar Morto.
Chiaramente, se cio’ fosse vero per tutti gli organismi, porterebbe a una totale rivisitazione non solo dell’effetto idrofobico, ma anche piu’ in generale del ruolo dell’acqua nella biologia. E’ stato quindi essenziale valutare se questo comportamento fosse particolare negli organismi alofilici o se potesse essere generalizzato (Jasnin et al., 2008).
Presso l’ILL, gli scienziati usano i raggi a neutroni per investigare diversi materiali solidi e liquidi. Negli esperimenti di spettrometria a neuroni per misurare la dinamica (come gli atomi si muovono in un materiale, i neutroni del raggio si scontrano con gli atomi sotto studio, come le palle da bigliardo che si scontrano l’una con l’altra. I neutroni e gli atomi si scambiano energia e il momento, i neutroni sono dispersi. Di conseguenza, misurando l’entita’ di questi scambi di energia dei neutroni dopo la collisione ci da una indicazione dell’energia e del momento degli atomi coi quali si sono scontrati e di conseguenza come questi atomi si muovono.
Ma come possiamo distinguere tra di loro I movimenti dei diversi atomi presenti in un campione complesso, quale una cellula che contiene non solo acqua ma anche moltre alter molecule I cui atomi si muovono in diversi modi? I neutroni sono sparpagliati con diverse energie dai diversi atomi. Per studiare sistemi complessi, gli scienziati usanp un trucco per ridurre il potere di sparpagliamento di tutto cio’ che non vogliono misurare. L’idrogeno sparpaglia i neutroni con maggior forza rispetto a qualsiasi altro tipo di atomo ( circa 10-100 volte maggiore, in funzione a quale tipo di atomo viene paragonato). Al contrario, il deuterio, un isotopo pesante dell’idrogeno (il suo nucleo contiene un neutrone oltre a un protone), sparpaglia i neutroni con una forza circa 40 volte inferiore all’idrogeno. Sfruttando questa proprieta, gli scienziati hanno sostituito l’idrogeno al deuterio nei componenti di un sistema complesso ai quali non sono interessati rendendoli cosi’ praticamente “invisibili”. I contributi ai segnali di sparpagliamento da parte delle molecole che contengono deuterio sono trascurabili; sono “visibili” solo i movimenti delle molecole che contengono idrogeno.

un campione sull’asta
criostatata dello
spettrometro IN6. Il criostato
controlla la temperatura del
campione durante la raccolta
dei dati. Il campione è nella
scatola di alluminio piatto
alla fine dell’asta. I dischi
sull’asta sono deflettori per
aiutare a mantenere costante
la temperatura nella parte
inferiore della cortesia
criostato
Immagine gentilmente
concessa da Giuseppe Zaccai
Marion Jasnin e I suoi collaboratori hanno usato questo trucco per analizzare le dinamiche dell’acqua in vivo nel citoplasma dei batteri di Escherichia coli, sfruttando le sorgenti di neutroni all’ILL e ISISw3, UK. Studiare la fisica con i campioni biologici è sempre un compito difficile, e le cellule umane sono strutture molto delicate e complesse con cui lavorare. Batteri di E. coli sono stati una buona alternativa in quanto sono più facili da gestire, in grado di vivere nell’intestino umano in analoghe condizioni fisiologiche di temperatura e salinità, come le nostre cellule, e ricordate, l’adeguamento del citoplasma all’alta salinità si crede possa essere stata la causa dell’acqua ‘rallentata’ negli alofili.
Per sostituire gli atomi di idrogeno nelle proteine e altre macromolecole cellulari col deuterio, cellule di E. coli sono state coltivate su nutrienti deuterati e accqua deuterata (pesante). Per i rilievi, sono stati poi centrifugati delicatamente e l’acqua pesante è stata sostituita con normale acqua (contenente idrogeno), diluendo l’acqua intracellulare contenente deuterio, ma non il deuterio nelle macromolecole. In tale campione, dopo la diluizione, il segnale di scattering dei neutroni proviene principalmente dall’ acqua intracellulare. Il pellet di cellule viventi è stato posto in un supporto del campione di alluminio. L’alluminio, come tutti i metalli, è trasparente ai neutroni – anche se ovviamente non alla luce o raggi-X.
L’energia dei neutroni e il momento sono determinati prima e dopo lo scattering misurando la loro lunghezza d’onda (nell’intervallo di Ångström). I due metodi principali utilizzati per fare questo (a seconda dello spettrometro) sono il ‘tempo di volo’, in cui la velocità dei neutroni (inversamente proporzionale alla lunghezza d’onda, la velocità è nell’intervallo dei km / s per lunghezze d’onda in Ångström) è misurata su un determinato percorso, e mediante diffrazione dei cristalli (secondo la legge di Bragg, solo una certa lunghezza d’onda è diffratta per una certa periodicità di cristallo, e di impostazione angolare – leggere di più su questa legge in Hughes, 2007 e Cornuéjols, 2009). Per saperne di più su questi metodi onlinew4.
Il calore movimento: la velocità alla quale gli atomi si muovono dentro un materiale dipende dalla temperatura. Tuttavia, gli atomi in un materiale possono anche muoversi a velocità diverse alla stessa temperatura, a seconda di come essi sono legati ad altri atomi che li circondano: e’ noto che le molecole di acqua vengono rallentate da un contatto diretto con le macromolecole quali le proteine o DNA. La domanda che gli scienziati si sono posti è stata: le molecole d’acqua,presenti nelle cellule, che non sono in contatto diretto con le macromolecole si muovono cosi’ come farebbero normalmente in acqua liquida, o sono, anche esse, significativamente rallentate?
Ogni spettrometro a neutroni è specializzato per la misurazione di movimenti atomici che si verificano entro una determinata finestra di lunghezza tempo-dipendente. Fondamentalmente ci sono tre tipi: quelli che misurano nella gamma di circa 1Ångström di ampiezza che si verificano in circa 1 picosecondo (10-12 s), che corrisponde al moto termico degli atomi di idrogeno in acqua allo stato liquido a temperatura ambiente (da notare che questo corrisponde a una velocità di circa 100 m / s), quelli che misurano nella gamma di ampiezze di 1-10 Ångström in un nanosecondo (10-9 s), che registra molecole ‘rallentate’ di acqua, e un tipo intermedio per la gamma di 1-10 Ångström di ampiezza in 100 picosecondi.
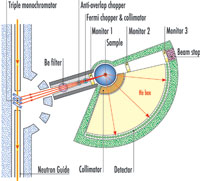
di neutroni a IN6 ILL. Cliccare
sull’immagine per ingrandirla
Immagine gentilmente
concessa da ILL
Utilizzando uno spettrometro a picosecondo e ananosecondo, Marion Jasnin e suoi collaboratori hanno stabilito che le dinamiche dell’ acqua all’interno di una cellula batterica sono simili a quelle in acqua pura. Le molecole di acqua ruotano come vengono diffuse linearmente nel liquido, e una leggera riduzione della rotazione di diffusione è stata misurata. Dalla frazione di atomi di idrogeno che si muovevano più lentamente e dalla superficie media delle macromolecole all’interno di una cellula di E. coli, gli scienziati hanno calcolato che questa quota corrisponde ad un unico strato di molecole d’acqua accanto alle macromolecole che è rallentato, ma il resto scorre liberamente come in acqua liquida.
Quello che succede all’interno della cellula, quindi, è simile a quello che si trova intorno alle isole della laguna di Venezia in Italia. L’acqua vicina alle macromolecole (isole), e’ trattenuta, mentre tra di esse – tanto sottile quanto uno strato di molecole di acqua delle macromolecole – l’acqua riacquista la sua fluidità. Questo è in contrasto con l’ipotesi di ‘addomesticamento’ che ha affermato che tutta l’acqua nella cellula sarebbe rallentata.
Sulla scia degli esperimenti su E. coli, il gruppo e’ ora anche riuscito a esplorare le dinamiche dell’acqua in globuli rossi umani presso le sorgenti di neutroni in Germania (FRM IIw5) e Svizzera (PSIw6). Lo stesso comportamento di E. coli è stato confermato, con acqua allo stato liquido che fluisce liberamente al di là del primo strato che è in contatto con l’emoglobina, la proteina principale contenuta in queste cellule (Stadler et al., 2009).
Gli scienziati possono tirare un sospiro di sollievo – e continuare a fare i loro esperimenti in soluzioni di acqua allo stato liquido, grazie a questa conferma che tali esperimenti siano un valido modello per ciò che accade nelle cellule.
References
- Cicognani G (2006): Defying the laws of physics? Science in School 1: 19-21. www.scienceinschool.org/2006/issue1/defying
- Cornuéjols D (2009): Biological crystals: at the interface between physics, chemistry and biology. Science in School 11: 70-76. www.scienceinschool.org/2009/issue11/crystallography
- Hughes D (2007) Taking the stress out of engineering. Science in School 5: 61-65. www.scienceinschool.org/2007/issue5/stress
- Jasnin M, Moulin M, Haertlein M, Zaccai G, Tehei M (2008) Down to atomic-scale intracellular water dynamics. EMBO Reports 9: 543-547. doi:10.1038/embor.2008.50
- Stadler AM, Embs JP, Digel I, Artmann GM, Unruh T, Buldt G, Zaccai G (2008) Cytoplasmic water and hydration layer dynamics in human red blood cells. Journal of the American Chemical Society 130: 16852-16853. doi:10.1021/ja807691j
- Tehei M, Franzetti B, Wood K, Gabel F, Fabiani E, Jasnin M, Zamponi M, Oesterhelt D, Zaccai G, Ginzburg M, Ginzburg BZ (2007) Neutron scattering reveals extremely slow cell water in a Dead Sea organism. Proceedings of the National Academy of Sciences of the United States of America 104: 766-771. doi:10.1073/pnas.0601639104
Web References
- w1 – Per apprendere di piu’ sull’Istituto Laue-Langevin, vedi: www.ill.eu
- w2 – Per ottenere maggiori informazioni sull’Institut de Biologie Structurale CEA-CNRS-UJF, vedi: www.ibs.fr
- w3 – Per apprendere di piu’ su ISIS, la sorgente di neutroni pulsate e muoni con sede in UK Rutherford Appleton Laboratory vicino Oxford, vedi: www.isis.rl.ac.uk
- w4 – Per maggiori informazioni sulla diffrazione a neutroni e time-of-flight e tecniche di diffrazione dei cristalli, vedi i seguenti link diretti alle pagine di Wikipedia:
- http://tinyurl.com/yh436y4 per diffrazione a neutroni
- http://tinyurl.com/ykywxht per la dispersione dei neutroni inelastici
- http://tinyurl.com/yj4bnrf per il time-of-flight
- http://tinyurl.com/yfho9gz per diffrazione dei cristalli.
- w5 – Per saperne di più sulla ricerca tedesca sulla fonte di neutroni FRM II (Forschungs-Neutronenquelle Heinz Maier-Leibnitz) a Monaco di Baviera qui: www.frm2.tum.de
- w6 – Per saperne di piu’ sul Paul Scherrer Institute a Villingen, Svizzera, vedi: www.psi.ch
Resources
- Per il ritratto di un giovane ricercatore che lavora su alofili, vedi:Leigh V (2008) Sale della Terra. Science in School 8. www.scienceinschool.org/2008/issue8/prudencemutowo/italian
Institutions
Review
Molto è stato fatto per scienza nella scuola per quel che riguarda il processo scientifico, eppure i nostri studenti di solito non sono molto esposti alla ricerca d’avanguardia nel campo della scienza, o allo stile di scrittura usato in riviste accademiche. Le ragioni di questa distanza sono di poca rilevanza per la scienza a scuola, e lo stile spesso impenetrabile di prosa accademica.
Queste critiche non si applicano all’articolo di Zaccai, che risponde all’importante domanda “come sappiamo?”. Mentre il comportamento delle molecole in vitro puo’ essere ben studiato e compreso, è spesso oggetto di congetture quanto di questo riproduce il comportamento in vivo. L’articolo suggerisce che l’acqua, almeno, non si comporta diversamente, e il testo è di interesse per docenti e studenti più grandi della biologia, della fisica o della chimica, in particolare come vi sia una natura interdisciplinare per gli studi riportati.
Possibili domande di comprensione includono:
- Spiega l’analogia che corre tra la laguna di Venezia e l’acqua intracellulare.
- Quali unità non-SI (s) si raccolglie (raccolgono) dall’articolo? Esprimere questo / i in unità SI.
- Che cosa vuol dire “deuterazione”?
- Perche’ E.coli e’ stato un buon soggetto per gli esprimenti?
- Classifica alcuni dei materiali citati in ordine alla loro capacità di disperdere neutroni.
- Definisci “idrofobico” e “idrofilico”.
- Come sono rese ‘invisibili’ le molecole al fascio di neutroni?
- Che conclusione puo’ essere dedotta dal lavoro descritto nell’articolo?
Ian Francis, UK





