Fusione nell’universo: da dove arrivano i vostri gioielli Understand article
Traduzione di Lucilla Croce Ferri. L’alchimia sembra troppo bella per essere vera? Paola Rebusco, Henri Boffin e Douglas Pierce-Price, dall’ESO a Garching, Germania, descrivono come sia possibile creare oro e altri metalli pesanti, anche se purtroppo non in laboratorio.
Come si sono formati gli elementi pesanti? L’ultimo episodio della saga “Fusione nell’Universo” (Boffin & Pierce-Price, 2007) finiva con la produzione di ferro, ma l’avventura di sintesi nucleare, in cui si creano i nuclei atomici, non si ferma qui. Rinfreschiamoci la memoria. Nei primi minuti dopo il Big Bang, la temperatura dell’Universo neonato si raffredò (fino a pochi miliardi di gradi!) permettendo la formazione di idrogeno ed elio. Le stelle passano la maggior parte della loro vita trasformando idrogeno in elio. Solo quando la temperatura e la pressione diventano alte abbastanza, gli atomi di elio cominciano a fondere, formando nuovi elementi. Gli elementi più eleggeri si fondono successivamente insieme per produrre gli elementi più pesanti, fino al ferro 56.
Il ferro 56 ha il nucleo più stabile perchè ha la maggior energia di legame nucleare (vedi riquadro e diagramma). La natura favorisce configurazioni stabili e perciò il processo di fusione, descritto nel nostro ultimo articolo, che ci porta dall’idrogeno fino a nuclei più pesanti e più stabili, non continuerà oltre il ferro 56. Perciò, da dove arrivano gli elementi più pesanti come il piombo, l’argento, l’oro e l’uranio?Non c’è magia: l’Universo ha altri modi affiscinanti per produrre tutti gli elementi pesanti. Nell’alta temperatura e alta pressione di una stella, la fusione avviene spontameamente come rotolare giù da una collina (un processo che rilascia energia). Tuttavia, questi nuovi meccanismi sono più laboriosi che scalare una collina (un meccanismo che richiede energia). Inoltre gli stadi successivi di sintesi nucleare sono piuttosto frenetici, in quanto coinvolgono catture ed esplosioni. Tre tipi di cattura sono coinvolti, due aventi a che fare con la cattura di neutroni (i processi s e r) e uno con la cattura di protoni (il processo p).
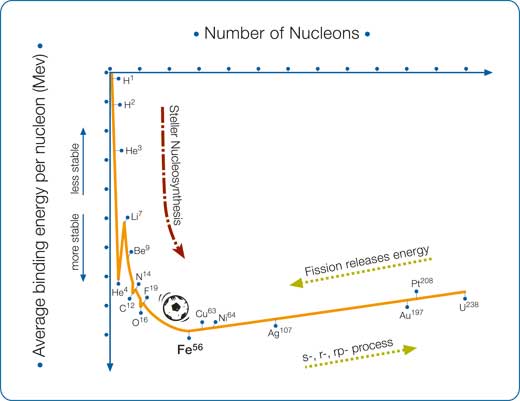
Immagine cortesemente messa a disposizione da Mafalda Martins, ESO
La cattura neutronica
Un modo per creare elementi più pesanti del ferro 56 inizia quando neutroni extra collidono e si fondono con un nucleo esistente. In questo modo otteniamo nuclei arrichiti di neutroni e più pesanti ma con lo stesso numero di protoni o lo stesso numero atomico. Questi nuclei sono semplicemente isotopi più pesanti dell’elemento originale, per cui non abbiamo ancora raggiunto il nostro scopo di creare elementi più peanti ma differenti.
Tuttavia, il processo non è ancora finito. Questi nuovi isotopi possono essere stabili o instabili, a seconda del loro numero di protoni e neutroni. Se la cattura neutronica produce un isotopo instabile, allora può avvenire un decadimento radioattivo spontaneo. Un tale decadimento è un “decadimento beta” in cui vengono emessi un elettrone e un anti-neutrino, così che uno dei neutroni del nucleo si converte in un protone. Il risultato di questa conversione è un nucleo con un protone in più e alcuni neutroni in meno. Siccome il numero di protoni è cambiato, questo processo ha prodotto un nuovo e differente elemento.
In questo processo di cattura neutronica seguito da un decadimento beta, è importante se la cattura iniziale del neutrone è lenta o veloce, relativamente al decadimento beta. I due casi, riferiti rispettivamente come il processo s e il processo r, producono differenti elementi e avvengono in circostanze diverse nell’Universo.
La cattura neutronica lenta: il processo s
Ogni cattura neutronica nel processo s converte un nucleo in un isotopo dello stesso elemento con un neutrone in più. Alla fine, questi singoli aumenti del numero di neutroni portano ad un isotopo instabile. Siccome la cattura neutronica è relativamente lenta nel processo s, il nucleo instabile decade con un decadimento beta prima che un altro neutrone possa venir catturato. In altre parole, appena la prima configurazione instabile è raggiunta, un decadimento beta cambia il nucleo in uno con un protone in più e un neutrone in meno (vedi diagramma).
Dove possiamo trovare le giuste condizioni nell’Universo affinchè avvenga il processo s? Risulta che esso può avvenire durante le ultime fasi della vita di stelle simili al Sole. Noi già sappiamo (vedi per esempio Boffin & Pierce-Price 2007) che se la massa iniziale di una stella è paragonabile a quella del Sole, allora alla fine della vita la stella non ha più combustibile e si raffredda per diventare una nana bianca. Prima che si raffreddi, vengono prodotti neutroni liberi (principalmente dal decadimento del carbanio e neon): sono abbondanti abbastanza per produrre elementi più pesanti attraverso la cattura lenta neutronica. In questo modo, sono prodotti elementi come il bario, il rame, l’osmio, lo stronzio, e il tecnezio.
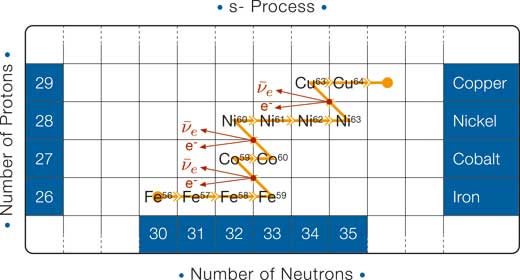
Immagine cortesemente concessa da Mafalda Martins, ESO
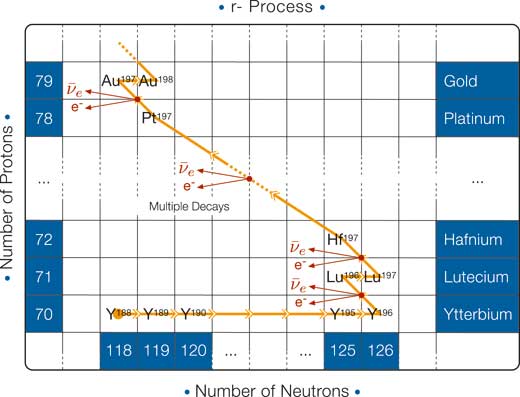
Immagine cortesemente concessa da Mafalda Martins, ESO
La cattura neutronica veloce: il processo r
Se invece i neutroni sono prodotti ad alta velocità, allora i nuclei instabili che si sono formati hanno abbastanza tempo per inglobare molti neutroni che decadono successivamente a cascata in protoni (vedi diagramma): questo è come vengono sintetizzati in natura gli elementi coi numeri atomici più alti.
Scopriamo dove ha luogo nell’Universo il processo r. Come discusso nell’articolo precedente, quando la massa di una stella è più grande di circa otto masse solari, la temperatura e la pressione nel suo centro divengono abbastanza alte per innescare la fusione del carbonio ed ossigeno e per formare un nucleo di ferro. Nella fase finale, l’interno di una stella è molto simile ad una cipolla (vedi diagramma): la parte più esterna è composta da idrogeno ed elio, mentre gli strati più interni consistono di nuclei progressivamente più pesanti, per le successive reazioni di fusione.
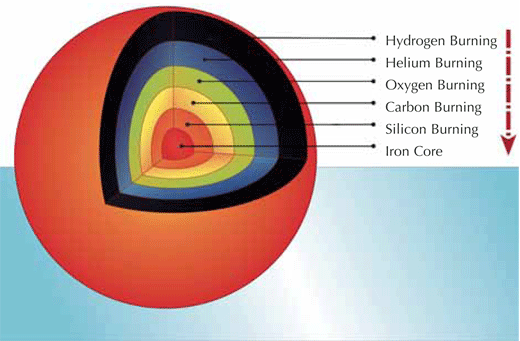
Immagine cortesemente concessa da Mafalda Martins, ESO
Il ferro è troppo stabile per bruciare, perciò si accumula e il nucleo di ferro continua ad aumentare. Tuttavia c’è una massa limite (chiamata il limite di Chandrasekhar) oltre la quale il nucleo ferroso non può più crescere, in quanto la sua gravità diventa troppo forte. A questo punto un collasso catastrofico contrae il nucleo (con gli strati più esterni del nucleo che raggiungono velocità fino a 250 milioni km/h), fino a quando la materia collassante rimbalza e tutta l’energia è trasferita agli strati più esterni in una esplosione titanica (vedi immagine). Questo fenomeno è chiamato un’esplosione di supernova, più precisamente una supernova di tipo II (SN II).

Immagine cortesemente concessa da Mafalda Martins, ESO
È nel nucleo ferroso di una SN II che collassa che avviene il processo r. Durante il collasso, elettroni e protoni si fondono per produrre neutroni e neutrini. Il flusso (il numero per unità di tempo e di area) di neutroni è così altro (dell’ordine di 1022 neutroni per cm2/s) che il nucleo ha tempo di catturare molti neutroni prima che avvenga il decadimento beta. L’oro, l’europio, il lantanio, il polonio, il torio e l’uranio sono alcuni degli elementi prodotti attraverso il processo r.
Cattura protonica
Un altro processo nel quale vengono prodotti nuclei più pesanti è quello via cattura di protoni (processo p). Tuttavia un nucleo grande che contiene molti protoni ha una carica positiva elevata, che respinge ulteriori protoni in avvicinamento. Questa repulsione (la barriera di Coulomb) è molto alta e fa in modo che la cattura protonica sia un evento molto più raro che non la cattura neutronica. Per essere assorbito dal nucleo, un protone libero deve essere molto energetico, per cui questo processo avviene solo a temperature molto alte.
Dove possiamo trovare temperature abbastanza elevate per la cattura protonica? Diamo di nuovo un’occhiata alle stelle. Benchè il nostro sistena solare ha solo una stella, il Sole, un gran numero di stelle si trova in sistemi con almeno due stelle. Quando due stelle orbitano una attorno all’altra, formano un “sistema binario”. Se le stelle sono abbastastanza vicine, è possibile per una stella con una grande attrazione gravitazione “rubare” gas alla sua stella compagna. Questo può accadere, per esempio, quando una stella massiccia, una stella nana compatta o una stella di neutroni, attira verso la sua superficie gas ricco di idrogeno proveniente dalla compagna. Questo materiale fornisce un flusso di protoni liberi, caldi ed energetici abbastanza per superare la barriera di Coulomb e fondersi con altri nuclei. Lantanio, rutenio e samario sono elementi tipici prodotti nel processo p.
Conclusione
Abbiamo visto come gli elementi più pesanti sono prodotti per mezzo di vari processi, nonostante la fusione nucleare nelle stelle produca elementi solo fino al ferro 56. Questi processi di nucleosistesi, che involvono la cattura di neutroni o protoni e decadimenti radiottivi, avvengono in situazioni esotiche nell’Universo. La cattura lenta neutronica può avvenire nella fase finale di stelle simili al Sole, prima che finiscano la loro vita come nane bianche. La cattura protonica è il risultato dell`inglobamento di gas proveniente da una sfortunata stella compagna da parte di una nana bianca o una stella di neutroni. E la cattura neutronica veloce avviene durante il collasso stellare catastrofico che avviene poco prima della drammatica esplosione di una supernova di tipo II. Trasformando un elemento in un altro, questi affascinanti processi naturali ottengono quello che gli alchimisti medioevali non riuscirono a raggiungere: la trasformazione di metalli di base in oro (e in altri elementi).
Nonostante ciò, noi non possiamo biasimare gli alchimisti. I loro laboratori potevano essere ben equipaggiati, ma gli mancava un pezzo chiave: una esplosione di supernova.
Il mistero della massa scomparsas
L’energia di legame nucleare è la quantità di energia necessaria per spaccare un nucleo in protoni e neutroni. È anche l’energia che rilasciano due particelle quando si fondono. Immaginiamo di aver un protone ed un neutrone e che abbiano la stessa massa (un’ approssimazione molto buona). Spingiamoli insieme fino a quando non si uniscono per formare un nucleo di deuterio. Qual è la sua massa? Se il protone ha massa 1 e il neutrone ha massa 1, ci si aspetterebbe 2, vero? Non è così: la massa di un nucleo di deuterio è inferiore alla somma delle due masse; è sparita della massa! La soluzione si trova nella famosa equazione di Einstein, E = mc2. Quando due particelle si uniscono, rilasciano l’energia di legame nucleare EB, ma siccome energia e massa sono equivalenti, questo significa che la massa corrispondente mB= EB/c2 va persa.
Consideriamo prima l’elio 4 e poi il ferro 56. In unità di massa atomica (u = 1.66 x 10-27 kg = 931.5 MeV/c2) le masse di un protone e di un neutrone sono rispettivamente mP = 1.00728 u e mn = 1.00866 u. La massa misurata di un nucleo di elio 4 è mHe = 4.00150 u, mentre la somma della massa delle sue componenti è 2mP + 2mn = 4.03188. La differenza dà la massa 4.03188 u – 4.00150 u = 0.03038 u, che corrisponde all’energia totale di legame di approssimativamente 28.3 MeV (l’energia di legame per nucleone è 28.3/(2 + 2) = 7.07 MeV).
Se ripetete gli stessi passi per il ferro 56 (che consiste die 26 protoni e 30 neutroni), l’energia totale di legame è molto più grande: circa 492.2 MeV, o 8.79 MeV per nucleone. Questa stabilità estrema mette il ferro 56 nel punto più basso della curva nel grafico dell’energia di legame, e la fusione ad elementi più pesanti sarebbe un processo “in salita”, che richiede l’immissione di energia. Questo è il motivo per cui ci vogliono processi più estremi (descritti in questo articolo) per produrre elementi più pesanti del ferro 56, nonostante i nuclei di elio 4 passano essere fusi in elementi più pesanti.
Margaret Burbidge e la squadra B2HF
I meccanismi dietro la produzione degli elementi più pesanti (il processo s e il processo r) furono messi in evidenza in un lungo articolo teorico, pubblicato nel 1957: “Sintesi degli elementi in una stella” (Burbidge et al., 1957). Questo articolo rivoluzionario e ancora attuale è firmato B2HF, che non è uno strano composto chimico ma le iniziali dei cognomi degli scienziati che lo scrissero: Margaret Burbidge, Geoffrey Burbidge, William Fowler e Fred Hoyle.
L’astronoma inglese Margaret Burbidge naque nel 1919 ed è ancora attiva nella ricerca, come professore emerito di fisica all’Università di California, San Diego, USA. Quando era una ragazza, suo nonno le diede libri divulgativi sull’astronomia: “Vidi nascere la mia passione per le stelle all’età di 4 anni”, scrive nella sua autobiografia (Burbidge, 1994), “unita all’altro mio diletto, i grandi numeri”. La sua vita è stata piena di scoperte scientifiche e battaglie politiche, non è sempre stato facile essere una scienziata donna, ma lei non ha mai ceduto. “Se incontri un ostacolo, trova un modo per aggirarlo”, suggerisce Il resto del gruppo non è da meno: Fred Hoyle e il marito di Margaret, Geoffrey Burbidge, sono famosi per le loro teorie iconoclastiche che si oppongono alla teoria del Big Bang, mentre William Fowler condivise il Premio Nobel per la fisica nel 1983 per i suoi studi teorici e sperimentali sulla nucleosintesi.
References
- Boffin H, Pierce-Price D (2007) La fusione nell?universo: siamo tutti polvere di stelle. Science in School 4.
- Burbidge EM, Burbidge GR, Fowler WA, Hoyle F (1957) Synthesis of the elements in stars. Reviews of Modern Physics 29: 547-650
- Burbidge EM (1994) Watcher of the skies. Annual Review of Astronomy and Astrophysics 32: 1-36
Resources
- Per scoprire quando e dove è scoppiata l’ultima supernova, vedi il sito delle supernove, dove scienziati e appassionati vanno a caccia delle nuove esplosioni di supernova e le registrano: www.supernovae.net





