Supporting materials
Download
Download this article as a PDF

Le thé est une boisson rafraîchissante - et peut également aider les élèves à en apprendre davantage sur d’importantes réactions chimiques, comme le montrent ces simples expériences à base d’infusions.
Les thés, y compris les thés noirs, aux herbes et aux fruits, sont des boissons populaires et se déclinent en un large éventail de variétés, le tout assorti d’une impressionnante variété de couleurs une fois brassées. Comme beaucoup de gens l’auront remarqué, l’ajout de substances au thé peut changer sa couleur – et un changement de couleur peut indiquer un changement chimique.
Dans cet article, nous examinons de plus près certaines réactions chimiques – réactions acide-base, réduction / oxydation et formation de complexes – qui peuvent être étudiées en utilisant des expériences simples et sûres à base de thés.

Le thé est fabriqué par infusion: une méthode physique d’extraction au cours de laquelle des composés chimiques, tels que des huiles et des composés organiques volatils, se dissolvent dans l’infusion. Lorsque l’on utilise des sachets de thé, la matière végétale formant le matériau pour infusion ne peut traverser le sachet. Les particules plus petites et les composés qui provoquent la couleur et la saveur, en revanche, peuvent le faire. Ainsi, le sachet de thé agit comme une membrane partiellement perméable.
Traditionnellement, le terme «thé» désignait un produit obtenu en récoltant des feuilles de théier (Camellia sinensis) qui étaient ensuite transformées ultérieurement. Ce produit est maintenant souvent appelé «thé noir», en raison de son aspect avant infusion. (Ceci est différent du thé servi sans lait, qui est parfois aussi connu sous le nom de thé noir.) Aujourd’hui, cependant, de nombreux matériaux dérivés de plantes sont commercialisés sous forme de thés. Dans cet article, nous utilisons donc le terme de «thé» pour tous ces produits, et le terme de «thé noir» pour désigner spécifiquement le thé traditionnel.
Nous avons conçu les activités suivantes à base de thé pour les élèves âgés de 14 à 19 ans. Elles conviennent également aux enfants de 11 à 14 ans en parlant moins de la théorie derrière les réactions chimiques. Les activités peuvent être réalisées en une seule leçon (environ 60 minutes), et nous recommandons aux élèves de travailler en groupes de 3 à 4. En option, les élèves peuvent utiliser la fonction vidéo sur leur téléphone portable pour enregistrer et revoir les changements qu’ils voient.
Les infusions doivent être préparées au début de la leçon et laisser refroidir à température ambiante avant que les activités ne soient effectuées. Une introduction aux activités pourra alors être dispensée pendant que les infusions refroidissent. Les infusions suivantes doivent être préparées:
Dans cette activité, nous explorons les changements de couleur qui se produisent lorsqu’un acide et une base sont ajoutés à une infusion de couleur bleue frappante de thé aux fleurs de pois papillon.
Pour l’enseignement à distance, cette activité pourrait être réalisée par des élèves plus âgés à la maison. Dans ce cas, de petits verres ou des coupelles blanches peuvent être utilisés à la place des tubes à essai, et l’hydrogénocarbonate de sodium doit être utilisé à la place de l’hydroxyde d’ammonium car il est plus sûr à manipuler, bien que le changement de couleur soit moins frappant.
To prepare this activity, each group requires: De facon à être prêt pour cette activité, chaque groupe a besoin:
Les élèves pourront suivre les étapes suivantes en groupe:
Discutez des questions suivantes avec vos élèves:
Pendant cette activité, les élèves devraient voir les changements de couleur suivants (voir figure 1) :
Ces changements de couleur se produisent parce que le thé aux fleurs de pois papillon contient des molécules appelées anthocyanes (voir encadré). Ces molécules modifient la longueur d’onde de la lumière qu’elles absorbent, et donc leur couleur, en fonction du pH de la solution dans laquelle elles se trouvent. Le jus de citron contient de l’acide citrique et d’autres acides, donc l’ajouter au thé produit une solution plus acide (pH plus bas) et un changement de couleur visible. L’ajout d’une base faible telle que l’hydroxyde d’ammonium ou l’hydrogénocarbonate de sodium diminue le nombre d’ions hydrogène, ce qui entraîne une acidité plus faible (valeur de pH plus élevée) et un autre changement de couleur.

Les anthocyanes sont un groupe de pigments hydrosolubles responsables de la coloration rouge, bleue ou violette de nombreuses fleurs, fruits (y compris les myrtilles et les framboises) et légumes (comme le chou rouge). [1] Ces pigments sont également en partie responsables des couleurs des feuilles d’automne.
La région de ces molécules de pigment qui produit la couleur est appelée le chromophore. Dans la région chromophore, la différence d’énergie entre deux orbitales moléculaires se situe dans la gamme du spectre de la lumière visible. L’ajout d’un ion hydrogène à un chromophore peut modifier sa longueur d’onde d’absorbance, et donc sa couleur. Étant donné que l’acidité d’une solution (ou la valeur du pH) dépend de la concentration d’ions hydrogène, les chromophores – et la matière végétale qui les contient – agissent potentiellement comme des indicateurs naturels d’acide-base.
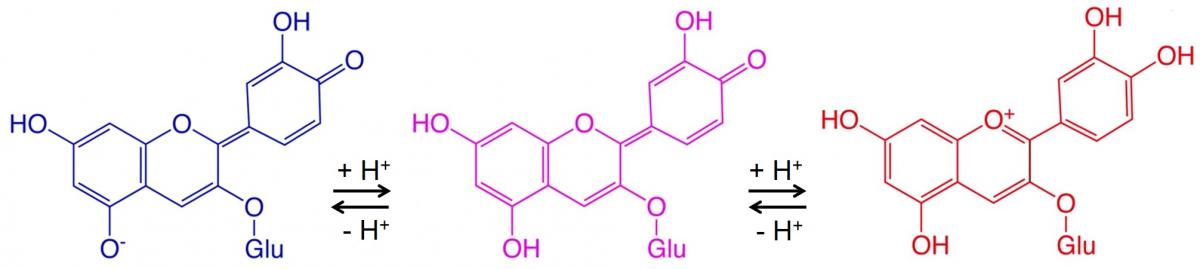
Il existe de nombreux exemples de changement de couleur dû aux anthocyanes et autres colorants végétaux et leur sensibilité au pH. La figure 2 montre un exemple.
Ici, deux réactions réversibles, impliquant chacune l’ajout d’un ion hydrogène à la molécule, provoquent un changement de couleur à chaque étape. Les conditions acides (pH bas) conduisent les réactions réversibles vers la droite (bleu vers rouge), tandis que les conditions basiques (pH élevé) conduisent les réactions réversibles vers la gauche (rouge vers bleu).
Cette expérience utilise une solution contenant des ions de fer (III) pour produire un changement de couleur indiquant la présence de polyphénols tels que les tanins dans le thé. La solution doit être préparée par l’enseignant avant le cours en dissolvant une cuillère à café de chlorure de fer (III) hexahydraté dans 50 ml d’eau. Alternativement, un récureur en acier ou de la laine d’acier peut être utilisé, bien que dans ces cas le changement de couleur soit plus lent. Lors de l’utilisation de la solution de fer (III), elle est instantanée.
Chaque groupe d’étudiants aura besoin du matériel suivant:
Les élèves pourront suivre les étapes suivantes en groupe:
Discutez des questions suivantes avec vos élèves pour mieux comprendre certains concepts clefs:
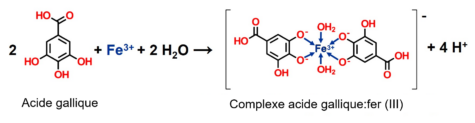
Dans cette activité, le thé s’assombrit lorsque des ions de fer (III) sont présents, passant du brun pâle à une couleur noire, comme de l’encre (voir figure 3). Les composés responsables de ce changement sont les polyphénols, qui réagissent avec les ions fer. Le thé contient un certain nombre de polyphénols, y compris des tanins qui lui confèrent de l’amertume et de l’astringence, et un exemple de ces polyphénols est l’acide gallique et ses dérivés, qui font partie de la structure de plusieurs tanins. Les réactions chimiques de cette activité sont assez compliquées, mais en bref, l’acide gallique réagit avec les ions fer (III) pour former du pyrogallate ferrique, un ion complexe insoluble noir.

Cette activité peut être utilisée comme point de départ pour discuter de la façon dont les complexes de métaux de transition sont formés (le type de liaison impliqué, ce que sont les ligands et comment les changements de pH affectent leur formation).
La figure 4 montre un exemple d’un complexe d’acide gallique et de fer (III), avec deux molécules d’eau agissant comme co-ligands pour compléter la sphère de coordination octaédrique.[2]
Vous pouvez également tester d’autres infusions pour la présence de polyphénols, par exemple celles à base de rooibos. Différentes couleurs peuvent apparaître en fonction des complexes de fer (III) formés (du brun foncé au bleu foncé).
Dans un article précédent de Science in School, [3] nous avons introduit l’idée des changements de couleur résultants d’agents oxydants et réducteurs (dans ce cas causés par des réactions chimiques entre les sucettes de glucose et les sels de permanganate).
Dans cette activité, nous examinons les changements de couleur dus à l’action des agents oxydants et réducteurs sur le thé d’hibiscus. Ici, le percarbonate de sodium agit comme agent oxydant et le dithionite de sodium comme agent réducteur.
Chaque groupe d’étudiants aura besoin du matériel suivant:
Les élèves pourront suivre les étapes suivantes en groupe:
Discutez des questions suivantes avec vos élèves:
Les élèves peuvent également être invités à faire leurs propres recherches pour étudier le lien entre cette activité et les produits de blanchiment. Par example:
Le thé d’hibiscus se décolore (blanchit) presque complètement avec du dithionite de sodium, mais pas avec du percarbonate de sodium (figure 5).

Les agents de blanchiment chimiques sont des produits utilisés pour enlever la couleur du tissu et pour nettoyer les tâches. Ils réagissent avec de nombreux composés organiques colorés, y compris des pigments naturels. Les agents oxydants sont les plus couramment utilisés, mais certains agents réducteurs sont également utilisés.
Le percarbonate de sodium est un agent de blanchiment oxydant typique à base de peroxyde. Le groupe peroxyde donne naissance à des espèces oxygénées très réactives, et ce sont les agents de blanchiment (et oxydants) actifs. Ils rompent les liaisons chimiques dans la région chromophore des molécules de pigment (voir encadré), changeant leur couleur.
Un agent de blanchiment réducteur, tel que le dithionite de sodium, fonctionne en convertissant les doubles liaisons carbone-carbone du chromophore en liaisons simples, diminuant ainsi l’état d’oxydation du carbone.
Bien que la plupart des réactifs soient des produits chimiques ménagers courants, certains, comme la solution d’hydroxyde d’ammonium, le percarbonate de sodium et le dithionite de sodium, peuvent être irritants ou corrosifs. Les enseignants doivent suivre leurs règles locales de santé et de sécurité et les conseils figurant sur l’étiquette du produit. Une blouse de laboratoire, des gants et des lunettes de sécurité doivent être portés par tous les élèves pour éviter le contact des produits chimiques avec la peau et les yeux. Une attention particulière doit être portée au chlorure de fer (III). Voir également la note de sécurité générale sur le site Web Science in School. Tous les déchets peuvent être éliminés sans danger dans les égouts. Tous les déchets peuvent être éliminés sans danger dans les égouts.
Cet article est basé sur une présentation au festival Spanish Science on Stage (Ciencia en Acción) en 2020 par Marisa Prolongo, aidée par son neveu Guillermo et sa nièce Ana. Les auteurs remercient l’Université technique de Madrid (UPM) pour son soutien tout au long du projet «Promouvoir l’apprentissage des STEM fondé sur l’enquête»; à la Fondation «la Caixa» pour son soutien au projet «La science et la technologie à la portée de tous»; et aux Sociétés royales espagnoles de physique (RSEF) et de chimie (RSEQ).
[1] Rusishvili M et al. (2019) Unraveling the molecular mechanisms of color expression in anthocyanins, Physical Chemistry Chemical Physics 21: 8757-8766. doi: 10.1039/C9CP00747D
[2] Rattanakit P, Maungchang R (2019) Determining Iron(III) Concentration in a Green Chemistry Experiment Using Phyllanthus emblica (Indian Gooseberry) Extract and Spectrophotometry, Journal of Chemical Education 96:756-760. doi: 10.1021/acs.jchemed.8b00817
[3] Prolongo M, Pinto G (2018) Colourful chemistry: redox reactions with lollipops. Science in School 43: 41-45.
Au Wellington College, nous avons personnellement utilisé l’article d’enseignement «Chimie colorée: réactions redox avec des sucettes», écrit par les mêmes auteurs. Nous avons constaté que les étudiants appréciaient vraiment l’aspect visuel et en apprenaient davantage sur la chimie derrière la démo. En conséquence, je suis ravi de tenter les expériences de ce nouvel article Teach impliquant divers thés. Nos étudiants sont actuellement enseignés à distance au Royaume-Uni: L’activité 1 peut être réalisée par les étudiants à la maison avant le cours, puis leur donner la chance de partager leurs résultats.
Caroline Evans, Head of Chemistry, Wellington College, UK
Download this article as a PDF