Les cancers infectieux : ce que nous dit l’ADN Understand article
Comment une cellule devient-elle cancéreuse ? Et comment un cancer infectieux se développe-t-il ? Dans ce second article sur les cancers transmissibles, la professeure et généticienne Elizabeth Murchison nous explique ce que nous apprend l’information génétique.

Image reproduite avec l’aimable autorisation de Wayne McLean/Wikipédia
Elizabeth Murchison décrit son travail comme de « l’archéologie moléculaire » : ce ne sont pas des pierres et des os anciens qu’elle analyse minutieusement, mais bien des molécules d’ADN, à la recherche des mutations fondamentales qui, lorsqu’elles apparaissent, modifient la nature des cellules touchées.
Son objectif est de retracer l’histoire d’une maladie particulièrement grave : la tumeur faciale transmissible du diable de Tasmanie (Devil Facial Tumor Disease ou DFTD). Elle souhaite expliquer comment elle est apparue et s’est répandue. Cette maladie infectieuse n’est pas causée par un virus ou par des bactéries, mais par des cellules tumorales qui ont acquis la capacité de se transmettre d’un individu à un autre en provoquant des tumeurs fatales chez chaque nouvel hôte. Ce cancer ne peut pas infecter l’homme. Il est apparu il y a seulement quelques dizaines d’années, mais il est tellement virulent qu’il menace déjà d’extinction l’espèce touchée : le diable de Tasmanie.
Un travail archéologique pour ce cancer infectieux
La séquence de nucléotides de l’actuelle tumeur DFTD est une sorte de registre archéologique qui renferme le génome de la tumeur d’origine, apparue il y a 30 ans, ainsi que les mutations qui se sont accumulées depuis. « En tant qu’archéologues moléculaires, nous rassemblons les variations génomiques que nous avons rencontrées et nous essayons d’évaluer lesquelles étaient présentes dans la tumeur d’origine et lesquelles sont apparues après », explique la professeure Murchison.
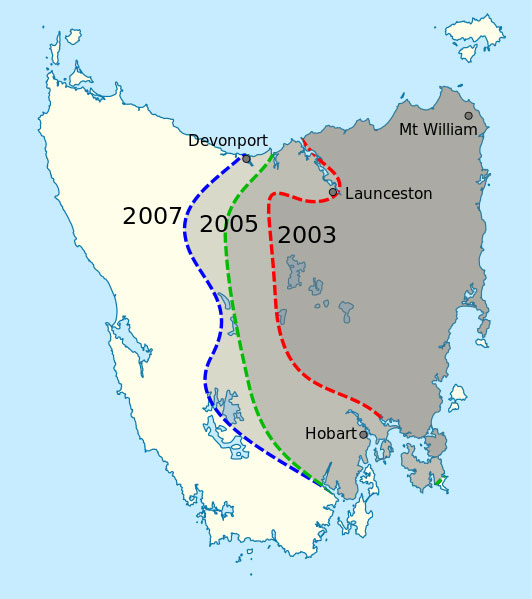
Image du domaine public ; Source de l’image : Wikipédia
Tous les cancers, contagieux ou non, se développent à partir d’une cellule qui a accumulé des mutations. Chaque fois qu’une cellule se divise et que son ADN est copié, de nouvelles mutations peuvent apparaître. Des mutations peuvent aussi être causées par des agents cancérogènes, comme le tabac, ou par des virus, comme le papillomavirus humain (HPV). Certaines mutations qui accroissent le risque de cancer peuvent également être héréditaires, comme le gène BRCA1, qui est associé au cancer du sein.
Généralement, l’ADN des cellules tumorales humaines a subi entre 1 000 et 5 000 mutations, quelquefois même 100 000 mutations ou plus dans le cas d’une exposition prolongée à un agent cancérogène.
Des mutations étonnement rares
Compte tenu des propriétés exceptionnelles et de la rareté des tumeurs transmissibles, l’équipe d’Elizabeth Murchison s’attendait à ce que la tumeur DFTD présente beaucoup plus de mutations que les cancers humains, mais ce n’est pas le cas. « Nous estimons que la DFTD possède environ 20 000 mutations, soit moins que certains cancers humains, raconte-t-elle, ce qui semble indiquer que, pour se propager et survivre dans un nouvel hôte, un cancer n’a pas besoin de nombreuses mutations, mais seulement de quelques mutations clés ».
L’équipe tente maintenant d’identifier quelles sont ces mutations clés. Pour commencer, il a fallu extraire l’information génétique de cellules normales du diable de Tasmanie pour ensuite la comparer à l’ADN de la tumeur. « Étant donné que nous n’avions pas de génome de référence, nous avons commencé par séquencer le génome du diable de Tasmanie », explique-t-elle. « Si l’on avait seulement séquencé le génome de la tumeur, nous n’aurions pas pu différencier les gènes mutés des gènes normaux ». C’était là un grand défi, aussi complexe que celui du séquençage du génome humain de référence w1.
Ensuite, il fallait comparer l’ADN des tumeurs avec le génome de référence, ce qui n’était pas non plus une mince affaire. La maladie est apparue pour la première fois en 1980, donc, lorsqu’on compare le génome d’une tumeur DFTD avec le génome de référence, il est difficile de déterminer si les variations observées se sont produites dès la tumeur d’origine ou au cours des 30 années qui ont suivi. Afin de distinguer les mutations à l’origine de la maladie de celles survenues après, l’équipe est en train de mener une analyse à grande échelle, en séquençant l’ADN normal de centaines de diables de Tasmanie et en le comparant avec l’ADN de centaines de tumeurs DFTD.
Grâce à ces travaux, nous savons aujourd’hui que la première tumeur transmissible est apparue chez un diable de Tasmanie femelle, car le génome de la tumeur contient deux chromosomes X. Les chercheurs sont également parvenus à identifier la base génétique d’une mutation clé : la capacité de la tumeur à se dissimuler du système immunitaire du nouveau porteur, grâce à l’inactivation d’un gène responsable de la production du signal moléculaire qui permet en temps normal de distinguer les cellules « amies » des cellules « ennemies ». Cette découverte, ainsi que l’extrême ressemblance génétique de toute la population des diables de Tasmanie, explique pourquoi les cellules d’un individu sont capables de proliférer chez un autre individu sans déclencher de réponse immunitaire. Ces données sont déjà exploitées pour la conception d’un vaccin contre la DFTD. L’étude de l’évolution de la lignée cellulaire de la tumeur DFTD lors de sa propagation en Tasmanie a également révélé qu’il existe beaucoup de sous-types génétiques de la tumeur.
La professeure Murchison est également en train d’étudier une autre forme connue de cancer transmissible : la tumeur vénérienne transmissible canine (ou TVTC) qui se transmet chez le chien. Tout comme pour la tumeur faciale du diable de Tasmanie, l’objectif est de combiner les profils génétiques des tumeurs d’origine ayant touché les premiers chiens et de retracer leur évolution (voir encadré).
Étude génétique de la tumeur vénérienne transmissible canine
L’analyse génétique a révélé que les tumeurs canines transmissibles que nous pouvons observer aujourd’hui ont un ancêtre commun qui est apparu il y a 11 000 ans ! Cette analyse a fourni plus de détails sur l’apparence du premier chien à avoir été touché par cette maladie, représenté sur le croquis ci-dessous.
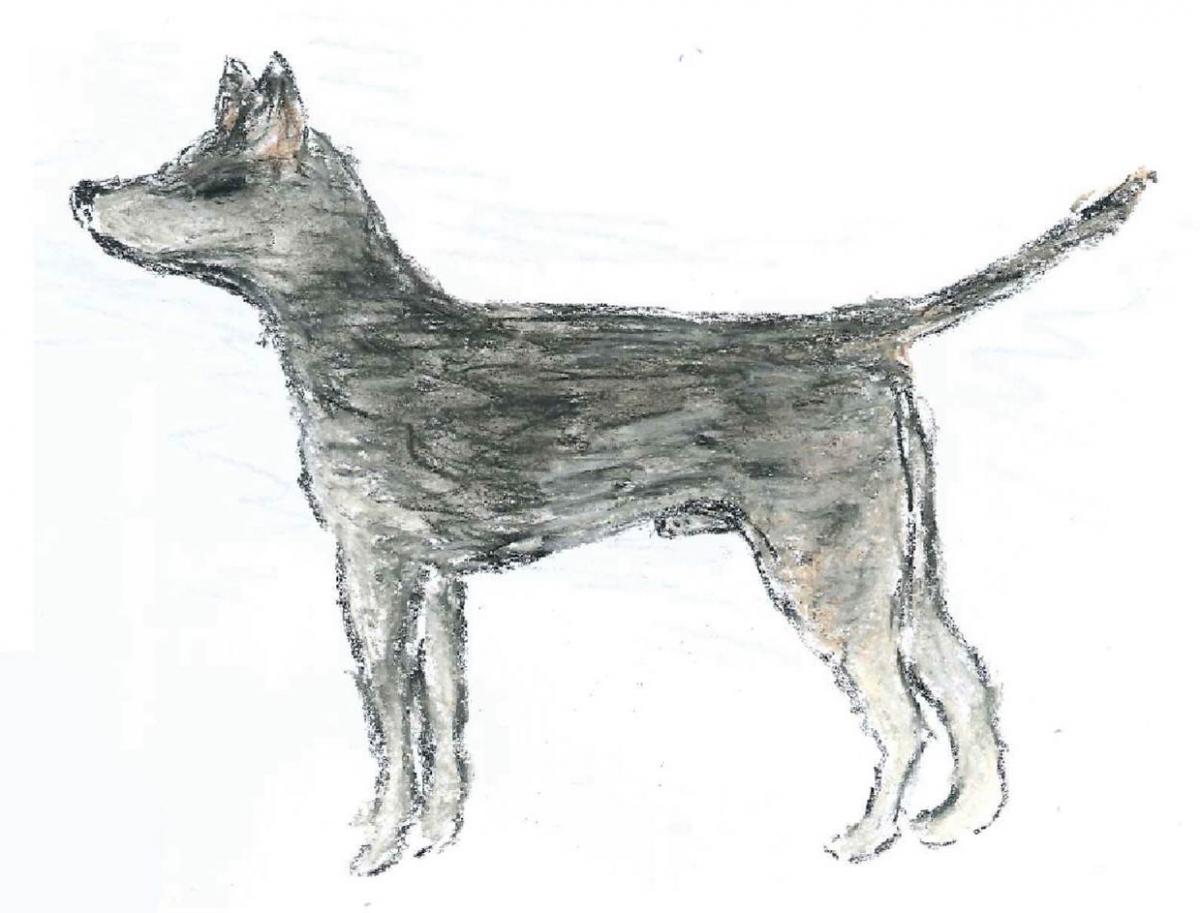
Image reproduite avec l’aimable autorisation d’Emma Werner
| Nom du gène |
Caractéristiques physiques associées |
|---|---|
| ASIP | Pelage couleur « Agouti » (mixte) |
| CBD103 | Probablement pelage noir |
| KRT71 | Pelage lisse ou ondulé |
| FGF5 | Pelage court |
| IGF1 | Grande ou moyenne taille |
| BMP3 | Probablement museau fin |
| MGAM |
Adaptation à un régime fait d’amidon et de viande |
Une lutte pour la survie
Revenons en Tasmanie. Les personnes engagées en faveur de la conservation des diables de Tasmanie ne comptent pas uniquement sur la recherche pour contrer la menace de la DFTD. Un projet de conservation de cette espèce sauvage est actuellement en place, lequel consiste à introduire sur leur petite île une nouvelle population de diables de Tasmanie, ni malades, ni infectés, séparés du reste de la population. Ainsi, tandis que le travail scientifique visant à comprendre cette terrible maladie se poursuit, l’avenir de ces petites créatures farouches pourrait s’éclaircir. « Nous sommes tous déterminés à agir pour la survie des diables », affirme la professeure Murchison.
Web References
- w1 – Le génome humain a été séquencé grâce au Projet Génome Humain. Pour plus d’informations, consulter la page Web du projet.
Resources
- Pour découvrir ce qu’est la DFTD, consulter le premier des deux articles de Science in School sur le sujet: Watt S (2015) Infectious cancers. Science in School 32: 6–9.
- Pour en savoir plus sur la DFTD et sur les actions menées pour sauver les diables de Tasmanie, cliquez ici.
- Cliquez ici pour regarder une courte vidéo grand public dans laquelle Elizabeth Murchison présente son travail.
- Pour en savoir plus sur les cancers transmissibles, voir: Giles C (2010) Sympathy for the devil. Wellcome News 62: 8–9.
Review
La seconde partie de l’histoire de la DFTD se concentre sur les caractéristiques génétiques des cancers transmissibles. La DFTD est une terrible maladie qui décime la population des diables de Tasmanie.
Cet article peut être utilisé comme base pour explorer des sujets très intéressants comme l’« archéologie moléculaire », le séquençage du génome/de l’ADN ou encore les aspects immunitaires des cancers classiques et transmissibles. Une question qui pourrait être encore plus intéressante se trouve dans le dernier paragraphe du texte, qui décrit une stratégie de conservation du diable de Tasmanie. C’est un bon point de départ pour débattre des préoccupations éthiques et des limites des actions de conservation des espèces:
- Devons-nous interférer dans le processus de sélection naturelle?
Ou bien, devons-nous sauver une espèce menacée par des causes naturelles?
- À la lumière des découvertes de Charles Darwin sur les pinsons des Galapagos, avons-nous le droit de sélectionner et de séparer un groupe d’individus de la population principale ? Quelles conséquences la reproduction en isolement peut-elle avoir sur une espèce donnée?
Cet article, comme le précédent, incite les professeurs de biologie à approfondir leurs connaissances sur le sujet.
Luis M. Aires, Lycée Antonio Gedeao, Portugal





