Des mousses à base de pois pour un cappuccino plus écologique Understand article
Texte adapté à partir d’un article ILL
Des pois, s'il vous plaît ! Découvrez comment les scientifiques explorent les mousses à base de pois pour des cappuccinos savoureux, écologiques et d'origine végétale !
La prise de conscience des enjeux liés au changement climatique a généré une demande croissante pour les aliments et boissons végétales, comme le cappuccino. Pour les rendre aussi délicieux que possible, il est essentiel de comprendre la structure des mousses végétales. Des chercheurs danois et français ont relevé ce défi avec succès en utilisant la diffusion de neutrons.[1]
Les mousses ont de nombreuses applications dans notre vie quotidienne. Nous connaissons tous, par exemple, les bains moussants, la crème à raser ou les extincteurs. Un domaine où les mousses sont particulièrement importantes est l’alimentation : la mousse de blanc d’œuf cuite devient une savoureuse meringue, les gâteaux sont décorés de crème fouettée, et le lait émulsionné (fouetté) est délicieux sur un cappuccino.
Les mousses
Les mousses sont composées de gaz dispersés dans un solide ou un liquide. Les mousses alimentaires présentées dans cette étude sont des mousses gaz/liquide, dans lesquelles des bulles d’air sont entourées d’un mince film liquide.
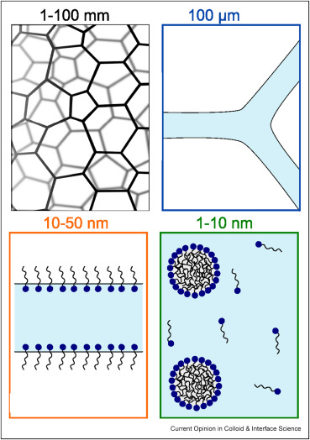
Image issue de la Réf. [2]
Ces mousses gaz/liquide peuvent être instables car le liquide autour des bulles peut s’écouler, entraînant l’affaissement de la mousse. Une simple mousse d’eau est très instable, mais en regardant de plus près les mousses alimentaires comme la mousse de lait, on constate que les couches liquides sont stabilisées par de petites particules, telles que des protéines ou des micelles.
Les mousses de lait sont un type de mousse largement utilisé en technologie alimentaire, et les chercheurs ont étudié leurs caractéristiques moléculaires en détail. Nous savons qu’il s’agit d’assemblages de bulles d’air au sein du lait, qui est un mélange d’eau, de matières grasses, de protéines et de sucre de lait. Lorsque les protéines du lait diffusent vers l’interface air-liquide et s’y concentrent, elles réduisent la tension à la surface des bulles. Les protéines se déploient alors, et leurs régions hydrophiles et hydrophobes pointant respectivement vers les phases liquide et gazeuse, stabilisent la mousse.
L’impact sur le climat de la consommation excessive de produits animaux, y compris les dérivés d’œufs et de lait, est devenu une préoccupation croissante pour les citoyens ces dernières années. En conséquence, nous consommons désormais davantage de produits à base de plantes, notamment des alternatives au lait fabriquées avec des protéines végétales, telles que les protéines d’avoine, de soja ou de pois. Pour que nous puissions savourer des cappuccinos végétaux, il est important de comprendre les propriétés moussantes des protéines végétales, car leur composition moléculaire et leur comportement chimique sont souvent différents de ceux des protéines animales. Cela peut affecter la texture, la sensation en bouche et le goût des aliments à base de plantes.
Une équipe de chercheurs danois étudie les mousses formées par un type spécifique de protéines de pois connues sous le nom d’albumines. Ces protéines sont faciles à extraire des plants de pois et sont également très solubles. Elles pourraient entrer dans la composition d’aliments et boissons d’origine végétale, comme le cappuccino. Un autre avantage des plants de pois est que leur culture est adaptée à nos latitudes.

Image: Mx. Granger/Wikipedia, Public domain
L’objectif de l’équipe était de comprendre la structure moléculaire des mousses d’albumine de pois, d’analyser leur mécanisme de stabilisation et d’évaluer l’influence du pH et du chauffage sur leurs propriétés. Pour observer ces évolutions structurelles sur une gamme d’échelles de longueur allant du nanomètre au millimètre, ils ont choisi une technique appelée la diffusion de neutrons aux petits angles (DNPA), combinée à l’imagerie optique, à l’Institut Laue-Langevin (ILL) à Grenoble, en France.
Diffusion de neutrons
Les neutrons sont des particules subatomiques électriquement neutres que l’on trouve dans les noyaux atomiques. Des neutrons libres peuvent être produits dans des réacteurs nucléaires, comme celui de l’ILL. À l’aide d’instruments dédiés, les faisceaux de neutrons sont dirigés vers des échantillons, tels que les mousses décrites ici. Les échantillons diffusent une partie des neutrons, qui sont ensuite repérés et comptabilisés par un détecteur spécial. En analysant le nombre de neutrons diffusés sous différents angles, les chercheurs peuvent obtenir des informations détaillées, à l’échelle nanométrique, sur la structure moléculaire et les propriétés des échantillons.
Les scientifiques ont pu utiliser la technique de la DNPA (Diffusion de Neutrons aux Petits Angles) pour recueillir des informations sur les propriétés de la mousse, telles que la taille des bulles, l’épaisseur du film, la teneur en protéines et le bord de Plateau, et ce, en fonction du temps et dans différentes conditions de pH et de température. Ceci est crucial en technologie alimentaire, car les denrées peuvent avoir des valeurs de pH différentes et être préparées ou servies à des températures élevées. Par exemple, le café est acide et généralement servi chaud.
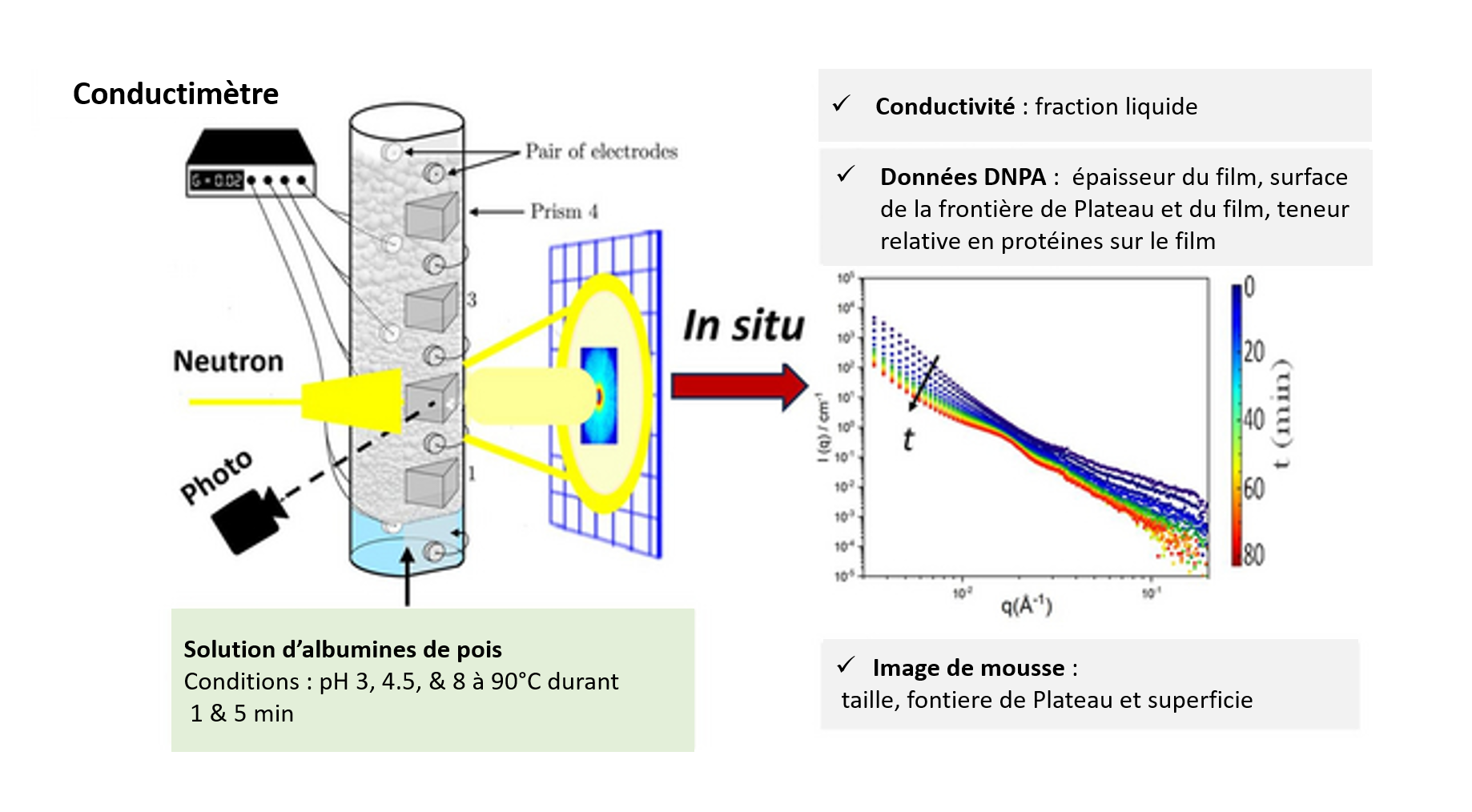
Image issue de la Réf. [1]
Les auteurs ont étudié les mousses d’albumine de pois à des valeurs de pH de 3, 4,5 et 8, le pH 4,5 correspondant au point isoélectrique des protéines d’albumine de pois. Le point isoélectrique est différent pour chaque protéine, en fonction de l’équilibre entre les acides aminés basiques/acides qu’elle contient. C’est la valeur de pH à laquelle il y a un nombre égal de résidus d’acides aminés chargés positivement et négativement à la surface de la protéine. À des valeurs de pH supérieures au point isoélectrique, la protéine a une charge globalement négative, et à des valeurs de pH inférieures au point isoélectrique, la protéine a une charge globalement positive; dans les deux cas, les molécules de protéines se repoussent. Cependant, au point isoélectrique, les molécules de protéines ont une charge globalement neutre et ne se repoussent plus. Au lieu de cela, elles ont tendance à s’agglutiner (s’agréger) et peuvent même précipiter de façon visible hors de la solution.
Image reproduite avec l’aimable autorisation de Chiara Obermueller. Structure issue de PDB: 1p8b
Pour les albumines de pois étudiées ici, cette agrégation a entraîné la formation d’une épaisse couche de protéines à l’interface air-liquide des mousses à un pH de 4,5, assurant ainsi leur stabilisation. À un pH de 8, le film était moins épais, et à un pH de 3, le rayon des bulles était le plus grand et le film protéique le plus fin. Ces mousses étaient particulièrement sujettes au drainage du liquide (diffusion du liquide à travers la mousse), ce qui peut altérer leur structure et entraîner leur affaissement.

Image issue de la Réf. [1]
La température, tout comme le pH, peut modifier la structure des protéines par dénaturation thermique. Un exemple familier est la cuisson des œufs, où le blanc d’œuf initialement clair et liquide devient blanc et solide. Dans le cas des mousses d’albumine de pois, le chauffage des solutions avant la création de mousse n’a pas eu d’effet visible sur la structure de la mousse. Il semble que les albumines de pois soient moins sensibles à la température qu’aux variations de pH.
Ces expériences représentent une étape très importante vers la compréhension des propriétés moléculaires des aliments d’origine végétale, qui sont de plus en plus importants à mesure que la durabilité devient une préoccupation croissante chez les consommateurs. Cela illustre également la puissance de la diffusion de neutrons en tant que technique permettant une caractérisation en temps réel et à de multiples échelles de systèmes biologiques très complexes.
References
[1] Li R et al. (2025) A time-resolved investigation at multiple-length scales of the structure of liquid foam stabilized by albumins from pea. Journal of Colloid and Interface Science 678: 1049–1060. doi: 10.1016/j.jcis.2024.09.086
[2] Chiappisi L (2024) Liquid foams: new insights and perspectives from neutron and synchrotron scattering experiments. Current Opinion in Colloid and Interface Science 72. doi: 10.1016/j.cocis.2024.101823
Resources
- Regardez une vidéo de l’ILL expliquant comment la diffusion de neutrons aux petits angles peut être utilisée pour suivre la description, la distribution et l’évolution des microstructures. (en anglais)
- Explorer la biochimie des bananes : Glardon S, Scheuber T (2018) Go bananas for biochemistry. Science in School 44: 28–33.






