Supporting materials
Hoja de trabajo para el alumno (Word)
Comidas autocalentables: reacciones redox, pasivación y celdas locales (Word)
Download
Download this article as a PDF

Traducido por Elisa Inés López Schiaffino. ¿Alguna vez ha deseado una bebida o comida caliente sin tener una hornalla a mano? Marlene Rau presenta dos actividades del portal Lebensnaher Chemieunterricht que usan reacciones químicas para calentar comida – y para presentar el concepto de…

Las comidas autocalentables – en principio creadas para uso militar – son recipientes de comida hecha que se calientan sin contacto con el fuego. Se pueden calentar de varias formas – presionando un botón en el envoltorio, desenvolviendo y agitando el recipiente, o vertiendo el contenido de una bolsa en otra y esperando unos minutos – y todas esas formas usan reacciones químicas exotérmicas. Estas comidas pueden ser usadas para motivar a los alumnos a que estudien reacciones de manera relativamente segura y sin la necesidad de recurrir a un quemador. Además, se puede discutir el impacto ecológico negativo de las comidas desechables.
Para el siguiente experimento, recurrimos al sistema de comidas autocalentables Crosse & Blackwell, que utiliza la reacción de magnesio y agua salada para producir hidrógeno:

Mg (s) + 2H2O (l) -> Mg2+ (aq) + H2 (g) ↑ + 2OH– (aq)
s: sólido; l: liquid; g: gaseoso; aq: solución; las flechas verticales indican que se libera gas.
Esta reacción es muy lenta, debido a la pasivación, por eso para acelerarla se agrega hierro y sal. La pasivación es el proceso por el cual un material se hace menos reactivo, generalmente por el depósito de una capa de óxido en su superficie: si se coloca una tira de magnesio en agua fría, su superficie se oxida y se forma hidróxido de magnesio (Mg(OH)2), y esta capa impide que la reacción continúe.
Por ello, en la comida autocalentable se agrega hierro al magnesio, lo que produce una celda galvánica local – corrosión en pequeña escala que ocurre cuando dos metales de reactividad diferente están en contacto en un ambiente húmedo – lo que acelera la reacción exotérmica. Dado que el potencial redox del magnesio es más bajo que el del hierro (el metal menos reactivo), los electrones pasan del magnesio al hierro, y recién entonces de allí al agua. Aunque los cationes de magnesio (Mg2+) y los aniones de hidróxido (OH–) se siguen formando, están separados por el hierro y no se pueden combinar para formar hidróxido de magnesio. Como resultado, el magnesio no se ha pasivado por la capa de hidróxido de magnesio que disminuye su reactividad.
Debido a que los iones de magnesio e hidróxido con cargas diferentes son móviles, en agua pura pronto forman hidróxido de magnesio, la carga se equilibra y la reacción se lentifica nuevamente. Para impedir esto, se agrega cloruro de sodio al agua, para que los iones de sodio (Na+) y cloruro (Cl–) de la sal rodeen a los iones de magnesio e hidróxido, equilibrando la carga.
Este experimento sirve para presentar y discutir los conceptos de transferencia de electrones, celdas galvánicas locales, pasivación, ánodos de sacrificio, corrosión y composición del agua (enlaces covalentes, polaridad y número de oxidación). Llevar a cabo el experimento toma 45 minutos, a lo que se debe agregar un tiempo de discusión. Ha sido realizado exitosamente con alumnos de 14 años para estudiar las reacciones de transferencia de electrones y la corrosión, y con alumnos más avanzados para trabajar en la electroquímica.
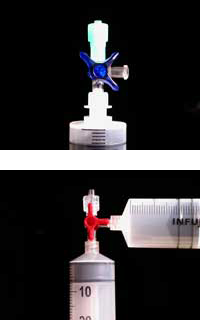
Para conseguir los materiales plásticos requeridos para el experimento se puede recurrir a los kits ChemZw2, desarrollados en colaboración con el proyecto Lebensnaher Chemieunterricht (LNCU)w3, o a los proveedores de materiales para laboratorios de medicina y química.
Comentario: si usa el contenido de solo dos de los cuatro paquetes de la mezcla de magnesio/hierro, puede guardar los otros dos para los experimentos de los alumnos – es suficiente para aproximadamente 20 grupos de estudiantes. Incluso con solo dos paquetes para la demostración, la comida autocalentable alcanzará una temperatura de 100°C al cabo de alrededor de un minuto.
En la celda galvánica local, se produce hidróxido de magnesio. Si se desea, puede ser detectado usando fenolftaleína (vea más abajo).
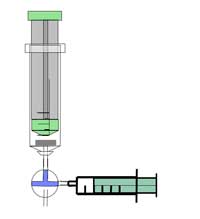
Precaución: Use gafas de seguridad. La reacción crea un gas altamente inflamable; tenga cuidado. También lea las recomendaciones generales de seguridad.
Opcional: agregue una gotita de solución de fenolftaleína al agua que juntó en el vaso de precipitados. ¿Qué sucede? ¿Por qué?
Recomendación de salud y seguridad: puede deshacerse de los líquidos restantes tirándolos en el lavabo. Limpie los materiales plásticos con agua y déjelos secar.
Otras reacciones empleadas comúnmente en las comidas autocalentables comprenden la oxidación del hierro, la reacción del cloruro de calcio anhidro con agua (ver más abajo) o, para enfriar, la reacción de los fertilizantes de nitrato de amonio con agua.
Encontrará otros experimentos explicados en el sitio de Internet LNCUw3; por ejemplo cómo fabricar sus propias bolsas calientes y frías, o cómo determinar el contenido de oxígeno en el aire a través de la reacción de oxidación del hierro utilizada en las bolsas calientes.
Esta actividad también puede formar parte de una clase en la que los alumnos escriban un guión para un programa televisivo de ciencia en el que respondan la pregunta de un telespectador sobre cómo funcionan las comidas autocalentables. La versión en español de esta hoja de trabajo está disponible en el sitio de Internet Science in Schoolw5, y la versión en alemán en el sitio de Internet LNCUw3.
En esta actividad, los alumnos calientan café usando cloruro de calcio anhidro y agua. La actividad es de utilidad para enseñar contenidos relacionados con la disolución de sales en agua, al presentar los aspectos energéticos de este proceso. Los alumnos deberían estar familiarizados con las uniones iónicas y covalentes. Esta actividad funciona bien con grupos de tres alumnos de 14 años o más.
Una posibilidad es discutir la energía reticular, tomando como ejemplo de la vida cotidiana los paquetes fríos que dependen de una reacción endotérmica producida al doblar una lámina metálica. Se puede usar la siguiente actividad para presentar la noción de energía de hidratación y para demostrar que la reacción de disolución de algunas sales es exotérmica.
Esta actividad es relativamente segura – lo más peligroso sería romper un vidrio por no manejarlo con cuidado.
Precaución: Use gafas de seguridad; no beba el café.
Dos problemas que a menudo tienen los alumnos son agregar demasiado poco cloruro de calcio al agua (cuanto más usan, más calor se produce) y olvidarse de aislar los vasos de precipitados.
Una solución posible es improvisar un pequeño recipiente de agua colocando agua y cloruro de calcio en un vaso de precipitados grande, y sujetando espuma de poliestireno con cinta adhesiva alrededor del vaso de precipitados. Entonces se puede calentar el café en un vaso de precipitados pequeño dentro del recipiente de agua improvisado.
El mejor resultado obtenido en el proyecto LNCU (ver recuadro) fue logrado al llenar un vaso de precipitados pequeño con agua y colocándolo en un vaso de precipitados más grande, con una placa aislante de espuma de poliestireno entremedio. Los alumnos luego colocaron el cloruro de calcio, al que habían agregado muy poca agua, en el contenedor vacío de un rollo fotográfico. Lo sujetaron con un hilo y le pusieron una piedra para que tuviera peso, y lo dejaron suspendido en el agua. La temperatura de 50 ml de café cambió de 20 a 44°C en menos de un minuto.
Discuta la aparente contradicción entre el comportamiento de los paquetes fríos en experimentos previos y el experimento que acaba de realizar – en este caso, el proceso no es endotérmico. En los paquetes fríos, se necesita mucha energía para destruir la red tridimensional de iones de la sal. Esta es la energía reticular, que se define como la energía necesaria para separar un mol de un compuesto iónico. Como la energía que se libera cuando las moléculas de agua rodean los iones (energía de hidratación) no es suficiente, la energía que falta proviene de los alrededores, por eso la solución se enfría. En el experimento de café, en cambio, la energía de hidratación es mayor que la energía reticular, por lo que el proceso en su totalidad es exotérmico. La energía de hidratación y la reticular son características fijas de cada sal en particular.
Para continuar, los alumnos podrían intentar alcanzar la temperatura mínima posible usando cloruro de calcio anhidro, cloruro de sodio e hielo. Les sorprenderá descubrir que agregar cloruro de calcio anhidro al hielo (en vez de al agua) no aumenta la temperatura. Esto se debe a que primero deben romperse los enlaces de hidrógeno en los cristales de hielo, y eso requiere energía, por eso el proceso en su totalidad es endotérmico.
En el 2003, cuatro docentes de química de Alemania se unieron para crear un portal en Internet para compartir sus mejores ideas relacionadas con la enseñanza: Lebensnaher Chemieunterrichtw3 (LNCU, clases de química relevantes para la vida cotidiana). Su recopilación ha crecido sin cesar, y ofrecen una amplia selección de actividades para todas las edades, desde la escuela primaria a la secundaria, con enlaces a los principales temas curriculares de química, como por ejemplo la tabla periódica, la titulación, el aire y el agua; y también actividades de biología y física para los alumnos más jóvenes.
Los materiales, en idioma alemán, se pueden descargar libremente como documentos Word® y PDF, con instrucciones para los docentes y hojas de trabajo para los alumnos. Además, el sitio ofrece una gama de videos sobre las actividades y una lista de más sitios web (alemanes e ingleses) con propuestas didácticas y materiales relevantes para el aula de ciencia.
Encontrará una demostración fotográfica de cómo preparar las comidas autocalentables aquí: www.mlaltd.co.uk/store
Kalogirou E, Nicas E (2010) Química a microescala: experimentos para el colegio. Science in School 16. www.scienceinschool.org/2010/issue16/microscale/spanish
A través de este artículo, los alumnos podrán conectar la ciencia que se practica en el aula con la del mundo real. Los experimentos despertarán el asombro – característica que a menudo escasea en las clases prácticas – y los alumnos podrán desarrollar y construir habilidades y conocimiento.
El tema principal al que se refiere el artículo es la química, pero el docente puede adaptar la clase para incluir discusiones sobre la energía en relación a otros temas, por ejemplo la conservación del calor, la supervivencia en los climas fríos, y el tratamiento de las lesiones deportivas.
Nick Parmar, Reino Unido