Viéndolo crecer: el desarrollo de un embrión digital Understand article
Traducido por Elena Senís. ¿Y si pudiera ser testigo del desarrollo de una nueva vida, teniendo el tiempo suficiente para estudiar cada detalle, cada célula, desde todos los ángulos, minuto a minuto? Sonia Furtado habla con los científicos que hacen esto posible creando un embrión digital…

Jochen Wittbrodt y Annette
Schmidt
Imagen cortesía de EMBL
Photolab
Imagine que Google Earth™ sacara fotos de satélite a intervalos regulares de forma que, además de ver el planeta entero y hacer zoom en diferentes países o ciudades, pudiera dar marcha atrás a la secuencia de fotos para ver qué ha cambiado en los últimos 10 o 20 años. Sustituya la Tierra por un embrión de pez cebra en desarrollo, recolecte unos cuantos cientos de fotos tomadas durante 24 horas y tendrá lo que los científicos del Laboratorio Europeo de Biología Molecular (EMBL)w1 han llamado “el embrión digital”.
El biofísico Philipp Keller, los biólogos Annette Schmidt y Jochen Wittbrodt y el físico Ernst Stelzer se unieron para desarrollar una técnica con la que obtener una representación 3D de las primeras 24 horas del desarrollo de un embrión de pez cebra (Keller et al., 2008). Todo empezó a principios de 2006, cuando un colega científico le sugirió a Philipp que simplemente pusiera un embrión en el microscopio y siguiera la trayectoria de todas las células. Motivado por esta conversación, Philipp miró con nuevos ojos al microscopio de iluminación de un solo plano (single-plane illumination microscopy, SPIM) (ver glosario para todos los término en cursiva), una técnica de imagen en 3D previamente desarrollada por el grupo de Ernst. Perfeccionó los principios básicos del SPIM para grabar el desarrollo embrionario y el resultado fue el microscopio de fluorescencia de haz de luz láser digital escaneada (digital scanned laser light sheet fluorescent microscopy, DSLM).
Debido a que las células de un embrión en desarrollo están dividiéndose y moviéndose constantemente, las instantáneas han de ser tomadas en intervalos de tiempo muy cortos para poder seguir los cambios. Esto requiere un microscopio que combine la toma de imágenes a gran velocidad con una alta calidad de imagen para poder distinguir dos células que se encuentran muy próximas entre sí. Además, para seguir el desarrollo de un embrión, las células deben mantenerse vivas y comportándose de forma normal durante uno o dos días y el microscopio no debe dañar la tinción fluorescente utilizada para marcarlas.
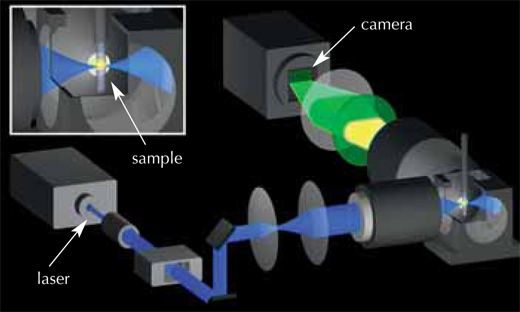
Imagen cortesía de Petra Riedinger
La solución fue utilizar un haz de láser muy fino para minimizar el daño tanto a la tinción como al embrión. Este haz de láser ilumina a través del embrión, excita la tinción fluorescente de las células y hace que esta emita luz. El haz del láser se mueve en una línea vertical y la fluorescencia emitida por la muestra con un ángulo de 90º respecto al haz del láser es detectada por la cámara, creando un fragmento de imagen de un grosor de milésimas de milímetro (ver vídeo 1w2). El embrión se mueve después un minúsculo espacio en horizontal y se escanea el siguiente fragmento de imagen. Una vez se ha escaneado el embrión completo desde un punto de vista, se rota 180º y se escanea de nuevo para generar posteriormente una imagen completa en 3D. El embrión vive y sigue desarrollándose, lo que significa que los “fragmentos de imagen” se pueden repetir periódicamente en el mismo embrión y se pueden comparar para monitorizar los cambios. Los científicos del EMBL “fragmentaron” sus embriones de pez cebra cada 60-90 segundos durante un periodo de 24 horas, obteniendo alrededor de 400 000 imágenes por embrión.
El siguiente reto fue desarrollar un mecanismo para analizar los tres terabytes de datos de cada embrión. Los científicos eligieron un enfoque automático: utilizaron grupos de ordenadores trabajando en paralelo, tanto en el EMBL de Heidelberg como en el Instituto de Tecnología de Karlsruhe, Alemaniaw3. “A cada ordenador se le proporciona una instantánea y se le dice que busque los núcleos celulares en esa imagen”, explica Philipp. Cada núcleo representa una célula, así que combinando la información de todos los fragmentos, los científicos pueden generar su embrión digital: una representación visual de todas las células del embrión que muestra dónde se encuentran en cada momento, adónde se van a mover después y cuándo y dónde se dividen. El resultado es un vídeo en 3D del embrión en desarrollo.
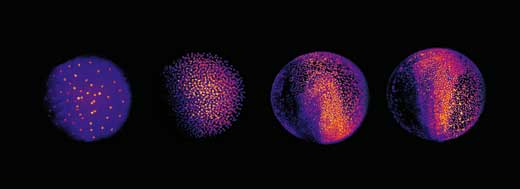
Imagen cortesía de EMBL Photolab
Esto permitió a Philipp, Annette y Jochen arrojar luz sobre diferentes etapas del desarrollo embrionario del pez cebra. En etapas muy tempranas del desarrollo, el embrión de pez cebra es básicamente un grupo de células puestas sobre un saco vitelino (la fuente de nutrientes del embrión). Al principio, las células se dividen en una onda que se mueve desde el centro en todas direcciones, como un remolino en una piscina. La reconstrucción mostró que, tras los primeros nueve ciclos celulares, el patrón de las divisiones celulares cambia a una onda que se mueve desde el centro en una sola dirección y después se divide para continuar en la periferia en dos semicírculos (ver imagen abajo y vídeo 10w2). La línea entre estos dos semicírculos se convertirá después en el eje corporal del animal. Así, los científicos descubrieron que el eje corporal del pez cebra se define en un estadío más temprano del desarrollo de lo que antes se suponía, en un momento en el que los genes maternos (en forma de mRNA depositado en el óvulo) son todavía la única fuente para producir proteínas.
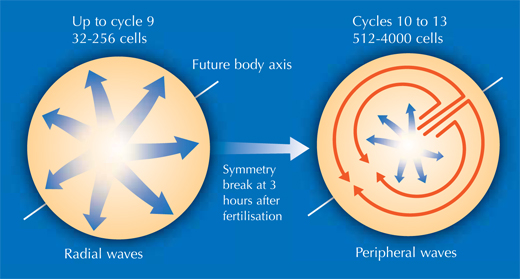
Imagen cortesía de Nicola Graf
Los investigadores también estudiaron la gastrulación, el proceso por el cual las células de la capa externa inicial del embrión migran hacia el interior para formar las dos capas germinales restantes. Esas tres capas darán lugar posteriormente a los diferentes tipos de tejido. “Son necesarias 2 o 3 páginas de un libro de texto para describir este proceso, pero cuando ves un vídeo del embrión digital, de repente es bastante fácil de entender”, dice Annette. Y lo que es más importante, Annette y sus colegas descubrieron que los libros de texto están, de hecho, equivocados.
Desde los años 80 ha habido un debate en el área, a veces fervoroso, sobre cómo migran las células para formar estas capas. La visión que prevalecía en los libros de texto era que las células involucionaban, esto significa que migran hacia una abertura del embrión y se enrollan sobre el margen para formar la capa inferior, como la parte de dentro del borde de un gorro de piscina que se enrolla alrededor de la cabeza. A pesar de todo, algunos científicos argumentan que las células de la capa externa simplemente bucean, o se invaginan, desde donde están para formar la capa de abajo.
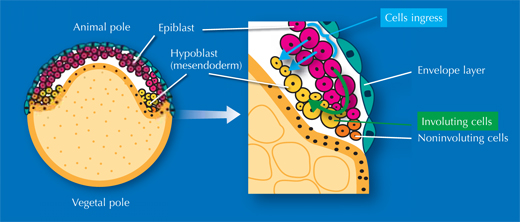
Imagen cortesía de Nicola Graf
Hemos resuelto este asunto muy bien”, dice Jochen, “¡Al final todo el mundo tenía razón!”. Es cuestión del punto de vista. Por un lado del embrión las células involucionan, sin embargo, por el otro las células se invaginan (ver vídeo 16w2). La controversia surgió porque diferentes científicos estudiaban diferentes áreas del embrión. Como no podían observar el proceso completo desdoblado, no podían determinar exactamente qué área estaban observando. Al resolver estas limitaciones, los científicos del EMBL descubrieron la verdad.
Los investigadores también utilizaron el embrión digital como un esbozo del desarrollo, para buscar el origen de las células que conforman determinado órgano o tejido. Como primer ejemplo utilizaron el ojo. En la representación digital, en un estadío avanzado del desarrollo (i. e. en la parte final del vídeo de 24 horas), los científicos marcaron las células que sabían que estaban involucradas en formar uno de los ojos del pez cebra. Después siguieron a dichas células hacia atrás en el tiempo para descubrir dónde habían sido originadas (ver vídeo 11w2).
Los científicos han puesto su embrión digital a disposición del público en internetw2, junto con otras herramientas para que otros científicos analicen sus propios datos de microscopía. ¿Qué es lo siguiente? Con Google Earth, además de ver el planeta entero y ampliar diferentes lugares, los usuarios pueden añadir notas y marcadores y ver los que otras personas han añadido. De forma similar, la ambición de Philipp, Anette, Jochen y Ernst es que sus embriones digitales se conviertan en “embriones virtuales”: recursos en los que otros científicos puedan visualizar procesos del desarrollo, hacer zoom para obtener más información y añadir sus propias anotaciones y resultados. A largo plazo, a los científicos les gustaría ampliar el alcance del embrión digital a otras especies, lo que les permitiría comparar cuantitativamente cómo se desarrollan diferentes embriones, proporcionando valiosos conocimientos sobre la evolución. El embrión digital tiene mucho espacio para crecer y, con cada vez más gente con ganas de colaborar en su desarrollo, tiene una vida muy prometedora por delante.
Glosario
Microscopio de fluorescencia de haz de luz láser digital escaneada (DSLM): versión mejorada del SPIM que utiliza un rayo láser fino en lugar de un haz de luz, reduciendo así el daño tanto al espécimen como al fluoróforo.
Gastrulación: fase del desarrollo embrionario temprano durante la cual se generan las tres capas embrionarias: ectodermo, mesodermo y endodermo. La duración y el mecanismo molecular de la gastrulación difieren entre los organismos.
Cepa genética: grupo de animales genéticamente uniformes, usados en experimentos de laboratorio. Una cepa genética se puede generar por consanguinidad, mutación o ingeniería genética.
Microscopio de iluminación de un solo plano (SPIM): este método permite la observación de procesos en organismos vivos en 3D, incluso en capas profundas de tejido. Detecta fluorescencia en un ángulo de 90º con respecto al eje de iluminación con un haz de luz láser, permitiendo el corte óptico. La muestra no se coloca sobre un portaobjetos, sino en una cámara llena de líquido que se rota durante la observación.
El pez cebra como organismo modelo
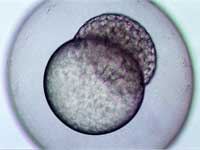
stage, two hours and forty-five
minutes after fertilisation
Image courtesy of Angharad Jones
, Wellcome Images
Por razones éticas, no se puede estudiar fácilmente el desarrollo (embrionario) temprano en humanos. Afortunadamente, el proceso es similar en todos los vertebrados, así que otros animales se utilizan como organismos modelo para entender nuestro propio desarrollo. Pero, ¿por qué el pez cebra? Esto se lo debemos a George Streisinger, un biólogo húngaro de la Universidad de Oregón, Estados Unidos. A principios de los años 80 soñaba con aplicar las técnicas moleculares que había utilizado en el estudio de virus para investigar la genética y el desarrollo de un vertebrado. Como era pescador aficionado, eligió trabajar con el pez cebra porque sabía que era fácil de mantener y cruzar. Hay varias razones que hacen del pez cebra un organismo modelo muy atractivo: la primera es que son suficientemente pequeños como para mantener el elevado número necesario para hacer estudios de genética, pero a la vez son suficientemente grandes como para realizar manipulaciones embrionarias clásicas, como transplantes.
El tiempo de generación es relativamente corto (de 3 a 4 meses), producen muchos embriones (de 100 a 200 por cruce) y proporcionan un acceso fácil a todos los estadíos del desarrollo debido a la fertilización externa. Como los embriones son transparentes y se desarrollan rápidamente, estando establecidas a los tres días todas las estructuras de un pez adulto, es fácil estudiar su desarrollo —usando tanto un microscopio de transmisión como tecnología más compleja, tal y como se describe en este artículo—. Además, el genoma del pez cebra ha sido secuenciado recientemente y hay disponibles cepas genéticas definidas que ofrecen una oportunidad única de estudiar no solo embriología, sino también enfermedades hereditarias y la genética que hay detrás de la biología del desarrollo. El sueño de Streisinger se ha hecho realidad.
References
- Keller PJ, Schmidt AD, Wittbrodt J, Stelzer EH (2008) Reconstruction of zebrafish early embryonic development by scanned light sheet microscopy. Science 322: 1065-9. doi: 10.1126/science.1162493
Web References
- w1 – Para saber más acerca del EMBL ver: www.embl.org
- w2 – La página web de El Embrión Digital incluye videos que muestran el desarrollo del embrión de pez cebra, así como datos para descargar: www.digital-embryo.org
-
El vídeo 1 es una representación esquemática del principio de funcionamiento del DSLM.
-
Los vídeos 2 y 3 muestran el desarrollo del pez cebra durante las primeras 24 horas.
-
El vídeo 10 ilustra la rotura de la simetría en las divisiones celulares después de 9 ciclos celulares y la pronta determinación del eje corporal del embrión.
-
El vídeo 11 muestra la trayectoria migratoria de las células que forman el ojo temprano del pez cebra.
-
El vídeo 16 ilustra cómo tanto la involución como la invaginación juegan un papel en la gastrulación del pez cebra.
-
- w3 – Para más información sobre el Instituto de Tecnología de Karlsruhe, Alemania, ver: www.kit.edu
Resources
- Patterson L (2010) Getting ahead in evolution. Science in School 14: 16-20.
- Hodge R (2006) A search for the origins of the brain. Science in School 2: 68-71.
- Para ver una recopilación de herramientas de aprendizaje e investigación sobre el desarrollo embrionario, ver: http://people.ucalgary.ca/~browder/virtualembryo
Institutions
Review
Este artículo describe los últimos avances en biología del desarrollo. El resultado potencial —un embrión virtual que puede ser compartido y anotado por otros científicos, como se hace con las fotos y comentarios que aparecen en Google Earth— es un emocionante ejemplo de cómo los descubrimientos científicos se pueden diseminar, comentar y, a lo mejor, extender. Esto puede enlazar bien con las ideas de ciencia global y comunicación que aparecen en algunos planes de estudios.
Hay muchos aspectos en este artículo que puede captar el interés de los alumnos de biología. El uso de una sofisticada microscopía para promover el avance de la ciencia puede dar lugar a debates acerca de cómo la tecnología frena descubrimientos o cómo gran parte del conocimiento científico es efímero e incierto, pues depende de la tecnología actual.
El uso de embriones de pez cebra puede dar lugar a un debate ético. ¿Está bien experimentar con embriones de pez? ¿Y con embriones de mamífero? ¿Y con embriones humanos? Esto puede llevar a un debate acerca de los aspectos legales de este tipo de investigación.
En general, este artículo puede ser útil para que los profesores de biología actualicen su propio conocimiento. También puede ser utilizado como lectura de base para estudiantes que vayan a participar en olimpiadas de biología, así como para aquellos que deban presentarse a entrevistas de acceso a la universidad. Además, los pies de vídeo son útiles para ilustrar el desarrollo embrionario en cualquier asignatura que incluya este tema.
Algunas preguntas de comprensión adecuadas pueden ser las siguientes:
- Describa y discuta los problemas éticos relacionados con el trabajo desarrollado por los científicos.
- Sugiera cómo el trabajo con embriones de peces podría tener alguna relevancia en el tratamiento de enfermedades humanas en el futuro.
Sue Howarth, Reino Unido





