Observando los cielos: experimentos sobre el cambio climático Teach article
Traducido por Valeria Nones Magariño y Gabriel Pinto, Universidad Politécnica de Madrid. n el segundo de dos artículos, Dudley Shallcross, Tim Harrison, Steve Henshaw y Linda Sellou ofrecen experimentos de química y física para aprovechar la energía del sol y medir los niveles de dióxido…

Las discusiones sobre el cambio climático en el aula de ciencias pueden abarcar un amplio número de temas, donde la discusión sobre fuentes de energía y sus consecuencias probablemente tendrá un papel relevante. Los temas planteados seguramente incluyan diferentes combustibles que pueden utilizarse, su efectividad y producción; alternativas a la combustión; energía solar; y la importancia del dióxido de carbono en el calentamiento global. A continuación, sugerimos dos actividades de laboratorio como soporte a las lecciones de física y química sobre el cambio climático. Otras tres actividades relacionadas con combustibles fueron publicadas en Shallcross et al (2009).
1) Celdas de Grätzel: energía de luz solar
El Sol, por supuesto, es la fuente de la mayoría de la energía utilizada sobre la Tierra, aparte de la energía geotérmica y nuclear – incluyendo la energía liberada a partir de combustibles fósiles o de los modernos combustibles “verdes”. Pero la luz del sol también puede utilizarse directamente como fuente de energía, como puede demostrarse en el aula utilizando celdas de Grätzel, también llamadas “células solares de colorante nanocristalino” (‘nanocrystalline dye solar cells’) o “células solares orgánicas” (‘organic solar cells’). Nombradas en honor de su inventor, el ingeniero suizo Michael Grätzel, las células o celdas de Grätzel convierten directamente la luz solar en electricidad por fotosíntesis artificial utilizando colorantes naturales que se encuentran, por ejemplo, en las cerezas, moras, frambuesas y grosellas. Estos colorantes o pigmentos de color púrpura-rojo, conocidos como antocianinosw1, , son muy fáciles de extraer por los alumnos a partir de frutas y hojas, simplemente hirviéndolas en un pequeño volumen de agua y filtrándolas.
Estas celdas son muy prometedoras, ya que están hechos de materiales de bajo costo y no son necesarios aparatos complicados para su fabricación. Aunque su eficiencia de conversión es menor que la de las mejores celdas de película fina, su relación precio/rendimiento (kWh/M2/año) es lo suficientemente alta como para permitirles competir en generación de electricidad con los combustibles fósiles. Las aplicaciones comerciales, que se paralizaron por problemas de estabilidad química, se prevén ahora en la Hoja de Ruta Fotovoltaica de la Unión Europea (‘European Union Photovoltaic Roadmap’w2) como un aporte potencialmente significativo para la generación de electricidad renovable a partir del año 2020.
Las celdas Grätzel separan las dos funciones proporcionadas por el silicio en un diseño tradicional de celda: normalmente, el silicio actúa como fuente de fotoelectrones, proporcionando también el campo eléctrico necesario para separar las cargas y crear una corriente. En la celda de Grätzel, la mayor parte de los semiconductores se utiliza exclusivamente para el transporte de carga, mientras que los fotoelectrones se suministran a partir de un pigmento fotosensible separado (la antocianina). La separación de cargas se produce en las superficies entre el pigmento, el semiconductor y el electrolito.
Las moléculas de pigmento son muy pequeñas (en la escala de nanómetros), por lo que para capturar una cantidad razonable de la luz entrante, la capa de moléculas del pigmento debe ser bastante gruesa – mucho más que las propias moléculas. Para solucionar este problema, se utiliza un nanomaterial como soporte para contener grandes cantidades de las moléculas de pigmento en una matriz tridimensional, aumentando el número de moléculas en cualquier área de la superficie de la célula. En los diseños existentes, este soporte lo proporciona por el material semiconductor (óxido de titanio), que juega un doble papel.
Las celdas de Grätzel pueden hacerse desde cero, pero no es fácil obtener el vidrio pre-tratado que tiene un lado conductor. Más aún, hornear la pasta de dióxido de titanio en la superficie del vidrio, requiere el uso de un horno durante 24 horas. Por lo tanto, es más fácil utilizar kits comerciales, tales como los de la compañía holandesa Mansolarw3, que permiten ensamblar seis celdas de Grätzel por conjunto y cuesta aproximadamente 80 euros. Sin embargo, si usted ya tiene cierta experiencia en el uso del equipo necesario y prefiere construir sus propias celdas de Grätzel, a continuación encontrará un resumen de los pasos necesarios:
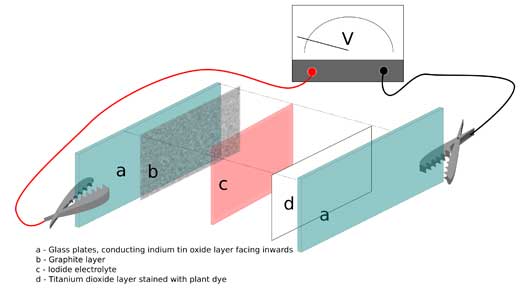
Imagen cortesía de Marcus Medley, Bristol ChemLabS
- Tome dos placas de vidrio, cada una del tamaño de un portaobjetos de microscopio, un lado de las cuales ha sido tratado con óxido de estaño e indio para hacerlo electroconductor.
- Una de las placas debe tener dióxido de titanio horneado en su lado no recubierto. El dióxido de titanio forma una estructura altamente porosa con un área superficial muy alta, a la que se puede adherir el pigmento. Advertencia: es muy fácil despegar el polvo de dióxido de titanio de la placa de vidrio, y aunque usted puede comprar pasta de dióxido de titanio, hornear las placas con una capa nueva lleva un tiempo considerable. Por lo tanto, es necesario tener en cuenta la forma de almacenamiento de las placas para evitar dañarlas. La solución más fácil es comprar los materiales prefabricados.
- Cubra la otra placa con una capa de grafito, simplemente frotando un lápiz sobre la superficie del vidrio que no tiene recubrimiento.
- Llene una placa Petri con pigmento de antocianina. Empape el dióxido de titanio con el pigmento de antocianina colocando la placa en la placa Petri y, a continuación, séquela con un secador de pelo. El pigmento se adhiere a la superficie del dióxido de titanio mediante un enlace covalente. Después de su uso, es fácil quitar el pigmento de antocianina usando etanol o propanona (acetona).
- Ensamble la celda según se indica a continuación:
- En la parte inferior coloque la placa de grafito con el lado de grafito hacia arriba, para que sirva como cátodo.
- Utilice una disolución de yodo disuelta en yoduro de potasio como electrolito y rocíela entre las placas.
- En la parte superior, coloque la placa de dióxido de titanio que ha sido cubierta de pigmento, con el lado de óxido de estaño e indio hacia arriba. El oxido de estaño e indio servirá como ánodo transparente.
- Utilice un clip para mantener las placas unidas.
- Utilice dos pinzas cocodrilo para juntar las dos piezas de vidrio solapadas (superior e inferior, ver imagen) de la celda de Grätzel y conéctelas con dos cables eléctricos a un multímetro para tomar medidas.
- Proyecte luz sobre la celda. Si la investigación sobre este aparato se hace en el norte de Europa durante los meses de invierno, una lámpara de microscopio o de escritorio proporcionará la luz suficiente.
- Utilice un fotómetro para determinar la intensidad de luz que cae cobre la celda de Grätzel.
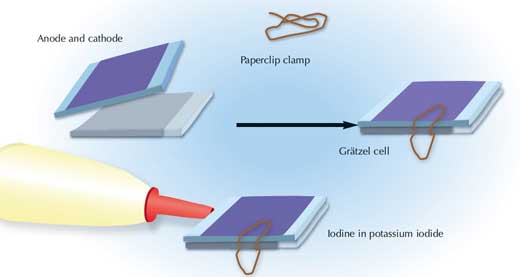
Imagen cortesía de Nicola Graf
Como diversión, las celdas de Grätzel pueden utilizarse para dar energía diferentes mecanismos. Por ejemplo, se pueden reemplazar las baterías de una calculadora con varias celdas de Grätzel pequeñas conectadas en serie. Como alternativa, se pueden alimentar los circuitos de música de las tarjetas de saludos de cumpleaños o pequeños motores.
Los alumnos podrán efectuar una serie de investigaciones con estas celdas. Estos incluyen cómo la corriente o voltaje producido varía con:
- Antocianinas de diferentes fuentes
- Pigmentos de plantas distintos a las antocianinas
- La concentración de antocianinas en las disoluciones utilizadas
- El área de la capa de dióxido de titanio expuesta a las antocianinas
- La temperatura de las celdas
- La frecuencia de la luz (utilizando filtros de color)
- La intensidad de la luz (utilizando una lámpara de microscopio como fuente de luz)
- Varias celdas en serie o en paralelo.
Los detalles de las reacciones químicas en las celdas se pueden encontrar en un artículo onlinew4.
del enlace. Haga clic sobre la
imagen para ampliarla
Imagen cortesía de Marcus
Medley, Bristol ChemLabS
2) Detectando niveles de dióxido de carbono en la atmósfera
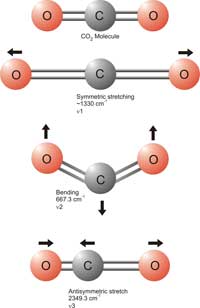
El CO2 es el gas de efecto invernadero más comúnmente conocido e implica uno de los principales temas en debates sobre el cambio climático. Uno podría preguntarse cómo se miden los niveles de CO2 en muestras de aire, ya que sus concentraciones son muy bajas: la respuesta es la espectroscopía infrarroja. Las moléculas de dióxido de carbono absorben las frecuencias específicas de la radiación infrarroja, que afectan a los enlaces covalentes entre los átomos de carbono y oxígeno, dependiendo de la energía. Las energías bajas provocan un movimiento de flexión del enlace (vibraciones de tensión) y las energías altas causan un estiramiento del enlace (vibraciones de flexión). Las frecuencias a las que esto ocurre están dentro de la parte infrarroja del espectro electromagnético (entre 4000 y 650 número de onda). Un número de onda es el recíproco de la longitud de onda y es una unidad que se utiliza comúnmente en espectroscopía infrarroja. Este efecto puede usarse para determinar la concentración de CO2 como se describe a continuación.
Hay dos tipos principales de sensores de dióxido de carbono (ver Harrison et al, 2006). Los sensores de investigación más costosos bombean aire a través del sensor, mientras que los dispositivos más baratos se basan en la difusión de aire. El aire pasa a través de una celda de absorción, que es un pequeño cilindro oscuro dentro del sensor.
En un extremo de la celda de absorción, hay una fuente de luz infrarroja acoplada a un filtro de longitud de onda fijo, que proporciona una fuente de banda estrecha de luz infrarroja alrededor de 2350 cm-1 (número de onda). En el otro extremo del tubo, existe un detector de infrarrojos o contador de fotones, que mide la intensidad de la luz infrarroja. A mayor número de moléculas de CO2 en la muestra de aire, mayor cantidad de radiación infrarroja es absorbida en la celda, y menor es la radiación infrarroja que alcanza al detector. Para pequeñas absorciones, la ley de Lambert-Beer nos dice que
Concentración = (1-(I/I0)) / σl
donde:
- l es la longitud de la trayectoria (longitud de la celda)
- σ es el coeficiente de absorción de CO2 a la longitud de onda utilizada y es conocido con una alta precisión
- (I/I0) es la proporción de la radiación infrarroja que llega al detector, cuando la celda contiene una muestra de aire (I) en relación a cuando la celda está vacía (I0)

de carbono
Imagen cortesía de Bristol
ChemLabS
I0no se mide cada vez, pero se medirá con frecuencia para comprobar que no hay fluctuaciones apreciables en la intensidad de la luz infrarroja del instrumento.
Los estudiantes que han utilizado esos sensores, prestados por la Universidad de Bristol, se han sorprendido de que el nivel de CO2 medido dentro de un aula vacía es mucho mayor que el de fuera, muy superior al valor de 0.037% (0.037/100 x 1 x 106 = 370 ppm) de concentración atmosférica de CO2 mencionado en algunos libros de texto. Los nuevos colegios en el Reino Unido parecen tener ventanas que están diseñadas para no ser abiertas, ¡por lo que se acumula el CO2 exhalado!
Los sensores de CO2 que utilizamos con los estudiantes fueron calibrados para la flexión asimétrica ν3 de CO2 en 2349 números de onda (Harrison et al, 2006). Una flexión asimétrica es cuando los enlaces dobles entre el carbono y oxígeno (C=O) absorben la energía, y uno de los dos enlaces se alarga mientras el otro se contrae (ver diagrama). Para el CO2 sólo puede haber un estiramiento (o flexión) asimétrico. Este particular estiramiento del enlace es importante porque el dióxido de carbono es la única molécula presente en grandes cantidades en la atmósfera capaz de absorber en 2349 número de onda. Por lo tanto, sólo la absorción por CO2 puede causar un cambio en la intensidad de la luz infrarroja en esta longitud de onda.
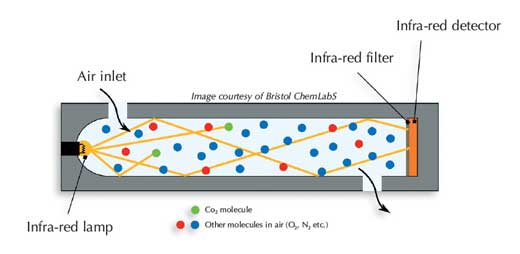
Imagen cortesía de Bristol ChemLabS
Bristol ChemLabS estaría interesada en tener noticias de escuelas en toda Europa que quisieran pedir prestado uno de estos medidores fáciles de usar para la investigación de la concentración de dióxido de carbono en muestras de aire. Aunque los instrumentos están comercialmente disponibles, son bastante caros y por lo tanto no ampliamente disponibles en escuelas o universidades.
References
- Harrison T, Shallcross D, Henshaw S (2006) Detecting CO2 – the hunt for greenhouse-gas emissions. Chemistry Review 15: 27-30
- Shallcross D, Harrison T (2008a) Modelizado del Cambio Climático en el aula. Science in School 9. www.scienceinschool.org/2008/issue9/climate/spanish
- Shallcross D, Harrison T (2008b) Practical demonstrations to augment climate change lessons. Science in School 10: 46-50. www.scienceinschool.org/2008/issue10/climate
- Shallcross D, Harrison T, Henshaw S, Sellou L (2009) Fomentando el interés hacia los combustibles: experimentos sobre el cambio climático. Science in School 11. www.scienceinschool.org/2009/issue11/climate/spanish
Web References
- w1 – Para mas información sobre las antocianinas y sus funciones maturales, vea Wikipedia: http://en.wikipedia.org/wiki/Anthocyanin
- w2 – La Hoja de Ruta Fotovoltaica de la Unión Europea del 2002 (The 2002 European Union Photovoltaic Roadmap) puede descargarse del sito web de PV-NET (http://paris.fe.uni-lj.si/pvnet) or desde: http://tinyurl.com/n8cwfv
- w3 – La compañía holandesa Mansolar: www.mansolar.com es un proveedor de kits de celdas de Grätzel
- w4 – Para más información sobre los fundamentos químicos de las celdas de Grätzel, consulte el sitio web de la Royal Society of Chemistry (www.rsc.org) o en: http://tinyurl.com/mr3bec
Resources
- Para una lista completa de los artículos Science in School sobre el cambio climático, consulte: www.scienceinschool.org/climatechange
- Para una lista completa de los artículos Science in School sobre energía, consulte: www.scienceinschool.org/energy
- La web SchoolCO2 ofrece información y material de enseñanza para medir y compartir datos de dióxido de carbono entre las escuelas de Europa: http://fwn-school-co2-net.hosting.rug.nl
Review
El artículo es un buen complemento a la trilogía anterior de artículos sobre el cambio climático de los mismos autores, sobre la modelización del clima (Shallcross et al, 2008a) y experimentos en el aula (Shallcross et al, 2008b, 2009). Esta vez, los autores destacan la parte tecnológica del tema del cambio climático. Proponen una actividad práctica como una posible alternativa a las celdas solares convencionales y una investigación sobre el contenido de CO2en distintos entornos, utilizando equipos profesionales que prestan a escuelas.
Recomiendo esta serie de artículos a los profesores de Ciencias de secundaria que busca un conjunto completo de materiales didácticos para abordar el complejo tema del cambio climático, el calentamiento global y los recursos energéticos. El estilo es lo suficientemente claro para hablantes de inglés no nativos y las referencias en la Web permiten profundizar sobre el tema. El artículo es también un valioso punto de partida para la planificación de un estimulante programa de estudios de ciencia interdisciplinar.
Algunas preguntas para ayudar en la comprensión del tema son:
- ¿Cuál de las siguientes afirmaciones acerca de antocianinas es verdadera?
- pueden realizar fotosíntesis artificial
- realizan la fotosíntesis en las plantas
- realizan la fotosíntesis en las plantas
- son químicamente estables
- ¿Cuál de las siguientes afirmaciones acerca de dióxido de titanio es falso?
- actúa como un semiconductor
- proporciona un soporte tridimensional para las moléculas de colorante
- tiene que ser horneado en la superficie del cristal
- es electroconductos
- Los sensores de dióxido de carbono pueden medir
- el efecto invernadero
- la absorción de la luz infrarroja
- la contaminación del aire
- la absorción de luz UV
Giulia Realdon, Italia





