Mercurio: una solución venenosa Understand article
Traducido por Alberto Fernández Martínez y Gabriel Pinto Cañón (Universidad Politécnica de Madrid). Sigrid Griet Eeckhout del Laboratorio Europeo de Radiación del Sincrotrón en Grenoble, Francia, investiga qué determina la toxicidad de los compuestos del mercurio y cómo los rayos X…

Imagen cortesía de Mark Evans/
iStockphoto
Los metales constituyen el 75% de los elementos conocidos. Pueden formar aleaciones entre sí y con no-metales y son ampliamente utilizados, por ejemplo, en coches, ordenadores, autopistas y puentes. La civilización se fundó sobre la base de los metales en la antigüedad, principalmente por oro, plata, cobre, mercurio, estaño, hierro y plomo. El oro se descubrió alrededor del 6000 a.C. y se ha hallado mercurio del 1600 a.C. Los antiguos griegos usaban el mercurio en ungüentos, y los romanos lo usaban en cosméticos. Desde el comienzo de la Era Industrial, los metales han penetrado lentamente en el ambiente, acumulándose en suelos, sedimentos y aguas superficiales.
Pequeñas cantidades de muchos elementos traza son de interés ecológico, debido a su necesidad como nutrientes o a su toxicidad como contaminantes. Los elementos nutrientes traza incluyen magnesio, manganeso, cobre y zinc, algunos de los cuales son tóxicos a elevadas concentraciones. Otros, incluyendo los elementos pesados como el mercurio, cadmio, arsénico y plomo, causan preocupación ambiental debido a su elevada toxicidad y a su uso industrial generalizado. El mercurio está presente en el medio ambiente a concentraciones inferiores al 0,1% pero es extremadamente tóxico debido a que se une a los grupos funcionales de diversos enzimas y proteínas, y de esta manera inhibe o afecta negativamente funciones orgánicas fundamentales.
El mercurio se emplea para extraer oro, y se encuentra en termómetros, amalgamas dentales, termostatos, relés, interruptores, barómetros, medidores de vacío y otros aparatos científicos, aunque las preocupaciones en torno a su toxicidad han desplazado ampliamente los termómetros de mercurio de su uso clínico.
El mercurio es un elemento traza con fuentes naturales (metal nativo, Hg, y mineral cinabrio, HgS) y antropogénicas (hechas por el hombre). Las fuentes antropogénicas comprenden los usos agrícolas (fungicidas) y metalúrgicos (minería y fundición), industrias plásticas, y deshechos. La mayor parte del mercurio en suelos, sedimentos y aguas de superficie proviene de la combustión de derivados del petróleo. Este metal volátil puede viajar largas distancias en su forma gaseosa o uniéndose a pequeñas partículas de polvo. El mercurio gaseoso puede permanecer en la atmósfera hasta un año, antes de ser depositado sobre la tierra mediante la lluvia.
Una vez depositados, los metales y metaloides (elementos con propiedades intermedias entre las de los metales y los no-metales) sufren procesos dinámicos biogeoquímicos en el medioambiente de la superficie terrestre, que es una mezcla de rocas, tierra, agua, aire y organismos vivos.
Los procesos biogeoquímicos afectan a la forma atómica del metal y, por tanto, a su solubilidad, movilidad, biodisponibilidad y toxicidad. Como regla general, cuanto menos soluble sea una especie, menos móvil y menos tóxica es. Por tanto, la transformación de especies solubles en formas difícilmente solubles, bien in situ o en terraplenes tras excavación, puede disminuir el impacto de los metales pesados peligrosos sobre los organismos vivos y su medio ambiente.

Imagen cortesía de Klaas Lingbeek-
van Kranen / iStockphoto
Los microorganismos pueden transformar los metales por medio de la oxidación-reducción u otras reacciones químicas. Un ejemplo de ello es otro metal pesado, como el cromo hexavalente, Cr(VI), que es una solución acuosa de cromo muy peligrosa. Ingerir grandes cantidades de Cr(VI) puede producir molestias gástricas y úlceras, convulsiones, daño renal y hepático, diversas formas de cáncer e incluso la muerte. El cromo trivalente, o Cr(III), por otra parte, es un nutriente traza esencial que ayuda al organismo a utilizar el azúcar, la proteína y la grasa. El Cr(III) es insoluble en agua. Reducir Cr(VI) a Cr(III) utilizando microorganismos lo hace insoluble en agua y, por tanto, limita su disponibilidad y toxicidad.w1
Este tipo de transformación puede también ocurrir de otras maneras. En los suelos, organismos microscópicos pueden transformar la forma inorgánica (no contiene compuestos de carbono) de mercurio, menos venenosa, en una forma venenosa, orgánica (que contiene carbono). En esta reacción, denominada metilación, un átomo, habitualmente el hidrógeno, es reemplazado por un grupo metilo (-CH3). Como ión cargado positivamente, el metilmercurio (CH3Hg+) se combina rápidamente con aniones como el cloruro (Cl–), hidróxido (OH–) o nitrato (NO3–).
La transformación de mercurio en un compuesto de metilmercurio produce una forma metálica que se hace lipofílica (se puede disolver en grasa) y puede por tanto, atravesar las membranas celulares, la barrera hemato-encefálica y la placenta. En esta forma orgánica puede entrar en la cadena alimentaria y acumularse en el pescado, en los animales que se alimentan de pescado y en el hombre. En otras palabras, la forma menos venenosa de mercurio, que es la inorgánica, que se excretaría de forma segura por los organismos, se transforma en una forma orgánica, que está disponible y es venenosa para los organismos..
Por tanto, ¿cómo se convierte la forma inorgánica de mercurio, menos venenosa, en una forma orgánica, venenosa? Investigadores suecos y norteamericanos utilizaron radiación de sincrotrón en el Laboratorio Europeo de Radiación de Sincrotrón para determinar la especiación del mercurio en materia orgánica natural en concentraciones relevantes para el medio ambiente, utilizando la técnica de espectroscopia por absorción de rayos X (XAS).
Encontraron que el mercurio en suelo orgánico natural se une a dos grupos de sulfuro orgánico reducido, principalmente tioles (-SH) . El grupo tiol es el equivalente sulfuro del grupo hidroxilo (-OH) que se encuentra en los alcoholes.
Experimentos de laboratorio indican que las especies neutras, inorgánicas, de mercurio-tiol y mercurio-sulfuro en solución, determinan las velocidades de metilación.
Esto significa que la unión de mercurio a los grupos tioles en la materia orgánica natural hace a este elemento disponible para las bacterias metiladoras del medio ambiente. Es más, desde que estos complejos mercurio-tiol se encuentran solubles, pueden ser movilizados y transportados a lugares donde hay bacterias metiladoras.
El siguiente paso es identificar el papel que distintas moléculas contenedoras de sulfuros, frecuentemente halladas en materia orgánica del suelo, juegan en la transformación del mercurio en sus formas venenosas.
El uso de la XAS para caracterizar la especiación del mercurio es muy novedosa. Es un gran paso hacia delante comparado con los métodos bioquímicos (fase líquida) anteriores y es la primera vez que concentraciones tan bajas de mercurio (como 0,1 gramos de mercurio por 1000 gramos de tierra) han podido ser medidas.
Descifrar la química de los metales y metaloides traza en el medio ambiente es difícil debido a que las materias naturales son complejas en su composición y estructura. Con la llegada de las fuentes de radiación sincrotrón avanzadas, que proporcionan técnicas que usan rayos X de alta intensidad y de una mayor resolución espacial, los científicos están en condiciones de determinar las formas y distribuciones de los metales en sistemas heterogéneos como los suelos, plantas e interacciones mineral-microbio-metal. Para hacer esto, se pueden aplicar juntas tres técnicas micro-analíticas. La técnica de fluorescencia por micro-rayos X puede realizar el mapa de la distribución de los distintos metales y ayudar a identificar las asociaciones de metales (Figura 3). Luego, la especie que contiene al metal (como arcilla o mineral) es determinada en puntos de interés en los mapas químicos por la difracción de micro-rayos X y micro XAS. Los patrones de difracción muestran la estructura interna del material. La proporción de cada especie en el conjunto del material es posteriormente calculada mediante combinación lineal del los diferentes componentes.
En conclusión, las técnicas de rayos X mediante la luz del sincrotrón son extremadamente valiosas para determinar las formas y distribución de los metales en los suelos, sedimentos y aguas de superficie. Una vez que conocemos la especiación del metal, podemos ver cómo limitamos su solubilidad y biodisponibilidad. Conforme la población y la economía mundiales continúan creciendo, especialmente en los países en desarrollo, la necesidad de metales aumentará pero su uso amplificará el potencial de contaminación del suelo y del agua. Ya que ello tendría graves implicaciones para la salud humana y la calidad del medio ambiente, los estudios medioambientales son extremadamente importantes.
Técnicas de rayos X (para lectores avanzados)
Para una explicación sencilla de estas dos técnicas, ver Capellas (2007).
Espectroscopía por absorción de rayos X (XAS)
Los rayos X son radiación con energías que oscilan entre 500 electrovoltios (eV) y 500 keV (1 keV es equivalente a 1000 eV).
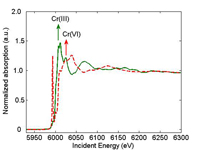
spectrum of a Cr(III) sample
(green) and Cr(VI) sample (red).
The arrow shows the position
of the absorption edge. au =
arbitrary unit.
Click on image to enlarge
Image courtesy of Sigrid Griet
Eeckhout
Cuando se hace una medición por espectroscopía por absorción de rayos X (XAS), se cambia la energía de los rayos X incidentes. Cuando la energía de los rayos X incidentes iguala la energía del enlace de un electrón de nivel central (habitualmente el electrón 1s), el electrón es expulsado del átomo. El espectro correspondiente de absorción de rayos X muestra una elevación puntiaguda, también conocida como pico de absorción (Fig. 1).
La posición del pico de absorción viene también determinada por el estado de oxidación formal. Por ejemplo, el pico de absorción de Cr(VI) aparece a mayor energía que el de Cr(III). El electrón saliente interactúa con los átomos colaterales, creando oscilaciones en el espectro más allá del pico. Estas oscilaciones proporcionan información sobre los átomos vecinos.
Ya que cada átomo tiene electrones cercanos al núcleo con energías de enlace de características bien definidas, la técnica de absorción de rayos X es específica para cada elemento. Esto significa que se puede estudiar un elemento determinado (por ejemplo mercurio) dentro de una materia heterogénea, tal como suelo formado por materia orgánica, microbios, minerales, metales, etc.
El espectro XAS es sensible al estado de oxidación formal (que refleja el número de electrones disponibles para unirse a otros átomos), a la química de coordinación (ej., coordinación octaédrica o tetraédrica) y a las distancias, número de coordinación y tipos de átomos que rodean al elemento seleccionado.
Fluorescencia de rayos X
Las energías de unión, de características bien definidas, de un elemento, se utilizan como una huella dactilar en la técnica de fluorescencia por rayos X. Cuando se cambia la energía y se observa un pico en una energía particular, se sabe que el elemento respectivo está presente (Fig. 2).
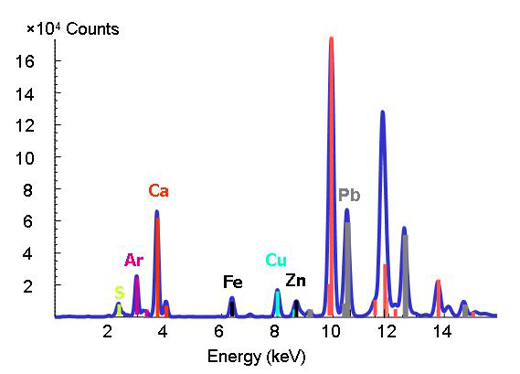
Imagen cortesía de ESRF
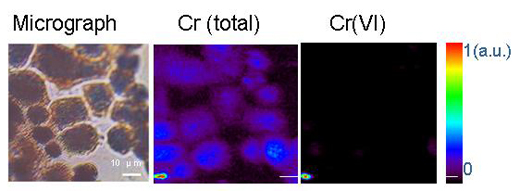
Reproducido con permiso de Chemical Research in Toxicology. Copyright (2005) American Chemical Society
References
- Capellas M (2007) Recuperando Pompeya. Science in School 6. www.scienceinschool.org/2007/issue6/pompeii/spanish
- Skyllberg U, Bloom PR, Qian J, Lin CM, Bleam WF (2006) Complexation of mercury(II) in soil organic matter: EXAFS evidence for linear two-coordination with reduced sulfur groups. Environmental Science & Technology 40: 4174-4180
- Este artículo fue elegido entre más de 1100 artículos de la revista Environmental Science and Technology como la contribución más importante a la ciencia de medio ambiente del año 2006.
Web References
-
w1 – Para discutir el cromo con referencia a la película Erin Brockovich, ver:
Stevens J (2007) Erin Brockovich. Science in School 4: 67-69. www.scienceinschool.org/2007/issue4/erinbrockovich/





