Νετρόνια και αντιψυκτικά: έρευνα στο αρκτικά ψάρια Understand article
Μετάφραση από: Ελισάβετ Ιωαννίδου (Elisavet Ioannidou) – Φοιτήτρια Βιολογίας, ΕΚΠΑ και Παναγιώτη Κ. Στασινάκη (Panagiotis K. Stasinakis) - Εκπαιδευτικός, Βιολόγος, MEd, PhD, Πανελλήνια…

(κοινώς: shorthorn sculpin)
έχει επίσης αντιψυκτικές
πρωτεΐνες.
Δημόσια εικόνα, πηγή
εικόνας: Wikimedia Commons
Όταν σκεφτόμαστε για την Αρκτική, πολλοί από εμάς σκεφτόμαστε παγόβουνα, πολικές αρκούδες και φώκιες. Θερμοκρασίες κατάψυξης, παγωμένοι άνεμοι και ακατοίκητες χιονισμένες έρημοι – μια πρόκληση για κάθε ζώο που ζει εκεί.

συνθήκες έχουν ωθήσει τα
ζώα να εξελίξουν μερικές
αξιοπρόσεκτες
προσαρμογές.
Ευγενική προσφορά της
εικόνας από ucumari, πηγή:
Flickr
Είμαστε εξοικειωμένοι με πολλούς από τους τρόπους με τους οποίους τα Αρκτικά ζώα έχουν προσαρμοστεί στο περιβάλλον τους: τη χοντρή γούνα των πολικών αρκούδων, το παχύ στρώμα λίπους στις φώκιες, τις μεταναστευτικές συνήθειες πολλών πτηνών. Αυτά τα ζώα, ωστόσο, είναι όλα ενδόθερμα – διατηρούν μια σταθερή θερμοκρασία σώματος, υψηλότερη από αυτή του παγωμένου περιβάλλοντός τους.
Για τα ψάρια, η κατάσταση είναι πολύ διαφορετική – τα περισσότερα είναι εξώθερμα, που σημαίνει ότι τα σώματά τους έχουν την ίδια θερμοκρασία με το περιβάλλον τους. Και το περιβάλλον τους είναι πραγματικά πολύ κρύο: ο Αρκτικός Ωκεανός συχνά φτάνει θερμοκρασίες πολύ χαμηλές, της τάξης του -1 οC, και δεν παγώνει λόγω της υψηλής περιεκτικότητας αλάτων του νερού.
Το αίμα των ψαριών, το οποίο περιέχει πολύ λιγότερα άλατα, θα αναμενόταν να παγώνει στους -0,5 οC. Για να το αποφύγουν αυτό, τα αρκτικά ψάρια έχουν εξελίξει εξειδικευμένες αντιψυκτικές πρωτεΐνες (AFPs – Antifreeze proteins).

εικόνας από τη Rita Willaert,
πηγή: Flickr
Οι AFPs έχουν έναν περίπλοκο ρόλο. Για να προστατέψουν το ψάρι από το να παγώσει μέχρι θανάτου, πρέπει να συνδεθούν με το σχηματιζόμενο πυρήνα κρυστάλλων πάγου στο σώμα του ψαριού, εμποδίζοντάς τον από το να μεγαλώσει και να γίνει πλήρης κρύσταλλος πάγου. Πώς, ωστόσο, ξεχωρίζουν τον πάγο από το υγρό νερό;
Οι AFPs έχουν μελετηθεί εκτενώς με τη χρήση πολλών τεχνικών, συμπεριλαμβανομένης της διάθλασης των ακτίνων Χ, αποκαλύπτοντας την ύπαρξη μιας εξειδικευμένης επιφάνειας σύνδεσης με τον πάγο.
Η τεχνική της διάθλασης ακτίνων Χ βασίζεται στο βαθμό στον οποίο οι ακτίνες αυτές διασκορπίζονται (διαθλώνται) από το ηλεκτρονιακό νέφος κάθε ατόμου. Πολλά μόρια έχουν διακριτά μοτίβα διάθλασης. Όμως, τα άτομα υδρογόνου (και δευτερίου), τα οποία έχουν μόνο ένα ηλεκτρόνιο, μετατοπίζουν τη διεύθυνση των ακτίνων πολύ λίγο (Σχήμα 1α, κάτω), με αποτέλεσμα το σήμα διάθλασης των ακτίνων Χ για το νερό (H2O) να είναι αρκετά όμοιο με αυτό για το οξυγόνο (Ο). Ως αποτέλεσμα αυτού, όταν οι επιστήμονες προσπάθησαν να εξετάσουν πώς η επιφάνεια σύνδεσης με τον πάγο επιδρά με αυτόν, δεν μπορούσαν να ταυτοποιήσουν όλα τα μόρια νερού πάνω στην επιφάνεια.
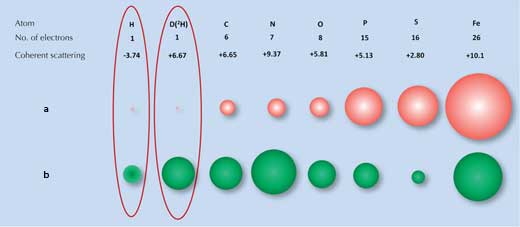
Α) οι ακτίνες Χ διασκορπίζονται από τα ηλεκτρόνια με την ισχύ του διασκορπισμού (διαστάσεις των κόκκινων σφαιρών) να είναι ανάλογη του αριθμού των ηλεκτρονίων.
Β) τα νετρόνια διασκορπίζονται από τους πυρήνες, με την ισχύ του διασκορπισμού (διαστάσεις πράσινων σφαιρών) να εξαρτάται από τις συγκεκριμένες πυρηνικές δυνάμεις.
Ευγενική προσφορά της εικόνας από τον Matthew Blakeley

τις αντιψυκτικές πρωτεΐνες
του ψαριού Zoarces
americanus (κοινώς: ocean
pout).
Ευγενική προσφορά της
εικόνας από τον Derek Keats,
πηγή: Flckr
Εδώ είναι που μια δεύτερη τεχνική, η διάθλαση των νετρονίων, είναι ωφέλιμη. Τα νετρόνια διασκορπίζονται από τους ατομικούς πυρήνες αντί των ηλεκτρονίων και το μέγεθος της μεταβολής αυτής σχετίζεται με τις δυνάμεις που ασκεί ο κάθε πυρήνας. Αυτές οι δυνάμεις με τη σειρά τους δε σχετίζονται μόνο με το στοιχείο αλλά και με τα ισότοπά του, τα οποία διαφέρουν στον αριθμό νετρονίων του πυρήνα τους (Σχήμα 1β, πάνω). Ευτυχώς για εμάς, τα άτομα του υδρογόνου μπορούν εύκολα να ανιχνευθούν από τη διάθλαση των νετρονίων και το ισότοπο του υδρογόνου δευτέριο (βαρύ υδρογόνο, το οποίο έχει ένα ακόμα νετρόνιο) μπορεί να ανιχνευθεί με μεγαλύτερη ακρίβεια. Έτσι, το σήμα από το νερό είναι σημαντικά διαφορετικό από αυτό του οξυγόνου.
Εμείς (ο Matthew Blakeley και οι επιστημονικοί συνεργάτες του) αποφασίσαμε να ερευνήσουμε έναν τύπο AFP που βρέθηκε στο αίμα των Αρκτικών ψαριών: τις AFPs τύπου ΙΙΙ. Για να αποφύγουμε τα προβλήματα που αντιμετώπισαν άλλοι ερευνητές, χρησιμοποιήσαμε ένα συνδυασμό διάθλασης ακτίνων Χ και νετρονίων για να εξετάσουμε τη δομή της πρωτεΐνης και τις αλληλεπιδράσεις της με τα μόρια του νερού. Για τα πειράματά μας χρησιμοποιήσαμε τις εγκαταστάσεις στο Ινστιτούτο Laue-Langevin (ILL)w1 και στην Ευρωπαϊκή Μονάδα Ακτινοβολίας Συγχροντρονίων (ESRFw2, δείτε, πλαίσιο, κάτω). Η έρευνα νετρονίων με τόσους μικρούς όγκους κρυστάλλων, ήταν δυνατή μόνο χάρη στην πρόοδο που έλαβε χώρα στο ILL μέσα στα προηγούμενα λίγα χρόνια, τόσο στην προετοιμασία των δειγμάτων όσο και στον εξοπλισμό.
Καθώς είναι τυπικό στις έρευνες της δομής των πρωτεϊνών, εισαγάγαμε το συνθετικό γονίδιο της AFP τύπου ΙΙΙ στο Escherichia coli, όπου υπερεκφράστηκε, επιτρέποντάς μας να συλλέξουμε επαρκείς ποσότητες πρωτεΐνης. Τα βακτήρια στην καλλιέργειά τους προμηθεύονταν βαρύ ύδωρ (το οποίο περιείχε δευτέριο αντί για κανονικά άτομα υδρογόνου), για να βεβαιωθούμε ότι η προκύπτουσα πρωτεΐνη θα ήταν δευτεριωμένη: οι θέσεις όλων των ατόμων Η (υδρογόνου) θα ήταν καλυμμένες από δευτέριο. Έπειτα, κρυσταλλώσαμε την πρωτεΐνη έτσι ώστε να μπορούμε να καθορίσουμε τη δομή, ελέγχοντας ότι η δευτεριωμένη μορφή είχε την ίδια δομή με την κανονική μορφή (δείτε Cornuéjols, 2009, και Blattmann & Sticher, 2009, για περισσότερα σχετικά με την κρυσταλλογραφία ή ακόμα και να δοκιμάσετε μόνοι σας).
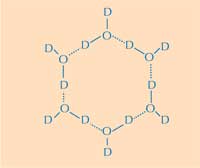
δακτύλιος του νερού. D =
Δευτέριο, O = Οξυγόνο. Κλικ
στην εικόνα για μεγέθυνση.
Ευγενική προσφορά της
εικόνας από τον Nicola Graf
Μέρος της απάντησης στο πώς οι AFPs τύπου ΙΙΙ διακρίνουν τον πάγο από το υγρό νερό, βρίσκεται στον τρόπο που η δομή των AFPs διαφέρει από αυτή των τυπικών πρωτεϊνών ο οποίες κανονικά έχουν τα υδρόφοβα αμινοξέα στον πυρήνα (μακριά από τα μόρια νερού του περιβάλλοντός τους) και τα υδρόφιλα αμινοξέα στην επιφάνεια. Όπως έχει δειχθεί από προηγούμενους ερευνητές, οι AFPs είναι ασυνήθιστες, έχοντας πολλά υδρόφοβα αμινοξέα στην επιφάνειά τους, αποτρέποντας την ένωση της πρωτεΐνης με το νερό μέσω δεσμών υδρογόνου. Αυτά τα υδρόφοβα αμινοξέα αποτελούν τμήμα της επιφάνειας σύνδεσης με τον πάγο, η οποία ενώνεται με τον πυρήνα του πάγου αλλά όχι με το υγρό νερό. Πώς δουλεύει αυτό;
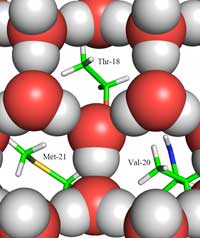
μεταξύ πάγου (ως κόκκινες
και γκρι σφαίρες) και της
επιφάνειας επαφής με τον
πάγο. Διακρίνονται οι
μεθυλομάδες των
υδρόφοβων καταλοίπων
Thr-18, Val-20 and Met-21,
τα οποία εφαρμόζουν στις
οπές της δομής του πάγου.
Κλικ στην εικόνα για
μεγέθυνση.
Copyright © 2011 John Wiley &
Sons, Ltd, πηγή εικόνας:
Howard et al. (2011)
Εδώ βρίσκεται το δεύτερο μέρος της απάντησης: πώς η δομή του πάγου διαφέρει από αυτή του υγρού νερού. Χρησιμοποιώντας τη διάθλαση νετρονίων, ήμαστε ικανοί να εντοπίσουμε τις θέσεις των μορίων νερού πάνω στην επιφάνεια σύνδεσης με τον πάγο. Ταυτοποιήσαμε μια τετραεδρική ομάδα μορίων νερού συνδεδεμένη στην πρωτεϊνική επιφάνεια σύνδεσης με τον πάγο. Αυτή η τετραεδρική ομάδα βρέθηκε στο υγρό νερό (όπως και στο πείραμά μας), αλλά ακόμα είναι τυπική και στον πάγο. Η παρατήρηση αυτή μας έδωσε το έναυσμα για να μοντελοποιήσουμε το υπόλοιπο του κρυστάλλου του πάγου και να συνάγουμε το πώς θα ενωνόταν με την AFP. Το μοντέλο που προέκυψε αποτελείται από εξαμελείς δακτυλίους μορίων νερού σε αυτό που είναι γνωστό ως διάταξη βάρκας: έξι μόρια νερού σε μια εξαγωνική διάταξη αφήνοντας μια οπή στη μέση (δείτε Εικόνα 2, πάνω). Είναι αυτή η οπή που δίνει την ικανότητα στην AFP τύπου ΙΙΙ να διακρίνει τη δομή του κρυστάλλου πάγου από το νερό: οι υδρόφοβες περιοχές του σημείου σύνδεσης με τον πάγο εφαρμόζουν μέσα στις οπές, συνδεόμενες με τον πάγο μέσω δυνάμεων Van der Waals (Εικόνα 3, αριστερά). Σε αντίθεση το υγρό νερό δεν έχει καμία οπή στην οποία οι υδρόφοβες περιοχές, όπως οι μεθυλομάδες, να μπορούν να εφαρμόσουν. Αυτό αποτρέπει μία μεγάλη επιφάνεια σύνδεσης, μεταξύ του υγρού νερού και της περιοχής σύνδεσηε με τον πάγο, το οποίο θα ήταν απαραίτητο για μια ισχυρή αλληλεπίδραση.

στα ψάρια της Αρκτικής
χωρίς τις αντιψυκτικές
πρωτεΐνες;
Ευγενική προσφορά της
εικόνας από dwleindecker /
iStockphoto
Παρ’ όλο που και άλλοι ερευνητές έχουν προτείνει ότι τα υδρόφοβα κατάλοιπα παίζουν ένα σημαντικό ρόλο στο πώς οι AFPs τύπου ΙΙΙ αναγνωρίζουν τους πυρήνες πάγου, αυτά είναι τα πρώτα πειραματικά δεδομένα που το επιβεβαιώνουν.
Από μόνο του, είναι ενδιαφέρον να μάθουμε περισσότερα στο πώς τα αρκτικά ψάρια επιβιώνουν στο περιβάλλον τους, αλλά αυτή η έρευνα έχει και πιθανές βιομηχανικές εφαρμογές. Ήδη οι AFPs τύπου ΙΙΙ έχουν εισαχθεί σε παγωτά για να μειώσουν τη δημιουργία μεγάλων κρυστάλλων πάγου και έτσι να βελτιώσουν τη συνοχή. Στο μέλλον γονίδια που κωδικοποιούν για τις AFPs μπορεί να εισαχθούν σε καλλιέργειες, για να τις επιτρέψουν να αναπτυχθούν σε περιβάλλοντα με θερμοκρασίες υπό του μηδενός.
Περισσότερα σχετικά με το ILL και το ESFR

Το Ινστιτούτο Laue-Langevin (ILL)w1 είναι ένα διεθνές ερευνητικό κέντρο, κορυφαίο στην επιστήμη και τεχνολογία των νετρονίων. Σε αυτό λειτουργεί μια από τις πιο ισχυρές πηγές νετρονίων στον κόσμο, τροφοδοτώντας δέσμες νετρονίων σε περίπου 40 όργανα υψηλής αποδοτικότητας, τα οποία συνεχώς αναβαθμίζονται.
Ως ινστιτούτο υπηρεσιών το ILL παρέχει τις εγκαταστάσεις και την τεχνογνωσία του σε επισκέπτες ερευνητές. Κάθε χρόνο γύρω στους 1200 ερευνητές, περισσοτέρων των 30 χωρών, επισκέπτονται το ILL στη Γκρενόμπλ της Γαλλίας. Περισσότερα από 800 πειράματα πραγματοποιούνται κάθε χρόνο, εστιαζόμενα κυρίως στη βασική έρευνα σε μια ποικιλία πεδίων: φυσική συμπυκνωμένης ύλης, χημεία, βιολογία, πυρηνική φυσική και επιστήμης των υλικών.
Η Ευρωπαϊκή Μονάδα Ακτινοβολίας Συγχροντρονίων (ESRF)w2 είναι ένα διεθνές ερευνητικό κέντρο, που μοιράζεται χώρο με το ILL, στη Γκρενόμπλ της Γαλλίας. Παράγει υψηλής «φωτεινότητας» δέσμες ακτίνων Χ οι οποίες εξυπηρετούν χιλιάδες επιστημόνων από όλο τον κόσμο, κάθε χρόνο.
Η συμπληρωματικότητα των δεσμών ακτίνων Χ του συγχροντρονίου μπορούν να μας βοηθήσουν να καταλάβουμε πώς λειτουργούν τα σύνθετα συστήματα, όπως οι AFPs που περιγράφηκαν στο άρθρο αυτό. Για να εκμεταλλευτούμε πλήρως τη συνεργασία συγχροντρονίου και επιστήμης νετρονίων, η ESRF και το ILL έχουν γίνει παράγοντες κλειδιά στη δημιουργία της Συνεργασίας για τη Δομική Βιολογία (PSB) και τη Συνεργασία για την Ελαφρά Συμπυκνωμένη Ύλη. Περισσότερες συνεργασίες αναμένονται στο άμεσο μέλλον.
Το ILL και το ESRF είναι μέλη του EIROforumw3, εκδότη του Science in School.
References
- Blattmann B, Sticher P (2009) Φτιάξτε μόνοι σας κρυστάλλους πρωτεΐνης. Science in School 11.
- Cornuéjols D (2009) Biological crystals: at the interface between physics, chemistry and biology. Science in School 11: 70-76.
- Howard EI, Blakeley MP et al. (2011) Neutron structure of type-III antifreeze protein allows the reconstruction of AFP–ice interface. Journal of Molecular Recognition 24: 724-732. doi: 10.1002/jmr.1130
Web References
- w1 – Για μάθετε περισσότερα για το ILL, δείτε: www.ill.eu
- w2 – Για να βρείτε περισσότερα για τα ESRF και PSB, δείτε www.esrf.eu και www.psb-grenoble.eu
- w3 – Για περισσότερες πληροφορίες για το EIROforum, δείτε: www.eiroforum.org
Institutions
Review
Αν ποτέ αναρωτήθηκες πώς τα ψάρια μπορούν να επιβιώσουν στους παγωμένους ωκεανούς, μπορείς να βρεις την απάντηση σε αυτό το πολύ ελκυστικό άρθρο, το οποίο ξεναγεί τον αναγνώστη σε μια επιστημονική έρευνα στη δομή των πρωτεϊνών και των αλληλεπιδράσεών τους.
Το άρθρο μπορεί να χρησιμοποιηθεί ως μελέτη υποβάθρου στη μελέτη βιομορίων ή ως βάση για συζήτηση σχετικά με το ρόλο των πρωτεϊνών στους ζωντανούς οργανισμούς. Κατάλληλες ερωτήσεις κατανόησης περιλαμβάνουν:
- Περιγράψτε πώς τα αρκτικά ψάρια έχουν προσαρμοστεί στα παγωμένα αρκτικά νερά.
- Με ποιον τρόπο οι AFPs δρουν ως αντιψυκτικό στο αίμα των ψαριών;
- Ποιοι είναι οι περιορισμοί της διάθλασης των ακτίνων Χ, όταν αναλύουμε τις AFPs;
- Πώς η διάθλαση νετρονίων διαφέρει από τη διάθλαση ακτίνων Χ;
- Περιγράψτε τα βήματα που ήταν απαραίτητα για την επιτυχή εξέταση της δομής των AFPs.
- Πώς οι AFPs διαφέρουν από άλλες πρωτεΐνες;
- Πώς οι AFPs διακρίνουν τον πάγο από το υγρό νερό;
Angela Charles, Μάλτα





