Ιώδεις ατμοί: η σημασία του ιωδίου Understand article
Μετάφραση από τον Λορέντζο Δημήτρη. Το ιώδιο, με τους χαρακτηριστικούς ιώδεις ατμούς, έχει μυριάδες εφαρμογές – από το γνωστό αντισηπτικό μέχρι πρωτοποριακές…

Η εικόνα είναι ευγενική
προσφορά της Eleanor A
Merritt
Τί είναι αυτό που κάνει το ιώδιο τόσο σημαντικό και ενδιαφέρον; Δεν είναι μόνο το ότι εξαχνώνεται σε ένα εντυπωσιακό μωβ αέριο, αλλά και το ότι επηρεάζει πολλές πτυχές της ζωής στη Γη και του ανθρώπινου πολιτισμού. Γνωρίζατε, για παράδειγμα, ότι το ιώδιο προστατεύει τα θαλάσσια φύκια από οξειδωτική βλάβη (για παράδειγμα από τον Ήλιο), αποτρέπει εγγενείς ανωμαλίες στον άνθρωπο, και έχει πολλές βιομηχανικές εφαρμογές;
Η ανακάλυψη του ιωδίου μπορεί να τοποθετηθεί στο 19ο αιώνα και τους Ναπολεόντειους πολέμους. Εξαιτίας της επιβολής αποκλεισμού στα ευρωπαϊκά λιμάνια από τους Βρετανούς, οι Γάλλοι βρέθηκαν αντιμέτωποι με ελλείψεις σε νιτρικό κάλιο (KNO3) για την κατασκευή μπαρουτιού. Έτσι, ο χημικός Bernard Courtois ερεύνησε τη δυνατότητα χρήσης φυκιών (καφέ φύκια,Laminaria sp.) ως πηγή καλίου για αυτή την σημαντική ουσία. Πρόσθεσε πυκνό θειικό οξύ σε τέφρα από φύκια και εξεπλάγη από τον όμορφο μωβ καπνό που παράχθηκε.

Louis Gay-Lussac, Γάλλου
φυσικού και χημικού, από
τον François Séraphin
Delpech (1778–1825)
Εικόνα δημόσιας κυριότητας
/ Wikimedia Commons
Αν και ο Courtois υποψιάστηκε ότι ο μωβ ατμός του ήταν ένα καινούριο στοιχείο, δεν είχε τα οικονομικά μέσα να συνεχίσει την έρευνά του. Οι συνάδελφοί του, όπως ο Joseph Gay-Lussac, ανέλαβαν την επιβεβαίωση των αποτελεσμάτων του και την ονομασία του στοιχείου ως ιώδιο, από την ελληνική λέξη ιώδης, που σημαίνει μωβ ή βιολετής.
Ο Gay-Lussac συνέχισε ερευνώντας τη χημεία του ιωδίου, και παρά τον πόλεμο, οι Γάλλοι χημικοί βρήκαν τρόπους να αλληλογραφούν με Βρετανούς χημικούς, κυρίως με τον Sir Humphry Davy. Αρχικά, ο Davy πίστευε ότι οι ατμοί ήταν μια ένωση του χλωρίου, ωστόσο σύντομα συμπέρανε ότι πράγματι ήταν ένα νέο στοιχείο.

φαιοφύκη, είναι οι
ισχυρότεροι συσσωρευτές
ιωδίου από όλα τα ζώντα
συστήματα. Η φωτογραφία
τραβήχτηκε στην ακτή στο
Dunstaffnage, κοντά στο
Oban, στη Σκωτία, στο
Ηνωμένο Βασίλειο
Η εικόνα είναι ευγενική
προσφορά του FCK
Με τη βοήθεια της φασματοσκοπίας απορρόφησης ακτίνων-Χ, γνωρίζουμε πλέον ότι τα φύκια συσσωρεύουν ιώδιο ως ιωδίδιο (Ι-), που δρα ως αντιοξειδωτικό για την προστασία από την οξειδωτική βλάβη που προκαλείται από το ατμοσφαιρικό όζον (O3). Αυτό εξηγεί ως ένα σημείο γιατί ίχνη μοριακού ιωδίου (I2) μπορούν να εντοπιστούν στην ατμόσφαιρα των παράκτιων περιοχών και γιατί η πρόσληψη ιωδίου από τους ανθρώπους στις περιοχές αυτές εξαρτάται από την αφθονία σε φύκια παρά από την εγγύτητα προς τη θάλασσα.
Στο μεγαλύτερο μέρος του επόμενου αιώνα, η εξαγωγή του ιωδίου εξακολούθησε να γίνεται από τα φύκια. Σήμερα, πάντως, αφαιρείται από φυσικές άλμες που περιέχουν ιώδιο, σε κοιτάσματα φυσικού αερίου και πετρελαίου στην Ιαπωνία και τις ΗΠΑ, είτε από τα Χιλιανά caliches (νιτρικά ορυκτά), που περιέχουν ιωδιούχο ασβέστιο (Ca(IO3)2). Το ιώδιο διατίθεται στην αγορά ως ένα μωβ-μαύρο στερεό.
Χημεία του ιωδίου
Το ιώδιο ανήκει στα αλογόνα, και κατά συνέπεια κατέχει πολλά από τα τυπικά χαρακτηριστικά των στοιχείων σε αυτήν την ομάδα. Λόγω της υψηλής ηλεκτραρνητικότητά του, το ιώδιο σχηματίζει ιωδίδια με τα περισσότερα στοιχεία στην τυπική κατάσταση οξείδωσης του,-Ι. Πολλές από τις ενώσεις που περιέχουν ιώδιο, χρησιμοποιούνται συχνά ως αντιδραστήρια στην οργανική σύνθεση – κυρίως για ιωδίωση, οξείδωση και σχηματισμό C–C δεσμού.
Το ιώδιο στην ατμόσφαιρα προέρχεται κυρίως από βιολογικές και χημικές διεργασίες στον ωκεανό – όπως το αντιοξειδωτικό σύστημα με ιωδίδιο στα φύκια. Το περισσότερο ιώδιο τελικά αφαιρείται από την ατμόσφαιρα με το σχηματισμό νεφών. Στον ωκεανό, το ιώδιο κυρίως διαλύεται και υφίσταται ως ιωδικό ανιόν (IO3–, οξειδωμένη μορφή) και ιωδίδιο (I–, ανιόν). Στον εξωτερικό φλοιό της Γης (λιθόσφαιρα), το περισσότερο ιώδιο βρίσκεται σε θαλάσσια και χερσαία ιζήματα, τα επίπεδα ιωδίου είναι χαμηλά σε πυριγενή πετρώματα.
Η σημασία του ιωδίου στη φυσιολογία
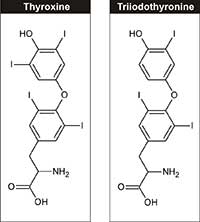
θυροξίνη (T4) και
τριιωδοθυρονίνη (T3)
Η εικόνα είναι ευγενική
προσφορά του Michael
Zimmermann
Στη φυσιολογία, το ιώδιο είναι ένα απαραίτητο στοιχείο, που απαιτείται για τη σύνθεση των θυρεοειδικών ορμονών – τριιωδοθυρονίνη και θυροξίνης – οι οποίες ρυθμίζουν την ανάπτυξη, την εξέλιξη και τον μεταβολισμό των κυττάρων. Η συνιστώμενη πρόσληψη ιωδίου για τη δίαιτα των ενηλίκων είναι 150 μg / ημέρα, που μπορεί να ληφθεί από τα γαλακτοκομικά προϊόντα, τα φύκια και το ιωδιωμένο επιτραπέζιο αλάτι.
Το κλασσικό σύμπτωμα της έλλειψης ιωδίου είναι η διεύρυνση του θυρεοειδούς (βρογχοκήλη). Καθώς πέφτει η πρόσληψη ιωδίου, ο αδένας της πρόσθιας υπόφυσης εκκρίνει αυξημένα επίπεδα ορμόνης που διεγείρει τον θυρεοειδή, σε μια προσπάθεια να μεγιστοποιηθεί η απορρόφηση του διαθέσιμου ιωδίου, αυτό οδηγεί σε υπερβολική ανάπτυξη του θυρεοειδούς αδένα.
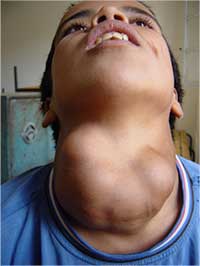
βροχοκήλη που οφείλεται σε
έλλειψη ιωδίου
Η εικόνα είναι ευγενική
προσφορά του Michael
Zimmermann
Όμως η πιο καταστροφική επίδραση της έλλειψης ιωδίου είναι στους αναπτυσσόμενους εγκεφάλους των βρεφών, που οδηγεί σε διανοητική υστέρηση. Επιπλέον, σοβαρή ανεπάρκεια ιωδίου κατά τη διάρκεια της εγκυμοσύνης συνδέεται με μια μεγαλύτερη συχνότητα εμφάνισης της θνησιγένειας, αποβολής και εγγενών ανωμαλιών.
Ο πιο αποτελεσματικός τρόπος για την πρόληψη της έλλειψης ιωδίου είναι η προσθήκη ιωδιούχου καλίου (ΚΙ) ή ιωδικό κάλιο (KIO3) στο επιτραπέζιο αλάτι. Αυτή η πρακτική του ιωδιωμένου αλατιούδιεξάγεται σε περίπου 120 χώρες, με περισσότερο από το 70% του παγκόσμιου πληθυσμού να έχουν πλέον πρόσβαση στο ιωδιωμένο αλάτι.
Βιομηχανικές χρήσεις του ιωδίου
Το ιώδιο και οι ενώσεις του χρησιμοποιούνται σε πολλά προϊόντα, από τρόφιμα και φαρμακευτικά προϊόντα, μέχρι ζωοτροφές και βιομηχανικούς καταλύτες. Για παράδειγμα, το ιώδιο είναι ένα ισχυρό αντιμικροβιακό. Για περισσότερο από έναν αιώνα, βάμμα ιωδίου – ένα μείγμα από αιθανόλη, νερό, ιώδιο και ιωδιούχο κάλιο – χρησιμοποιήθηκε ως αντισηπτικό για τις πληγές. Αυτό έχει πλέον αντικατασταθεί σε μεγάλο βαθμό από υδατοδιαλυτά ιονοφόρα (ιώδιο συμπλεγμένο με τασιενεργά), που είναι λιγότερο ερεθιστικά για το δέρμα. Για παράδειγμα, η ιωδιούχος ποβιδόνη (povidone-iodine), ένα μίγμα πολυβινυλοπυρρολιδόνης και ιωδίου, χρησιμοποιείται ευρέως στη χειρουργική αντισηψία.
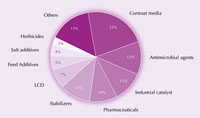
χρήσεις του ιωδίου
Η εικόνα είναι ευγενική
προσφορά του Tatsuo Kaiho
Για τη βιομηχανική παρασκευή οξικού οξέος, χρησιμοποιούνται ενώσεις ιωδίου όπως ιωδιούχο ρόδιο (μέθοδος Monsanto) ή ιωδιούχο ιρίδιο (διαδικασία Cativa της BP) για να καταλύουν την καρβονυλίωση της μεθανόλης.
Ο ιωδιούχος άργυρος (AgI), που χρησιμοποιήθηκε στις πρώτες φωτογραφικές πλάκες, σήμερα χρησιμοποιείται στη σπορά νεφών για την πρόκληση βροχής και τον έλεγχο του κλίματος. Επειδή το AgI έχει παρόμοια κρυσταλλική δομή με τον πάγο, μπορεί να προκαλέσει ψύξη παρέχοντας θέσεις για το σχηματισμό πυρήνων-συσσωματωμάτων. Αυτό έγινε στους Ολυμπιακούς Αγώνες του Πεκίνο το 2008 για την αποφυγή βροχόπτωσης κατά τη διάρκεια των τελετών έναρξης και λήξης.

210 έχει στις πλευρές του
δύο γεννήτριες ιωδιούχου
αργύρου για σπορά νεφών.
Η εικόνα είναι ευγενική
προσφορά του Christian
Jansky / Wikimedia
Λόγω του υψηλού ατομικού βάρους (126.9) και του μεγάλου αριθμού ηλεκτρονίων, το ιώδιο απορροφά άριστα τις ακτίνες-Χ και χρησιμοποιείται στα μέσα αντίθεσης ακτινολογίας. Αυτές οι ουσίες είναι γενικά ασφαλείς ώστε να χορηγηθούν σε ανθρώπους και επιτρέπουν την οπτικοποίηση των μαλακών ιστών σε ακτινογραφικές εξετάσεις.
Μια πιο καθημερινή εφαρμογή του ιωδίου γίνεται στις οθόνες υγρών κρυστάλλων στις τηλεοράσεις, τους υπολογιστές και τα κινητά τηλέφωνα, που χρησιμοποιούν πολωμένο φιλμ για να φιλτράρουν το φως. Αυτές οι ταινίες συνήθως αποτελούνται από στρώματα πολυβινυλικής αλκοόλης με πρόσμιξη ιωδίου. Εδώ, το ιώδιο λειτουργεί ως παράγοντας διασύνδεσης και διασφαλίζει ότι η δομή είναι πολωμένη.
Το ιώδιο στη βιομηχανία της ενέργειας

Tricastin, στη Γαλλία,
βρίσκεται κοντά σε μια
πυκνοκατοικημένη περιοχή.
Περίπου κάθε πέντε χρόνια,
διανέμονται χάπια
ιωδιούχου καλίου σε όσους
κατοικούν σε κοντινή
απόσταση για να
αποτραπεί βλάβη στο
θυρεοειδή αδένα τους σε
περίπτωση πυρηνικού
ατυχήματος.
Η εικόνα είναι ευγενική
προσφορά του AIEA /
Wikimedia
Το ιώδιο χρησιμοποιείται σε ένα από τα πιο ελπιδοφόρα ηλιακά κύτταρα της αγοράς για την παραγωγή χαμηλού κόστους «πράσινης ενέργειας»: το φωτοευαισθητοποιημένο με χρωστική ουσία ηλιακό κύτταρο από οξείδιο του τιτανίου. Επίσης γνωστό ως κύτταρο Grätzel, ονομασμένο από έναν από τους εφευρέτες του, αποτελείται από ηλεκτρολύτες πολυϊωδιδίου που λειτουργεί ως το στρώμα μεταφοράς του φορτίου μεταξύ της καθόδου και της ανόδου (για να μάθετε περισσότερα, δείτε Shallcross et al., 2009).
Από τα 37 γνωστά ισότοπα του ιωδίου, όλα εκτός από ένα, το 127I, είναι ραδιενεργά. Τα περισσότερα από αυτά τα ραδιοϊσότοπα, τα οποία παράγονται μέσω αντιδράσεων σχάσης στα πυρηνικά εργοστάσια και όπλα, είναι βραχύβια, γεγονός το οποίο τα καθιστά χρήσιμα ως ανιχνευτές και θεραπευτικές ουσίες στην ιατρική. Για παράδειγμα, ισότοπα ιωδίου μπορούν να χρησιμοποιηθούν για την απεικόνιση του θυρεοειδούς αδένα, ο οποίος απορροφά το ραδιενεργό ιώδιο όταν αυτό εγχύεται στην κυκλοφορία του αίματος.
Δυστυχώς, το ραδιενεργό 131I που απελευθερώνεται από πυρηνικά ατυχήματα – όπως η καταστροφή στη Φουκουσίμα, στην Ιαπωνία, το 2011 – απορροφάται εξίσου από το θυρεοειδή. Επειδή εκπέμπει υψηλής ενέργειας β-σωματίδια, καταστρέφει τα κύτταρα και προκαλεί καρκίνο. Για να αντισταθμιστεί αυτό το αποτέλεσμα, γίνεται κατάποση δισκίων μη-ραδιενεργού ιωδιούχου καλίου (ΚΙ) ώστε να κορεστεί η ικανότητα του θυρεοειδούς να προσλάβει το ραδιενεργό ιώδιο.
Αυτά είναι μόνο ένα μικρό δείγμα από τις πολλές εφαρμογές του ιωδίου. Προφανώς, παρ’ όλο που το στοιχείο είναι γνωστό εδώ και μόλις διακόσια χρόνια, έχει καθιερωθεί στη σύγχρονη χημεία, τη φυσική και την ιατρική.
Το ιώδιο στην τάξη
Δεν υπάρχει αμφιβολία ότι είμαστε όλοι εξοικειωμένοι με το πολύχρωμο πείραμα “ρολόι ιωδίου” μεταξύ υπεροξειδίου του υδρογόνου, ιωδιούχου καλίου, αμύλου και θειοθειϊκού νατρίου – αλλά υπάρχουν και άλλοι τρόποι για να εισαγάγει κανείς στην πράξη το ιώδιο στην τάξη. Για παράδειγμα:
- Όταν καταλύονται από το νερό, το αλουμίνιο και το ιώδιο αντιδρούν για την παραγωγή θεαματικών νεφών από μωβ ατμούς ιωδίου.
- Σε μια άμεση αντίδραση ενός μετάλλου με ένα αμέταλλο, σκόνη ψευδαργύρου αντιδρά με διάλυμα ιωδίου και αιθανόλης για να σχηματίσει ιωδιούχου ψευδάργυρο δίνοντας μία εξώθερμη αντίδραση οξειδοαναγωγής.
- Ιωδιούχο κάλιο μπορεί να χρησιμοποιηθεί για την ανίχνευση της παρουσίας αμύλου σε διάφορα τρόφιμα.
- Διάφορα διαλύματα, συμπεριλαμβανομένου του υδατικού διαλύματος ιωδιούχου νατρίου, μπορούν να υποβληθούν σε ηλεκτρόλυση και μπορεί να γίνει αναγνώριση των προϊόντων στα ηλεκτρόδια. Οι μαθητές στη συνέχεια με βάση την πρακτική εμπειρία και την θεωρητική γνώση τους μπορούν να κατασκευάσουν απλές ιοντικές εξισώσεις.
Λεπτομέρειες για αυτά και πολλά άλλα σχολικά πειράματα μπορείτε να κατεβάσετε από την ιστοσελίδαw1 Learn Chemistry.
Ευχαριστίες
Το άρθρο αυτό προήλθε από μια πολύ μεγαλύτερη δημοσίευση στο Angewandte Chemie International Edition (Küpper et al., 2011).
References
- Küpper FC, Feiters MC, Olofsson B, Kaiho T, Yanagida S, Zimmermann MB, Carpenter LJ, Luther GW, Lu Z, Jonsson M, Kloo L (2011) Commemorating two centuries of iodine research: an interdisciplinary overview of current research. Angewandte Chemie International Edition 50: 11598-11620. doi: 10.1002/anie.201100028
- Shallcross D, Harrison T, Henshaw S, Sellou L (2009) Κοιτώντας στους ουρανούς: πειράματα για την αλλαγή του κλίματος. Science in School 12: 34-39.
Web References
-
w1 – Η ιστοσελίδα Learn Chemistry της Βασιλικής Ακαδημίας Χημείας του Ηνωμένου Βασιλείου προσφέρει ένα ευρύ φάσμα υλικού που μπορείτε να κατεβάσετε για την υποστήριξη της διδασκαλίας και μάθησης της χημείας.
Review
Σε αυτήν τη συνοπτική ενημέρωση για το στοιχείο ιώδιο, οι συγγραφείς καθοδηγούν τον αναγνώστη μέσα από την ιστορία και τις πολλές εφαρμογές αυτού του σημαντικού στοιχείου, από την ιατρική έως τη βιομηχανία και την παραγωγή ενέργειας. Οι προτάσεις για σχολικά εργαστηριακά πειράματα κάνουν το θέμα πιο ενδιαφέρον και ελκυστικό.
Δεδομένου του απλού και ξεκάθαρου ύφους, θα πρότεινα αυτό το άρθρο όχι μόνο στους Ευρωπαίους καθηγητές αλλά και στους μαθητές τους ηλικίας 13-18. Θα μπορούσε να χρησιμοποιηθεί σε μαθήματα χημείας (περιοδικός πίνακας, αλογόνα), βιολογίας (ενδοκρινείς αδένες, ο θυρεοειδής και οι ασθένειές του) και φυσικής (ισότοπα, ραδιενέργεια και ηλιακές κυψέλες). Υπάρχει επίσης η ευκαιρία για μια διαθεματική αντιμετώπιση της ιστορίας της επιστήμης (ανακάλυψη των στοιχείων), του ρόλου των επιστημόνων στην ανάπτυξη όπλων, ή των σχέσεων μεταξύ επιστημόνων αντιμαχόμενων χωρών εν καιρώ πολέμου.
Κατάλληλες ερωτήσεις κατανόησης περιλαμβάνουν:
- Από το άρθρο, μπορείτε να συμπεράνετε ότι τα φύκια συσσωρεύουν ιώδιο:
- Για την οξείδωση του όζοντος της ατμόσφαιρας
- Για την απορρόφηση του όζοντος της ατμόσφαιρας
- Για την παραγωγή του όζοντος της ατμόσφαιρας
- Για να προστατευτούν από το όζον της ατμόσφαιρας.
- Αν δεν λάβουμε αρκετό ιώδιο:
- Ο θυρεοειδής αδένας μας μεγαλώνει / ατροφεί
- Ο αδένας της πρόσθιας υπόφυσης εκκρίνει λιγότερη / περισσότερη ορμόνη που διεγείρει τον θυρεοειδή
Giulia Realdon, Ιταλία





