Κατανοώντας τις γενετικές ασθένειες Understand article
Μετάφραση από Γιώργος Σφλώμος (George Sflomos). Η Sabine Hentze και η Martina Muckenthaler μιλάνε στη Lucy Patterson γύρω από την εργασία τους η οποία αφορά την ανίχνευση γενετικών ασθενειών…
προσφορά από alex-mit
/ iStockphoto
Στο πλαίσιο των πρόσφατων διαλέξεων με τίτλο SET-routesw1 Insight Lecturesw2, δύο επιστήμονες από τη Χαϊδελβέργη της Γερμανίας μίλησαν για την εργασία και την εμπειρία τους στον τομέα των γενετικών ασθενειών: η Sabine Hentze, είναι γιατρός που ειδικεύεται στην ανθρώπινη γενετική και τη γενετική συμβουλευτική και η Martina Muckenthaler είναι καθηγήτρια στο Κέντρο Παιδιατρικής του Πανεπιστημιακού Νοσοκομείου της Χαϊδελβέργης και εργάζεται πάνω στην κληρονομική ασθένεια της διαταραχής αποθήκευσης του σιδήρου, την κληρονομική αιμοχρωμάτωση (δείτε το κουτί).
Οι γενετικές ασθένειες προκαλούνται από ανωμαλίες στο DNA. Mπορεί να είναι απλά μια μετάλλαξη σε ένα μόνο νουκλεοτίδιο ενός γονιδίου, ή πιο περίπλοκες αλλαγές όπως διαγραφές και ανακατατάξεις περιοχών ή και ολόκληρων χρωμοσωμάτων.

και η Martina Muckenthaler
(δεξιά)
Η εικόνα είναι ευγενική
χορηγία από το EMBL
Photolab
Η ακεραιότητα του DNA απειλείται καθημερινά από μια σειρά παραγόντων που μπορούν να προκαλέσουν μεταλλάξεις, όπως η φυσική ακτινοβολία (για πειράματα ακτινοβολίας στην τάξη βλ. Peralta & Oliveira, 2009). Επιπλέον, η αντιγραφή ολόκληρης της αλληλουχίας DNA ενός κυττάρου κατά τη διάρκεια της μίτωσης δεν είναι μια απόλυτα ασφαλής διαδικασία. Ως εκ τούτου κάθε κύτταρο στο σώμα μας διατηρεί ένα στόλο από ένζυμα επιδιόρθωσης βλαβερών τροποποιήσεων του DNA που επιδιορθώνουν τις ζημιές. Ωστόσο υπάρχουν φορές που οι μεταλλάξεις διαφεύγουν του μηχανισμού επιδιόρθωσης και συσσωρεύονται στο DNA.
Αν συμβούν μεταλλάξεις σε σημαντικά γονίδια, τότε μπορεί να προκληθούν σοβαρές ασθένειες. Καθώς έχουμε δύο αντίγραφα από κάθε γονίδιο (ένα από τη μητέρα μας και ένα από τον πατέρα μας), οι μεταλλάξεις που βλάπτουν μόνο το ένα αντίγραφο ενός γονιδίου δεν δημιουργούν άμεσα προβλήματα, καθώς ακόμα φέρουμε ένα υγιές αντίγραφο.
Πράγματι, όλοι μας φέρουμε μεταξύ πέντε και δέκα υπολειπόμενων μεταλλάξεων χωρίς ούτε καν να το αντιληφθούμε. Μόνο οι κυρίαρχες μεταλλάξεις θα οδηγήσουν σε ασθένεια και αυτό στην περίπτωση που ακόμη και μόνο το ένα αντίγραφο ενός γονιδίου υποστεί βλάβη. Ωστόσο, και οι υπολειπόμενες μεταλλάξεις μπορούν να καταστούν προβληματικές, όταν τόσο η μητέρα όσο και ο πατέρας σας τυχαίνει να φέρουν από ένα μεταλλαγμένο αντίγραφο του ίδιου γονιδίου: στην περίπτωση αυτή υπάρχει ο κίνδυνος να κληρονομήσετε και τα δύο μεταλλαγμένα αντίγραφα. Αυτό μπορεί να προκαλέσει ασθένειες όπως η κυστική ίνωση και η δρεπανοκυτταρική αναιμία.
Όταν λείπουν ολόκληρα τμήματα των χρωμοσωμάτων ή έχουν αναστραφεί, ή ακόμη και ολόκληρα χρωμοσώματα έχουν διπλασιαστεί ή διαγραφεί, αυτές οι ανωμαλίες είναι συχνά θανατηφόρες. Στις περιπτώσεις αυτές το παιδί θα πεθάνει πριν ακόμη γεννηθεί ή θα οδηγήσει σε νοητική υστέρηση, δυσπλασίες και σύνδρομο Down.
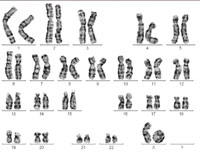
θηλυκού. Ένα από τα
χρωμοσώματα Χ σχηματίζει
αυτό που είναι γνωστό ως
δακτυλιοειδές χρωμόσωμα,
προκαλώντας σύνδρομο
Turner. Κάντε κλικ στην
εικόνα για μεγέθυνση.
Η εικόνα είναι ευγενική
προσφορά της Sabine Hentze
Είναι επίσης πιθανό να κληρονομήσουμε αυξημένη ευαισθησία σε συγκεκριμένες ασθένειες. Ορισμένες μεταλλάξεις, αν και οι ίδιες στην πραγματικότητα δεν προκαλούν ασθένειες, αυξάνουν δραματικά τον κίνδυνο ενός ατόμου για συγκεκριμένες ασθένειες: για παράδειγμα, οι κληρονομικές μεταλλάξεις στα γονίδια BRCA1 και BRCA2 οδηγούν σε αυξημένο κίνδυνο εμφάνισης του καρκίνου του μαστού.
Αποτελεί μέρος της δουλειάς της Sabine να διερευνήσει και να διαγνώσει αυτά τα είδη ασθενειών: “Μια τυπική κατάσταση είναι εκείνη όπου οι γονείς μου παρουσιάζουν το παιδί τους, λέγοντας μου: «Δεν έχει αναπτυχθεί σωστά σύμφωνα με την ηλικία του. Ο γιος του γείτονά μας που είναι της ίδιας ηλικίας είναι πολύ ψηλότερος, ήδη μπουσουλάει. Το δικό μου δεν μπορεί να το κάνει». Υπάρχουν διάφορα εργαλεία και διαθέσιμα τεστ, αλλά όταν πρόκειται να κάνει διάγνωση, η Sabine εξηγεί: Πρώτα απ’ όλα, στο κέντρο είμαστε εμείς, οι γιατροί, των οποίων η δουλειά είναι να κοιτάξουν, να ακούσουν, να εξετάσουν και να αξιολογήσουν. Μετά από διεξοδική κλινική εξέταση και με τη βοήθεια λεπτομερούς οικογενειακού ιστορικού, η Sabine μπορεί να είναι ήδη σε θέση να προβλέψει ποια μπορεί να είναι η υποκείμενη αιτία της διαταραχής ενός ασθενούς. Το επόμενο βήμα είναι να βρεθεί ποια είναι η μετάλλαξη που βρίσκεται στην καρδιά της νόσου.
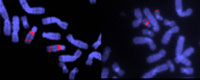
δεσμεύονται σε
υγκεκριμένες ακολουθίες
DNA. Σημειώστε τη
διαγραφή στο χρωμόσωμα
22 στο δείγμα στα δεξιά.
Αυτό προκαλεί το σύνδρομο
DiGeorge, το οποίο
χαρακτηρίζεται από την
απουσία θύμου και
παραθυρεοειδούς αδένα, και
έχει ως αποτέλεσμα την
εξασθένιση του
ανοσοποιητικού
συστήματος, το βραχύ
ανάστημα και τις
παραμορφώσεις του
προσώπου, της καρδιάς και
των μεγάλων αγγείων.
Η εικόνα είναι ευγενική
προσφορά του John Crolla,
Wellcome Images
Η ανάλυση χρωμοσωμάτων χρησιμοποιήθηκε για πρώτη φορά από τον Γάλλο γενετιστή και παιδίατρο Jérôme Lejeune, ο οποίος το 1959 διαπίστωσε ότι τα παιδιά που πάσχουν από το σύνδρομο Down είχαν ένα επιπλέον αντίγραφο του χρωμοσώματος 21. Ακόμη και σήμερα υπάρχουν πολλά ερωτήματα που μπορούν να απαντηθούν πληρέστερα χρησιμοποιώντας αυτή την τεχνική παρά μια γενετική εξέταση: κύτταρα που λαμβάνονται από τον ασθενή καλλιεργούνται στο εργαστήριο, ενώ στη συνέχεια φιξάρονται και χρωματίζονται έτσι ώστε τα χρωμοσώματα τους να μπορούν να μελετηθούν στο μικροσκόπιο.
Ωστόσο, όταν ορισμένες ασθένειες προκαλούνται από πολύ μικρές χρωμοσωμικές αναδιατάξεις ή διαγραφές και δεν μπορούν να παρατηρηθούν με τη συμβατική ανάλυση χρωμοσωμάτων, τότε χρησιμοποιείται μια τεχνική που ονομάζεται FISH (φθορίζοντα in situ υβριδισμός). Μικρά φθορίζοντα ιχνηθετημένα μόρια DNA σχεδιασμένα ειδικά για να υβριδίστουν, ή πιο απλά να συγκολλήθουν, σε μια συγκεκριμένη αλληλουχία στην περιοχή του χρωμοσώματος που πιστεύεται ότι έχει την ανωμαλία. Έτσι οι γιατροί μπορούν να ελέγξουν αν και που συγκεκριμένα υβριδίζονται σε ένα δείγμα των χρωμοσωμάτων του ασθενούς.
Επομένως πότε λοιπόν χρησιμοποιούμε μια γενετική εξέταση; «Χρησιμοποιώ ένα γενετικό τεστ μόνο αν υποψιάζομαι έντονα μια συγκεκριμένη ασθένεια για την οποία γνωρίζουμε το γονίδιο και την πιθανή μετάλλαξη», λέει η Sabine.
Η αιμοχρωμάτωση, η ασθένεια που ειδικεύεται η Μαρτίνα, δεν είναι μόνο η πιο κοινή κληρονομική νόσος στον δυτικό κόσμο με 85-90% των περιπτώσεων στην Κεντρική Ευρώπη, ενώ προκαλείται από μια συγκεκριμένη απλή μετάλλαξη στο γονίδιο HFE (δείτε το κουτί παρακάτω). Αν οι ασθενείς φαίνεται ότι πάσχουν από τη νόσο ή ανησυχούν ότι υπάρχει στην οικογένειά τους, είναι δυνατόν να διεξαχθεί γενετική εξέταση για να αναζητηθούν μεταλλάξεις στο γονίδιο HFE. Το DNA του ασθενούς απομονώνεται, συνήθως από ένα δείγμα αίματος και τα νουκλεοτίδια του γονιδίου HFE στα οποία συμβαίνουν οι πιο κοινές σημειακές μεταλλάξεις, αλληλουχίζονται και συγκρίνονται με την αλληλουχία που βρίσκεται σε υγιή άτομα.
Αιμοχρωμάτωση
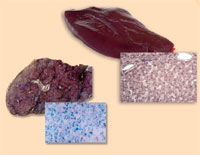
από αιμοχρωμάτωση
(δεξιά), σε σύγκριση με ένα
υγιές ήπαρ (αριστερά).
Σημειώστε την περίσσεια
σιδήρου (χρωματισμένο με
μπλε της Πρωσίας)
Οι εικόνες είναι ευγενική
προσφορά της Martina
Muckenthaler
Η αιμοχρωμάτωση είναι η πιο κοινή κληρονομική ασθένεια στον δυτικό κόσμο. Είναι μια κατάσταση που προκαλεί το σώμα να απορροφά και να αποθηκεύει επικίνδυνα υψηλά επίπεδα σιδήρου από τη διατροφή στο ήπαρ, την καρδιά, το πάγκρεας και άλλους ιστούς. Εκτός από τη χάλκινη χρώση του δέρματος, αυτό μπορεί τελικά να προκαλέσει ηπατική ανεπάρκεια, καρδιακή ανεπάρκεια ή διαβήτη, καθώς οι άνθρωποι, όπως και τα περισσότερα ζώα, δεν έχουν κανένα μέσο για να εκκρίνουν περίσσεια σιδήρου από τον οργανισμό τους.
Ο σίδηρος είναι ένα βασικό συστατικό της αιμοσφαιρίνης, του μορίου που είναι υπεύθυνο για τη μεταφορά του οξυγόνου στα ερυθρά αιμοσφαίρια. Επιπλέον, είναι ένας συμπαράγοντας κυτοχρωμάτων, πρωτεϊνών που είναι σημαντικές για την παραγωγή ενέργειας στην αναπνευστική αλυσίδα κάθε κυττάρου. Στο παρελθόν, παρατηρήθηκε ότι η πρακτική της αιμοληψίας με βδέλλες έμοιαζε να ανακουφίζει την ασθένεια. Στην πραγματικότητα, αυτό παραμένει το επίκεντρο της θεραπείας για την αιμοχρωμάτωσης ακόμη και σήμερα, αν και χωρίς τις βδέλλες.
Η σύνθεση νέων ερυθρών αιμοσφαιρίων βοηθάει στην απορρόφηση του σιδήρου. Αρχικά, η ασθένεια θεωρήθηκε ότι επηρέαζε μόνο τους άνδρες, και καθίσταται εμφανής μόνο στις ηλικίες των σαράντα και πενήντα. Ωστόσο, γνωρίζουμε τώρα ότι οι γυναίκες είναι εξίσου πιθανό να έχουν την ασθένεια, όμως η απώλεια αίματος μέσω της εμμήνου ρύσεως και της εγκυμοσύνης βοηθά φυσικά στην ανακούφιση των συμπτωμάτων.
Σε 85-90% των περιπτώσεων στην Κεντρική Ευρώπη, η αιμοχρωμάτωση προκαλείται από μία συγκεκριμένη μετάλλαξη στο γονίδιο HFE, που εντοπίζεται στο χρωμόσωμα 6. Πιστεύεται ότι έχει δημιουργήθηκε τυχαία 500 π.Χ. πριν σε ένα άτομο μιας φυλής της Κελτικής που ζούσε στην κοιλάδα του Δούναβη, και από εκεί εξαπλώθηκε σε όλη την Ευρώπη και με τους μετανάστες μεταδόθηκε στην Αμερική και την Αυστραλία. Στην Αυστραλία, μπορεί να αποδοθεί η προέλευση της σε έναν μόνο μετανάστη που μετέφερε τη μετάλλαξη. Ένας στους οκτώ ανθρώπους στον δυτικό κόσμο φέρει αυτή τη μετάλλαξη, αλλά δεδομένου ότι είναι υπολειπομένη, μόνο ένας στους 250 ανθρώπους θα αναπτύξει συμπτώματα αιμοχρωμάτωσης.
Ερευνητές όπως η Martina Muckenthaler πιστεύουν ότι είναι πιθανό η μετάλλαξη HFE να εξαπλωθεί ευρέως, καθώς παρέχει ένα επιλεκτικό πλεονέκτημα: «Ιστορικά, οι γυναίκες γεννούσαν πολλά παιδιά. Τόσο το αναπτυσσόμενο παιδί όσο και οι ίδιες οι γεννήσεις, οι οποίες είχαν ως αποτέλεσμα την απώλεια αίματος, αδειάζαν τα αποθέματα σιδήρου. Εκτός αυτού, υπήρχε πολύ λίγο κρέας για φαγητό, και καθώς αυτό περιέχει το περισσότερο σίδηρο στη διατροφή μας, ήταν πολύ δύσκολο να αναπληρωθούν τα αποθέματα σιδήρου. Επιπλέον, στο παρελθόν, οι άνθρωποι ζούσαν λιγότερο, οπότε τα συμπτώματα της νόσου δεν εξελίσσονταν. Αυτό σημαίνει ότι η μετάλλαξη του γονιδίου HFE ήταν ένα μεγάλο πλεονέκτημα από την άποψη της φυσικής επιλογής: τα άτομα με αυτή τη μετάλλαξη ήταν ικανά να αναπαραχθούν με επιτυχία καλύτερα από αυτά που δεν είχαν μετάλλαξη ».
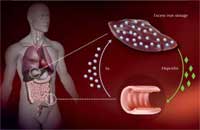
επαρκώς σε άτομα με
αιμοχρωμάτωση, οδηγώντας
σε υπερβολική πρόσληψη
σιδήρου στα έντερα και
υπερβολική αποθήκευση στο
ήπαρ.
Η εικόνα είναι ευγενική
προσφορά της Martina
Muckenthaler
Πώς όμως η μετάλλαξη αυτή προκαλεί υπερβολική πρόσληψη σιδήρου; Το σώμα απορροφά το σίδηρο στο έντερο μέσω μιας ειδικής πρωτεΐνης μεταφοράς. Στη συνέχεια, ο σίδηρος, μέχρι ότου χρειαστεί, αποθηκεύεται μέσα στα ηπατικά κύτταρα δεσμευόμενος σε μια πρωτεΐνη αποθήκευσης σιδήρου, τη φερριτίνη. Περίσσεια σίδηρου μπορεί να οδηγήσει στην παραγωγή ελευθέρων ριζών οξυγόνου, να καταστρέψει τα κύτταρα ακόμη και να τα σκοτώσει.
Για να διασφαλιστεί ότι δεν απορροφάτε υπερβολικός σιδήρου, το συκώτι υπολογίζει τη διαθέσιμη ποσότητα σιδήρου και η πληροφορία αυτή «μεταφράζεται» στην παραγωγή μιας ορμόνης «θερμοστάτης» των αποθηκών σιδήρου που ονομάζεται hepcidin – όσο περισσότερο σίδηρο τόσο περισσότερη hepcidin. Στο έντερο, η hepcidin καταστρέφει τις πρωτεΐνες των μεταφορέων σιδήρου, προκειμένου να μην δεχθούνε άλλο σίδηρο.
Η Martina έχει αναπτύξει μια ειδική μικροσυστοιχία που περιέχει 500 γονίδια που σχετίζονται με το μεταβολισμό του σιδήρου ενώ ως μοντέλο οργανισμού χρησιμοποιεί το ποντίκι. Με αυτήν τη μέθοδο, η ομάδα της συνέκρινε τη γονιδιακή δραστηριότητα των ηπατικών κυττάρων από υγιή ποντίκια με αυτή των ηπατικών κυττάρων από ποντίκια που τροποποιήθηκαν για να φέρουν τη μετάλλαξη στο γονίδιο HFE που προκαλεί αιμοχρωμάτωση στους ανθρώπους. Διαπίστωσαν ότι με τη μετάλλαξη HFE, η hepcidin δεν επάγεται επαρκώς ακόμη και όταν υπάρχει περίσσεια σίδηρου στο σώμα, προκαλώντας υπερβολική πρόσληψη σιδήρου. Μέσα από την έρευνά τους, τόσο η Μαρτίνα όσο και άλλοι ερευνητές προσπαθούν να κατανοήσουν αυτή τη διαδικασία με περισσότερες λεπτομέρειες.
Όταν τα παιδιά πάσχουν από μη ειδική νοητική ή σωματική αναπηρία, η αιτία μπορεί να είναι οι μεταλλάξεις σε μια σειρά γονιδίων σε διαφορετικά χρωμοσώματα. Εδώ, οι τεχνικές χρωματισμού χρωμοσωμάτων δεν έχουν την υψηλή ανάλυση για να αναγνωρίσουν το ελαττωματικό γονίδιο – ωστόσο, θα απαιτούσε πολύ σκληρή δουλειά για την αλληλουχία όλων των δυνητικά προσβεβλημένων γονιδίων ξεχωριστά. Σε αυτές τις περιπτώσεις, γενετιστές όπως η Sabine χρησιμοποιούν μια νέα τεχνολογία: οι μικροσυστοιχίες (για μια λεπτομερή εξήγηση των μικροσυστοιχιών και για το πώς θα μπορούσαν να διδαχθούν, δείτε Koutsos et al., 2009). Οι μικροσυστοιχίες επιταχύνουν σε μεγάλο βαθμό τη διαδικασία των γενετικών εξετάσεων καθώς μπορούν να εξετάσουν ταυτόχρονα δεκάδες ή εκατοντάδες χιλιάδες περιοχές του γονιδιώματος, και επομένως είναι δυνατόν να ανιχνευθούν ταυτόχρονα πολλές διαταραχές. Στο μέλλον, οι επιστήμονες ελπίζουν ότι θα μπορούσε να είναι δυνατή η ανάπτυξη μιας μικροσυστοιχίας που να μπορεί να χρησιμοποιηθεί για τον έλεγχο όλων των γενετικών ασθενειών και των προδιαθέσεων με ένα γρήγορο και απλό τεστ.
Η εικόνα είναι ευγενική
προσφορά του ktsimage /
iStockphoto
Κανένας γονέας δεν επιθυμεί να γεννηθεί το παιδί του με γενετική ασθένεια. Μέχρι πρόσφατα, η προγεννητική εξέταση ήταν η μόνη διαθέσιμη επιλογή για να καθοριστεί αν ένα μωρό θα γεννηθεί με μια σοβαρή διαταραχή. Ωστόσο, από την εμφάνιση της in vitro γονιμοποίησης έχει γίνει δυνατό να εξεταστεί η γενετική σύνθεση ενός εμβρύου προτού εμφυτευτεί στη μήτρα, μια τεχνική που ονομάζεται προεμφυτευτική γενετική διάγνωση.
Προς το παρόν, υπάρχουν πολλές δοκιμές για γνωστές γενετικές ασθένειες, επιτρέποντας σε γονείς που διακινδυνεύουν να μεταδώσουν μια γενετική ασθένεια να επιλέξουν ένα υγιές έμβρυο για εμφύτευση. Από πολλές απόψεις, πρόκειται για εξαιρετική είδηση, καθώς σημαίνει ότι οι μελλοντικοί γονείς δεν χρειάζεται να υποστούν την ταλαιπωρία της επεμβατικής εξέτασης για την ανίχνευση του εμβρύου στη μήτρα (γνωστή ως αμνιοπαρακέντηση, η οποία διατρέχει κίνδυνο για το μωρό), περιμένοντας τα αποτελέσματα και λαμβάνοντας την απόφαση να τερματίσει την εγκυμοσύνη αν το αποτέλεσμα είναι κακό.
Όσο περισσότερο μαθαίνουμε για τη γενετική βάση διαφόρων ασθενειών και χαρακτηριστικών και όσο εξελίσσονται οι μέθοδοι διαλογής, τόσο περισσότερο μπορούμε να βελτιώσουμε τις τεχνικές ανιχνεύσεις. Φυσικά, κανένας γονέας δεν θα ήθελε το παιδί του να υποφέρει από μια σοβαρή ασθένεια – αλλά τι γίνεται με λιγότερο σοβαρές διαταραχές όπως η αιμοχρωμάτωση, η συγγενής κώφωση ή ακόμα και η μυωπία; Ποιος λέει ότι ένα παιδί που μεγαλώνει με μια τέτοια κατάσταση δεν θα ζήσει ευτυχισμένη ζωή όπως και ένα κατά τα άλλα υγιές άτομο; Στην ουσία, το θέμα αυτό θέτει το ζήτημα του τι είναι το φυσιολογικό. Πού χαράζουμε τη γραμμή ως προς το ποιες είναι οι γενετικά καθορισμένες συνθήκες ή ποια χαρακτηριστικά είναι αποδεκτά και ποια όχι; Επιπλέον, θα ήταν ποτέ δυνατόν οι γονείς να έχουν τη δυνατότητα να επιλέξουν αν το παιδί τους θα είναι αγόρι ή κορίτσι, ή πόσο ψηλό ή ελκυστικό ή πόσο έξυπνο θα είναι;

χορηγία από το jgroup /
iStockphoto
Μια άλλη ερώτηση που τίθεται από τις γενετικές εξετάσεις είναι αν θα θέλατε πραγματικά να μάθετε τι ακριβώς φέρουν τα γονίδια σας. Τι γίνεται στην περίπτωση που θα διαπιστώσετε ότι έχετε υψηλό κίνδυνο να αναπτύξετε μια σοβαρή ασθένεια; Μπορεί να είστε σε θέση να προσαρμόσετε τον τρόπο ζωής σας για να καθυστερήσετε την εμφάνισή της ή να μειώσετε τα συμπτώματα, αλλά πώς θα αισθάνεστε αν γνωρίζατε τον κίνδυνο που σας απειλεί; Και τι θα γινόταν στην περίπτωση που οι ασφαλιστικές εταιρείες ή οι μελλοντικοί εργοδότες αποκτήσουν πρόσβαση σε αυτές τις πληροφορίες; Τι θα συνέβαινε αν υπήρχε ο κίνδυνος να κληρονομήσετε αυτή τη νόσο στα παιδιά σας; Θα θέλετε να το μάθει ο συνεργάτης σας; Μπορεί να διαφοροποιήσει τον τρόπο που θα αισθάνεται για σας; Για προτάσεις σχετικά με τον τρόπο παροτρύνσεως των συζητήσεων για τέτοια θέματα στην τάξη, βλ Strieth et al. (2008).
Σε αυτό ακριβώς το σημείο είναι πραγματικά απαραίτητο το έργο των γενετικών συμβούλων όπως η Sabine Hentze: «Εκτός από το εργαστηριακό μου έργο, ξοδεύω μεγάλο μέρος του χρόνου μου στη συμβουλευτική ασθενών, με άλλα λόγια στην επικοινωνία: τι φανερώνει το αποτέλεσμα της εξέτασης; Τι σημαίνει για μένα, για το παιδί μας, για την οικογένειά μας, για το μέλλον μας; »
Και είναι μέσα από το έργο των γενετικών συμβούλων που έχουμε συνειδητοποιήσει ότι ίσως ένα από τα σημαντικότερα ζητήματα στη γενετική εξέταση είναι ότι οι άνθρωποι έχουν επίσης το δικαίωμα να μην γνωρίζουν.
References
- Koutsos A, Manaia A, Willingale-Theune J (2009) Ψαρεύοντας γονίδια: Οι μικροσυστοιχίες DNA στην τάξη. Science in School 12.
- Peralta L, Oliveira C (2009) Radioactivity in the classroom. Science in School 12: 57-61.
- Strieth L et al. (2008) Γνωρίστε τη Γονιδιακή Μηχανή: προκαλώντας βιοηθικές συζητήσεις στο σχολείο. Science in School 9.
Web References
- w1 – Για περισσότερες πληροφορίες γύρω από τον οργανισμό SET-routes, προωθώντας τις γυναίκες στην επιστήμη, δείτε στην ιστοσελίδα www.set-routes.org
- w2 – Οι διαδραστικές επιστημονικές διαλέξεις SET-routes Insight Lectures είναι κατάλληλες για χρήση στα σχολεία. Παρουσιάζονται από εξαιρετικές γυναίκες επιστήμονες, οι διαλέξεις παρουσιάζουν τον συναρπαστικό κόσμο της επιστήμης, της μηχανικής και της τεχνολογίας (SET), και καλύπτουν τομείς τόσο διαφορετικούς μεταξύ τους όσο η επιστήμη του διαστήματος, η κλιματική αλλαγή, η γενετική συμβουλευτική, η αιμοχρωμάτωση και οι μικροσυστοιχίες DNA, η ελονοσία, τα βλαστοκύτταρα και η αναγέννηση, η αρχαιολογία του Σύμπαντος και η κοσμολογία. Δείτε: www.set-routes.org/lectures
Resources
- Τα παιχνίδια καρτών Democs για τη συζήτηση της προεμφυτευτικής διάγνωσης και των μη-συνταγογραφούμενων γενετικών εξετάσεων μπορείτε να τις κατεβάσετε δωρεάν εδώ: www.neweconomics.org/gen/democs.asp
- Για ένα άρθρο της επιστήμης στο σχολείο γύρω από το Democs, δείτε:
- Smith K (2007) Democs: a conversation card activity for teaching science and citizenship. Science in School 4: 27-19.
- Τα γονίδια είμαστε εμείς: ιστοσελίδα με ταινίες μικρού μήκους και δραστηριότητες για την τάξη σχετικές με τις γενετικές ασθένειες, δείτε: www.genesareus.org
- Για την εισαγωγή στις πιο κοινές γενετικές ασθένειες, δείτε τη Βιβλιοθήκη Γενετικών Διαταραχών (http://learn.genetics.utah.edu/content/disorders/whataregd) στην ενότητα μαθαίνω γενετική (http://learn.genetics.utah.edu), the Genetic Science Learning Center από το πανεπιστήμιο της Utah, Αμερική.
- Για να μάθεις περισσότερα γύρω από οξειδωτικές ρίζες στο σώμα σου και πώς να τις εξουδετερώσεις δες: Farusi G (2009) Αναζητώντας αντιοξειδωτικές τροφές. Science in School 13.
- Αν αυτό το άρθρο έχει ανοίξει την όρεξή σας, μπορείτε να βρείτε περαιτέρω πήγες για διάβασμα σχετικά με τις πιο τελευταίες εξελίξεις και σχετικά με τις γενετικές εξετάσεις και την προσωποποιημένη γονιδιωματική στο επιστημονικό blog του Daniel MacArthur, Genetic Future: http://scienceblogs.com/geneticfuture
Review
Οι κληρονομικές ασθένειες και τα διάφορα γενετικά σύνδρομα είναι πολύ σημαντικά για κάθε τάξη γενετικής: το θέμα είναι σχετικό για όλους τους μαθητές και θα τους ενθαρρύνει να εμπλέξουν την οικογένεια στην έρευνα για τα οικογενειακά δένδρα. Επίσης θα προξενήσει ακόμη περισσότερες συζητήσεις στην τάξη αν οι μαθητές είναι έτοιμοι να μιλήσουν για σπάνιες ασθένειες ή χρωμοσωμικές εκτροπές στην εκτεταμένη οικογένειά τους. Η αιμοχρωμάτωση είναι ένα ζήτημα που είναι ιατρικά διαχειρίσιμο. Είναι επίσης ένα καλό παράδειγμα ενός εξελικτικού πλεονεκτήματος που μπορεί ωστόσο να οδηγήσει σε αδιέξοδο όταν αλλάξει το περιβάλλον. Το θέμα αυτό υπόσχεται να προκαλέσει πολλές ενδιαφέρουσες συζητήσεις. Επιπλέον, το άρθρο περιγράφει τις κύριες τεχνικές που χρησιμοποιούνται σήμερα για την ανάλυση κληρονομικών διαταραχών, συμπεριλαμβανομένης μιας τεχνικής αιχμής που ονομάζεται μικροσυστοιχία.
Επιπλέον, το άρθρο περιγράφει όλες τις κύριες τεχνικές που χρησιμοποιούνται επί του παρόντος για την ανάλυση κληρονομικών διαταραχών, συμπεριλαμβανομένης μιας τεχνικής αιχμής, της μικροσυστοιχίας.
Πιθανά θέματα συζήτησης περιλαμβάνουν: Γενικά για τη γενετική ηθική, εξωσωματική γονιμοποίηση, προεμφυτευτική γενετική, οικογενειακός προγραμματισμός σε περιπτώσεις γνωστών ασθενειών και το ζήτημα του πότε αρχίζει η ζωή. Όλα αυτά είναι θέματα που σχετίζονται με την ηθική και τη θρησκεία.
Ακολουθούν μερικές προτάσεις για μαθητικές εργασίες σχετικές με το άρθρο:
- Σε έναν πίνακα, απαριθμήστε τις περιγραφόμενες τεχνικές και τη σκοπιμότητά τους για τον προσδιορισμό ενός κληρονομικού συνδρόμου ή ασθένειας.
- Συζητήστε τα χαρακτηριστικά κάθε τεχνικής σχετικά με την εγκυρότητά της για τον ασθενή.
- Συζητήστε «το δικαίωμα να γνωρίζετε» ή «να μην γνωρίζετε» και το ηθικό δίλημμα που αντιμετωπίζουν οι γιατροί όταν ανακαλύπτουν σοβαρές γενετικές μεταλλάξεις.
- Απεικονίστε την πρόσληψη και τη ρύθμιση του σιδήρου στους ανθρώπους χρησιμοποιώντας ένα διάγραμμα ροής ή εικόνες.
- Σχεδιάστε ένα διάγραμμα του μοτίβου κληρονομικότητας της μετάλλαξης στο γονίδιο HFE, χρησιμοποιώντας τη Μενδελική γενετική.
Friedlinde Krotscheck, Αυστρία





