Supporting materials
Download
Download this article as a PDF

Übersetzt von Bernhard Sturm. Erfreuen Sie sich an naturwissenschaftlichem Theater? Den Farben, dem Geruch, den Verwicklungen? Warum folgen Sie nicht Bernhard Sturms Empfehlungen: Lassen Sie Ihre Schüler durch das (Nach-)Spielen von Naturwissenschaften mehr Theater in den Fachraum bringen, um…

Darstellendes Spiel kombiniert Elemente der Kunst, der Musik und des Sports und fördert die Kreativität und Fitness von Schülern ebenso, wie deren emotionale und ästhetische Wahrnehmung. Als Gruppenübung entwickelt es auch die Kommunikations- und Kooperationsfähigkeit der jungen Lernenden. Warum also sollte man darstellendes Spiel nicht im naturwissenschaftlichen Unterricht einsetzen?
Dieser Artikel bietet eine Auswahl an darstellenden Übungen, um Naturwissenschaften im Chemie- und Physikfachraum nachzuspielen.
Dies ist eine Methode, um den Austausch von Sauerstoffatomen nach Lavoisier zwischen verschiedenen Metallatomen innerhalb der Redoxreihe zu veranschaulichen. Jeder Schüler trägt ein Mannschaftsleibchen in einer von drei Farben, die für die Atome von Sauerstoff und von zwei unterschiedlichen Metallen stehen. Es sollte dabei die gleiche Anzahl von jeder Farbe vorhanden sein. In Gruppen von 8 bis 10 Schülern führen die Schüler einfache Redoxreaktionen mit 1:1-Stöchiometrie durch, wie z.B. CuO + Fe → Cu + FeO, und präsentieren diese anschließend der gesamten Klasse. Die Schüler finden oftmals sehr kreative Wege, um sowohl die Aktivierungsenergie als auch die Energieabgabe in diesen Reaktionen darzustellen.
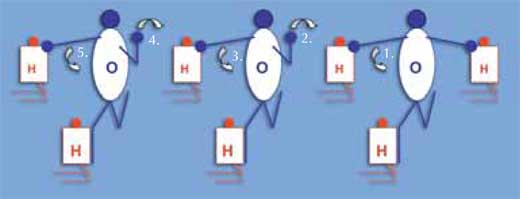
Die folgende Methode kann zur Veranschaulichung dienen, wie elektrische Ladungen ausgesprochen schnell durch Wasser hindurch übertragen werden, auch wenn keine Protonen wandern: Stattdessen wird eine positive Ladung übertragen. Die Schüler tragen Mannschaftsleibchen in einer von zwei Farben und stellen damit Wasserstoff- und Sauerstoff-Atome im Verhältnis 2:1 dar. Ordnen Sie sie in einer Reihe von Wasser-Molekülen an: Jedes Molekül besteht aus zwei (knienden) Wasserstoff- und einem (stehenden) Sauerstoff-Atom. Das Sauerstoff-Atom berührt ein Wasserstoff-Atom mit seiner oder ihrer rechten Hand und das andere Wasserstoff-Atom mit seinem oder ihrem rechten Fuß (siehe Diagramm rechts). Die Arme und Beine des Wasserstoff-Atoms haben keine Funktion. Ein zusätzliches Wasserstoff-Atom ist mit dem Sauerstoff-Atom durch Berührung mit seiner oder ihrer linken Hand an einem Ende der Reihe verbunden (H3O+). Die Arme und Füße der Sauerstoff-Schüler stehen für Elektronenpaare. Das überschüssige Elektronenpaar wandert von einem Ende der Wasser-Molekülreihe zum anderen, wenn das Sauerstoff-Atom im H3O+ Teilchen das Wasserstoff-Atom mit seiner oder ihrer rechten Hand loslässt. Stattdessen berührt das Sauerstoff-Atom des benachbarten Moleküls dieses Wasserstoff-Atom mit seinem oder ihrem linken Arm. Dies setzt sich dann über die gesamte Reihe fort.
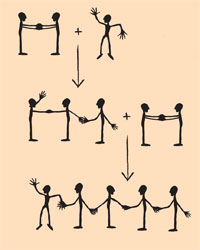
Die folgende Methode hilft beim Verständnis des Mechanismus der Polymerisierung und der Unterscheidung der Synthese von linearen und vernetzten Polymeren. Die Polymerisierung von Ethen wird mit allen Schülern sukzessive nachgestellt. Jeder Rumpf steht für ein Kohlenstoff-Atom, jeder Fuß für ein Wasserstoff-Atom und jeder Arm für ein bindendes Elektronenpaar. Ein einzelner Schüler, der ein Methylradikal darstellt, winkt mit seinem oder ihrem Arm, dem ungepaarten Elektron. Zwei Schüler halten sich mit beiden Händen als Doppelbindung zum Ethen-Molekül: Ein Atom des Ethen-Moleküls löst den Handgriff (bindendes Elektron) und bindet mit dem freien Elektron des Radikal-Moleküls (neuer Handgriff). Das entstehende Molekül mit drei Kohlenstoff-Atomen stellt wieder ein Radikal dar. Es geht mit einem weiteren Ethen-Molekül eine Bindung ein, usw. (siehe Darstellung links).
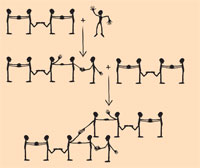
Dieses Modell kann erweitert werden, um die Vernetzung von Buta-1,3-dien darzustellen: Die das C2– und C3-Atom des Moleküls darstellenden Schüler berühren gegenseitig ihre Füße, um damit eine Einfachbindung zu symbolisieren (siehe Darstellung links). Das Hinzukommen eines Methylradikals führt dazu, dass sich eine der Doppelbindungen (doppelter Handgriff) im Buta-1,3-dien-Molekül löst und eine neue Einfachbindung (Handgriff) zwischen dem Methylradikal und z.B. dem C4-Atom gebildet wird. Das neu gebildete Molekül stellt wieder ein Radikal mit einem freien Elektron am C3-Atom dar. Das C1-Atom eines zweiten Buta-1,3-dien-Moleküls kann sich also verbinden, indem es seine Doppelbindung (doppelter Handgriff) löst und eine vernetzende Bindung (Handgriff) mit dem C3-Atom des ersten Moleküls bildet. Das resultierende Molekül mit 9 Kohlenstoff-Atomen ist wieder ein Radikal mit einem freien Elektron am C2-Atom des zweiten Buta-1,3-dien-Moleküls.
Die Abstände und Bewegungen von Wasser-Molekülen unterscheiden sich im festen, flüssigen oder gasförmigen Aggregatzustand. In dieser Übung spielen die Schüler Wasser-Teilchen. Aus meiner Erfahrung heraus führt man diese aufgrund des größeren freien Platzes am besten im Gelände durch. Dabei ist es hilfreich, die Klasse in Mädchen und Jungen aufzuteilen – eine Gruppe agiert, die andere schaut zu. Der Lehrer gibt den Schülern Regieanweisungen, wie diese sich umher bewegen sollen: Beginnend mit dem Winter (0 °C) stehen die Schüler ohne Bewegung in einer Gitteraufstellung. Es wird Frühling, dann Sommer und die Moleküle bewegen sich schneller (bis 40 °C), haben aber immer noch Kontakt zueinander. Schließlich enden die Moleküle in einem Kochtopf, werden erhitzt und verdampfen (100 °C).
In jeder Phase nimmt der Lehrer einen Schnappschuss auf, indem er „Halt!“ ruft. Die Darsteller (z.B. die Mädchen) und Zuschauer (z.B. die Jungen) beschreiben, was zuvor passiert ist und was sie nun um sich herum beobachten können.
Die Darsteller- und Zuschauergruppen wechseln anschließend die Rollen und die Moleküle „kühlen“ wieder auf 0 °C „herunter“.
Diese Übung kann abgewandelt werden, um die thermische Ausdehnung von Benzol darzustellen. 8 Schüler umstellen 20 andere mit einem locker gespannten Seil bis der Druck durch das „Erhitzen“ zu stark wird und die umstellenden Schüler gezwungen sind, das Seil fallen zu lassen.
Man kann das Gemälde An Experiment on a Bird in the Air Pumpw1 von Joseph Wright of Derby (1768) nutzen, um damit im Unterricht der Geschichte des Vakuums nachzugehen.
Teilen Sie die Klasse in Dreiergruppen auf und geben Sie jeder Gruppe einen Nachdruck des Gemäldes und ein Arbeitsblatt, auf dem die Umrisse und die wesentlichen Utensilien dargestellt sind (siehe Bild rechts, das im weltweiten Netzw2 herunter geladen werden kann). Die folgenden drei Fragen sollten die Diskussion anregen:



Nach der Diskussion wird die gesamte Szene durch die Schüler mit einer Vakuumpumpe und einem „Schokokuss“ (einem kleinen mit Schokolade überzogenen Schaumkeks) als Ersatz für den Vogel nachgestellt.
Diese Übung ist dazu geeignet, die Vorstellung von Elektronen als sich bewegenden und Energie transportierenden Ladungen einzuführen. Ein Schüler stellt die Energiequelle dar (eine Batterie): er oder sie gibt Gummibär-Tütchen aus (Energie). Auf der anderen Seite des Unterrichtsraums steht ein anderer Schüler als „Verbraucher“ von Energie: er oder sie sammelt die Gummibär-Tütchen. Sie können ein paar Tische in der Mitte des Raumes nutzen, um einen Kreis zu abzugrenzen.
Die restlichen Schüler repräsentieren die Elektronen: Sie stellen sich an der Energiequelle in einer Schlange an und erhalten nach und nach Gummibär-Tütchen, begeben sich dann in den „Stromkreis“, gehen zum „Verbraucher“ und liefern dort ihre Süßigkeit (Energie) ab. Der „elektrische Kreislauf“ findet so lange statt bis der ausgebende Schüler keine Tütchen mehr hat. Die Batterie ist dann entladen. Diese Übung kann auch auf Parallel- und Reihenschaltung übertragen werden.

Diese Darstellung hilft bei der Veranschaulichung, dass die Leitfähigkeit von Metallen mit steigender Temperatur abnimmt, was ansonsten nur experimentell ermittelt werden kann. Zeichnen Sie zur Darstellung des Abschnitts eines Leiterkabels auf dem Schulhof mit Kreide ein Rechteck von 2 mal 5 Metern. Bitten Sie 20 Schüler, sich in das Rechteck zu stellen; sie repräsentieren Metall-Atome. Die übrigen 10 Schüler (Elektronen) versuchen, durch das Kabel zu laufen, während die „Atome“ entweder still stehen (geringe Temperatur) oder durch Bewegungen ihres Körpers schwingen (hohe Temperatur). Die Zeit, welche die „Elektronen“ benötigen, um den Kabelabschnitt zu passieren, wird mit einer Stoppuhr gemessen.
Um in dieses Thema einzuführen, bitten Sie einen Schüler (Schüler 1) die Geschichte der Entdeckung des Gesetzes des freien Falls vorzulesenw3. Während einer der Assistenten Galileis (Schüler 2) durch Gitarrenanschläge Zeittakte vorgibt, führen Galilei selbst (Schüler 3) und sein zweiter Assistent (Schüler 4) ihre Experimente mit einem Tischtennisball (oder vergleichbar: eine festere Kugel erzielt bessere Ergebnisse) und einer schiefen Ebene mit (metallischen) Querbändern auf verschiedenen Höhen durch (siehe Bild links).
Der Ball rollt die schiefe Ebene von unterschiedlichen Höhen aus hinab. [Kommentar des Übersetzers/Autors: Besser ist es, den Ball stets von der gleichen Höhe aus zu starten und die Rollzeit bis zu verschiedenen Querbändern (Fallhöhen) zu messen.] Schüler 4 nimmt folgende Daten auf:
In nur einer Unterrichtsstunde liefert diese Methode exzellentes Datenmaterial für die Veranschaulichung des Begriffs der Halbwertszeit, ohne jegliche komplizierte oder gefährliche Versuchsapparaturen.
Ein Spielbrett mit 6 mal 6 Feldern ist mit 36 roten Spielsteinen belegt. Zwei leicht unterscheidbare Würfel werden geworfen und ihre Zahlen als x-Wert (Würfel 1) und y-Wert (Würfel 2) genutzt. Der rote Spielstein auf dem Feld, zu dem die x/y-Koordinaten der Würfel gehören, zerfällt in (wird ersetzt durch) einen blauen Spielstein. Wenn ein Zahlenpaar doppelt geworfen wird, geschieht nichts mit den Steinen, aber der Doppelwurf wird gezählt. Nach jeweils 10 Doppelwürfen werden deren Gesamtzahl (t) und die Zahl der verbleibenden roten Spielsteine (N) aufgeschrieben. Aus dem N-t-Diagramm wird die Halbwertszeit ermittelt.
Um verschiedene Halbwertszeiten darzustellen, können Sie 8-seitige Würfel oder ein Spielbrett mit 8 mal 8 Feldern einsetzen oder die Regeln so ändern, dass jedes Feld 2-mal gewürfelt werden muss, bevor ein roter Spielstein zerfällt.
Einige Übungen in diesem Artikel wurden von Arbeiten anderer angeregt. Der Autor möchte deshalb seinen besonderen Dank gegenüber Pöpping (2003; Radical polymerisation of ethene to polyethylene (Radikalische Polymerisierung von Ethen zu Polyethylen)), Schreiber (2004; Physical states of water (Aggregatzustände des Wassers)), Fallscheer (2006; Electric circuit (Elektrischer Stromkreis)), Bührke (2003), Drake (1975), Hepp (2004) und Riess et al. (2005; Galileo’s law of free fall (Galileis Gesetz des freien Falls)), und Barke & Harsch (2001; Nuclear disintegration and half-life (Kernzerfall und Halbwertszeit)) ausdrücken.
Dieser Artikel gibt besondere und konkrete Anregungen, wie Lehrer Darstellendes Spiel nutzen können, um Schülern das Erlernen von abstrakten Zusammenhängen in der Chemie und Physik zu erleichtern. Die Übungen können überwiegend im Rahmen der Behandlung von kurrikularen Standardthemen eingesetzt werden.
Die Tatsache, dass die vorgeschlagenen Übungen keine komplizierten oder teuren Ressourcen voraussetzen, ermöglicht ihren einfachen Einsatz im Unterrichtsraum. Lehrern werden klare und prägnante Anweisungen gegeben, wie sie kreatives Schreiben und Rollenspiel in ihrem Unterricht verwenden können. Dies macht naturwissenschaftliche Unterrichtsstunden für Schüler nicht nur interessanter, sondern bedeutet auch, dass sie sich für ihre Lernerfahrungen stärker einbezogen und verantwortlich fühlen. Es werden damit auch Schüler angesprochen, die stärker den Sprachen und Künsten zugewandt sind, weil es ihre Fantasie und Kreativität anregt. Letztendlich kann der Artikel Lehrern beim ersten Einsatz solcher Methoden in ihrem Unterricht unterstützen. Er liefert aber auch Lehrern, die bereits ähnliche Übungen in ihren Klassen einsetzen, neue Ideen.
Catherine Cutajar, Malta
Download this article as a PDF