Fumuri vişinii: importanţa iodului Understand article
Trandus de Mircea Băduţ. Iodul, cu vaporii săi vişinii, are o multitudine de aplicaţii – de la dezinfectantul familiar, la inovatoarele celule solare.

Pentru imagine mulţumim lui
Eleanor A Merritt
Ce face ca iodul să fie atât de important şi de interesant? Nu doar că el sublimează degajând acel dramatic gaz purpuriu, dar influenţează o mulţime de aspecte ale vieţii pe Pământ şi ale civilizaţiei umane. Ştiaţi că, de exemplu, iodul protejează algele marine de degradarea oxidativă (provenită inclusiv de la Soare)? Ori că previne anumite anomalii congenitale ale oamenilor? Sau că are multe aplicări industriale?
Descoperirea iodului poate fi căutată în istorie, în secolul al XIX-lea şi în războaiele lui Napoleon. Datorită blocadei impuse de britanici la porţile Europei, francezii s-au confruntat cu penuria de salpetru (KNO3) necesar fabricării prafului de puşcă. Astfel, chimistul Bernard Courtois a cercetat potenţialul algelor marine (alga maronie,Laminaria) ca sursă de potasiu pentru acea substanţă crucială. El a adăugat acid sulfuric concentrat la cenuşa algelor şi a fost surprins de frumuseţea fumului vişiniu degajat.

Gay-Lussac, fizician şi
chimist francez, litografie
realizată de François
Séraphin Delpech
(1778–1825)
Imagine din dimeniul public
/ Wikimedia Commons
Deşi Courtois a bănuit că aceşti vapori vişinii sunt ai unui element chimic nou, nu a avut mijloacele economice pentru a-şi urma cercetarea. A revenit colegilor săi, inclusiv lui Joseph Gay-Lussac, sarcina confirmării acelei intuiţii şi a botezării noului element – iod – de la cuvântul grecesciodes, care înseamnă ‘purpuriu’ sau ‘violet’.
Gay-Lussac a continuat să investigheze comportamentul chimic al iodului, şi – în ciuda războiului – chimistul francez a găsit căi de a coresponda cu chimişii britanici, în special cu Sir Humphry Davy. Iniţial, Davy a crezut că vaporii aceia sunt un compus ai clorului, dar curând a concluzionat că este într-adevăr un element chimic nou.

Fucaceæ şi Laminariaceæ
sunt cei mai puternici
acumulatori de iod dintre
sistemele vii. Fotografie luată
pe ţărmul Dunstaffnage,
lângă Oban, Scotland, Marea
Britanie
Pentru imagine mulţumim lui
FCK
Graţie spectroscopiei cu absorbţie de raze X ştim astăzi că algele marine acumulează iod sub forma de iodură (ionul I-), care acţionează ca un antioxidant şi le protejează împotriva alterării oxidative cauzate de ozonul atmosferic (O3). Aceasta explică cumva de ce pot fi detectate urme de iod molecular (I2) în atmosferă în regiunile de coastă şi de ce asimilarea iodului de către oameni în aceste zone este dependentă mai degrabă de abundenţa algelor marine decât de apropierea de mare.
Pentru aproape încă un secol, iodul a continuat să fie extras din algele de mare. Însă astăzi el este scos din saramurile iodate ce însoţesc zăcămintele de gaz şi de petrol din Japonia şi SUA, sau din minereurile azotoase din Chile, care conţin iodat de calciu (Ca(IO3)2). Iodul este furnizat pe piaţă sub forma unui solid de culoare vişiniu închis.
Chimia iodului
Iodul face parte din grupa halogenilor, având deci multe dintre caracteristicele elementelor din grupa a VII-a. Datorită înaltei sale eletronegativităţi, iodul formează ioduri (săruri ionice) cu mai toate elementele, în starea sa de oxidare formală, -I. Mulţi dintre compuşii chimici conţinând iod sunt utilizaţi frecvent ca reactivi în sinteza organică – în special pentru iodinare, oxidare, şi pentru formare de legături carbon-carbon.
Iodul existent în atmosferă provine mai ales din procesele biologice şi chimice din ocean – de genul sistemelor antioxidante iodurate din algele marine. Cea mai mare parte din acesta dispare din atmosferă prin formarea norilor. În ocean, iodul se găseşte mai ales dizolvat, în formele de radical iodat (IO3–, forma oxidată) şi radical iodură (I–, forma redusă). La suprafaţa scoarţei terestre (litosfera) iodul se concentrează de obicei în sedimentele marine şi terestre; în rocile magmatice nivelul de iod este redus.
Importanţa fiziologică a iodului
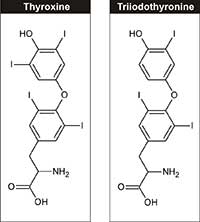
(T4) şi triiodotiroxina (T3)
Pentru imagine mulţumim lui
Michael Zimmermann
Din punct de vedere fiziologic, iodul este un element esenţiat vieţii, fiind necesar pentru sinteza hormonilor tiroidieni – triiodotironină şi tiroxină – ce reglează creşterea organismului uman, dezvoltarea şi metabolismul celulelor. Cantitatea de iod din cadrul dietei recomandate pentru adulţi este de 150 µg/zi, şi se poate obţine din lactate, din alge de mare şi din sare de bucătărie iodată.
Simptomul clasic al lipsei de iod din organismul uman este umflarea tiroidei (apariţia guşei). Atunci când scade aportul de iod din alimentaţie, glanda pituitară anterioară secretă nivele crescânde de hormon de stimulare a tiroidei, în efortul de a maximiza exploatarea iodului disponibil; aceasta duce la creşterea excesivă a glandei tiroide.
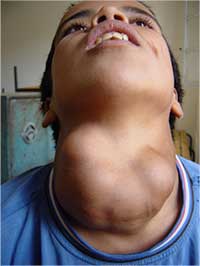
cauzată de lipsa iodului
Pentru imagine mulţumim lui
Michael Zimmermann
Dar cel mai devastator efect al lipsei de iod este dezvoltarea slabă a creierului la copiii mici, conducând la retardarea mentală. Mai mult, o deficienţă gravă de iod pe durata sarcinii este asociată cu o incidenţă înaltă de decese ale nou-născuţilor, de avorturi spontane sau de anomalii congenitale.
Cel mai eficient mod de a preveni deficienţa iodului constă în adăugarea de iodură de potasiu (KI) sau de iodat de potasiu (KIO3) la sarea de bucătărie. Această practică de iodizare a săriieste folosită în aproximativ 120 de ţări, şi astfel peste 70% din populaţia lumii are acces la sarea iodată.
Folosirea industrială a iodului
Iodul şi compuşii săi sunt folosiţi într-o miriadă de produse, de la alimente şi medicamente, până la creşterea animalelor şi la catalizări industriale. De exemplu, iodul este un antimicrobian puternic. Pentru mai mult de un secol, tinctura de iod – un amestec de etanol, apă, iod şi iodură de potasiu – s-a folosit ca antiseptic pentru răni. Aceasta a fost înlocuită astăzi de ionofori solubili în apă (iod completat cu surfactanţi), care este mai puţin iritantă pentru piele. De exemplu, iodul povidon, un amestec de polivinilpirolidon şi iod, este folosit extensiv ca dezinfectant în chirurgie.
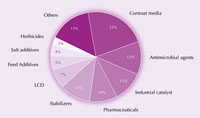
ale iodului
Pentru imagine mulţumim lui
Tatsuo Kaiho
La producerea industrială a acidului acetic, compuşii iodului – precum iodura de rodiu (procedeul Monsato) sau iodura de iridiu (procedeul BP Cativa) – sunt folosiţi pentru catalizarea carbonilării metanolului.
Iodura de argin (AgI), folosită iniţial la prepararea plăcilor fotografice, este astăzi utilizată la inseminarea norilor pentru a iniţia ploi şi pentru a controla climatul. Deoarece AgI are o structură cristalină asemănătoare gheţei, ea poate induce îngheţarea prin furnizarea de nuclee de coagulare. Procesul a fost folosit la Olimpiada de la Beijing, în 2008, pentru a evita ploile pe durata ceremoniilor de deschidere şi de închidere.

plane, cu două generatoare
de iodură de argint pe
laterale, este folosit pentru
inseminarea norilor.
Pentru imagine mulţumim lui
Christian Jansky / Wikimedia
Având o masă atomică mare (126.9) şi mulţi electroni, iodul se comportă ca un excelent absorbant de raze X, din această cauză fiind folosit pentru ca substanţă de contrast în radiologie. Aceste substanţe se pot administra de obicei oamenilor pentru a îmbunătăţi vizualizarea ţesuturilor moi prin examinări cu raze X.
Însă o mult mai frecventă aplicare a iodului o găsim în ecranele cu cristale lichide de la televizoare, calculatoare şi telefoane mobile, care folosesc pelicule de polarizare pentru a filtra lumina. Aceste pelicule sunt uzual confecţionate din straturi de alcool polivinilic dopate cu iod. Aici iodul acţionează ca o legătură pi şi asigură caracterul polarizant al structurii.
Iodul în industria energiei

la Tricastin, Franţa, este
situată în apropierea unei
regiuni cu populaţie densă.
La aproximativ fiecare cinci
ani se distribuie pastile cu
iodură de potasiu oamenilor
care locuiesc în vecinătate
petru a preveni alterarea
glandelor tiroide în cazul
unui accident nuclear.
Pentru imagine mulţumim
AIEA /Wikimedia
Iodul este folosit într-unul dintre cele mai promiţătoare tipuri de celule fotovoltaice de pe piaţa energiei solare, respectiv la producerea de ‘energie verde’ ieftină: celulele solare sensibilizate prin difuzare de oxid de titanium. Cunoscute ca celule Grätzel – după numele unuia dintre inventatori – acestea constau din electroliţi poliioduraţi cu rol de strat de transport al sarcinii electrice între catod şi anod (pentru a afla mai multe vedeţi Shallcross et al., 2009).
Dintre cei 37 de izotopi cunoscuţi ai iodului, doar unul nu este radioactiv, 127I. Majoritatea acestor radioizotopi, care sunt produşi prin reacţii de fisiune în uzine nuclearo-electrice (sau în arme), au durată de viaţă mică, ceea ce îi face folositori şi ca substanţe de monitorizare internă ori ca agenţi terapeutici în medicină. De exemplu, când sunt injectaţi în fluxul snaguin, izotopii de iod ne pot ajuta să obţinem imaginea glandei tiroide.
Din păcate, izotopul radioactiv 131I emis la accidentele nucleare – precum dezastrul din Fukushima, Japonia, din 2011 – este de asemenea absorbit de tiroidă. Şi, cum el este un emiţător de particule β cu energie înaltă, poate distruge celulele şi iniţia cancer. Pentru a contracara efectul nociv, se impune înghiţirea de pastile de iodură de potasiu (KI), neradioactivă, pentru a satura abilitatea tiroidei de a asimila iodul radioactiv.
Acestea sunt doar câteva exemple ale multiplelor aplicaţii ale iodului. Evident, chiar dacă elementul a fost descoperit doar de două sute de ani, el şi găsit un loc clar în chimia modernă, în fizică şi în medicină.
Iodul în ora de şcoală
Desigur că suntem toţii obişnuiţi cu experimentul coloristic al ‘ceasului cu iod’ obţinut prin combinarea peroxidului de hidrogen, iodurii de potasiu şi a tiosulfatului de sodiu – dar există şi alte metode de a prezenta iodul în mod practic la şcoală. De exemplu:
- Când se catalizează cu apă, aluminiul şi iodul reacţionează pentru a produce nori dramatici de vapori purpurii.
- Într-o reacţie directă dintre un metal şi un nemetal: pudra de zinc reacţionează cu soluţia de iod şi etanol pentru a forma iodura de zinc într-o reacţie de reducere exotermică.
- Iodura de potasiu poate fi utilizată pentru a detecta prezenţa amidonului într-o serie de alimente.
- Diferite soluţii, inclusiv iodura de sodiu apoasă, pot fi supuse electrolizei, iar substanţele acumulate la electrozi pot fi identificate. Elevii îşi pot folosi apoi experienţa practică şi cunoştinţele teoretice pentru a construi acele simple ecuaţii ionice care stau la baza electrolizei.
Detalii despre astfel de experimente şcolare pot fi descărcate de pe web-site-ul Learn Chemistryw1.
Recunoaşteri
Materialul de faţă a fost adaptat după un articol mult mai mare din Angewandte Chemie International Edition (Küpper et al., 2011).
References
- Küpper FC, Feiters MC, Olofsson B, Kaiho T, Yanagida S, Zimmermann MB, Carpenter LJ, Luther GW, Lu Z, Jonsson M, Kloo L (2011) Commemorating two centuries of iodine research: an interdisciplinary overview of current research. Angewandte Chemie International Edition 50: 11598-11620. doi:10.1002/anie.201100028
- Shallcross D, Harrison T, Henshaw S, Sellou L (2009) Looking to the heavens: climate change experiments. Science in School 12: 34-39.
Web References
-
w1 – Web-site-ul ‘Learn Chemistry’ al Societăţii Regale din Marea Britanie oferă o gamă largă de resurse descărcabile pentru a ajuta profesorii în predarea şi asimilarea chimiei.
Review
În această concisă şi proaspătă documentare despre iod, autorii ghidează cititorul prin istoria acestui important element chimic şi prin multiplele sale aplicaţii, de la medicină la industrie şi la producerea de energie electrică. Sugestiile pentru experimentele de laborator şcolar sporesc interesul şi atractivitatea subiectului.
Datorită stilului limpede şi plenar, recomand acest articol nu doar pentru profesorii de ştiinţă europeni dar şi pentru eleviii cu vârste între 13 şi 18 ani. Materialul poate fi folosit în lecţiile de chimie (tabelul periodic al elementelor, halogeni), de biologie (glandele endocrine, tiroida şi patologia ei) şi de fizică (izotopi, radioactivitate, celule solare). Avem şi oportunitatea interdisciplinară de a ne referi la istoria ştiinţei (descoperirea elementelor chimice), la rolul cercetătorilor în crearea de arme militare, sau la relaţiile dintre cercetători din ţări inamice pe durata războaielor.
Subiecte/întrebări pretabile pentru completarea subiectului:
- Din articol puteţi deduce că iarba-de-mare acumulează iodul pentru:
- a oxida ozonul atmosferic
- a absorbi ozonul atmosferic
- a produce ozon atmosferic
- a se proteja de ozonul atmosferic.
- Dacă nu absorbim suficient iod:
- glanda tiroidă ni se măreşte / atrofiază
- glanda pituitară anterioară secretă mai mulţi / puţini hormoni de stimulare a tiroidei
Giulia Realdon, Italia





