Supporting materials
Fisa de lucru a studentului (Word)
Incalzirea mancarii: reacţii redox, pasivizare şi element local (Word)
Download
Download this article as a PDF

Tradus de Iorgu Loredana, Tudorache Alexandra, Zaheu Iuliana, Moldovan Alexandra, Gabriela Badea; Colegiul National I.L. Caragiale-Bucuresti. Ti-ai dorit vreodata o bautura fierbinte sau o masa fierbinte, dar nu ai avut foc sau un aragaz la indemana? Marlene Rau iti prezinta doua activitati din…

Incalzitoarele de mancare- facute initial pentru uz militar- sunt pachete de mancare care se pot autoincalzi.Pot fi incalzite in multe feluri : -prin apasarea unui buton de pe ambalaj, desfacand si agitand pachetul sau prin turnarea continutului dintr-o punga in alta si asteptand cateva minute –toate acestea folosind reactii chimice exoterme.Aceste mese pot fi folosite pentru a motiva elevii sa studieze astfel de reactii sigure si fara a folosi un arzator. Suplimentar trebuie discutat aspectul negativ din punct de vedere ecologic al meselor de unica folosinta.
Pentru urmatorul experiment vom folosi sistemul de incalzire al mancarii Crosse & Blackwell care se bazeaza pe reactia dintre magneziu si apa sarata pentru a produce hidrogen:

Mg (s) + 2H2O (l) -> Mg2+ (aq) + H2 (g) ↑ + 2OH– (aq)
s: solid; l: lichid; g: gazos; aq: in solutie; sagetile verticale indica eliberarea gazului.
Aceasta reactie este foarte lenta, din cauza pasivizarii, astfel pentru a fi accelerata se adauga fier si sare. Pasivizarea este procesul prin care un material devine mai putin reactiv, de obicei prin depunerea unui strat de oxid pe suprafata sa: daca pui o banda de magneziu in apa rece, suprafata sa se va oxida la hidroxid de magneziu (Mg(OH)2), iar acest strat va impiedica reactiile viitoare.
Prin urmare, intr-o mancare incalzita fierul este adaugat magneziului, ceea ce produce o celula de coroziune locala – la scara redusa; aceasta se intampla cand doua metale cu reactivitati diferite intra in contact in conditii de umiditate accelerand reactia exoterma. Pentru ca potentialul magneziului este mai coborat decat cel al fierului(metalul cel mai putin reactiv), electronii vor trece de la magneziu la fier si doar de la acesta in apa. Deşi cationii de magneziu (Mg2+) şi anionii de hidroxid (OH–) continuă să se formeze, ei sunt separati de catre fier şi nu se pot combina pentru a forma hidroxidul de magneziu.Ca rezultat,magneziul nu devine pasivizat de un strat de hidroxid de magneziu care ar diminua reactivitatea.
Deoarece magneziul incarcat diferit si ionii de hidroxid sunt mobili, in apa curata ei vor forma curand hidroxid de magneziu, sarciona va fi echilibrata si reactia se va incetini din nou. Pentru a preveni aceasta, se adauga in apa clorura de sodiu, astfel sodiul (Na+) si ionii de clorura (Cl–) din sare, pot trece la magneziu si in schimb ionii de hidroxid echilibreaza sarcina electrica.
Experimentul poate fi folosit pentru a introduce şi discuta subiectele legate de transferul de electroni, de celulele locale, pasivizare, anozi de sacrificiu, coroziunea şi compoziţia apei (legaturi covalente, polaritatea şi numere de oxidare). Subiectul are nevoie de aproximativ 45 minute, plus timp de discutie si a fost testat cu succes cu elevi de 14 ani ce studiau reactiile de transfer de electroni si coroziunea, precum si de alti studenti mai in varsta care lucreaza in electrochimie.
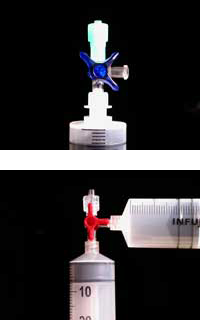
Materialele din plastic necesare pentru experiment pot fi comandate, ca parte a kiturilor de ChemZw2, care au fost realizate în colaborare cu proiectul the Lebensnaher Chemieunterricht (LNCU)w3 dar sunt de asemenea disponibile de la furnizori pentru laboratoare medicale si chimice.
Notă: Dacă utilizaţi conţinutul a doar două din cele patru pachete de amestec de magneziu /fier , puteţi pastra conţinutul celorlalte două pachete pentru experimentele cu elevii “- va fi suficient pentru grupuri de aproximativ 20 de studenti. Chiar şi cu doar două dintre pachetele de demonstraţie, mancarea încălzita va ajunge la o temperatura de 100 °C, după aproximativ un minut.
La celula locala, se produce hidroxid de magneziu. Dacă se doreşte, acest lucru poate fi pus in evidenta cu ajutorul fenolftaleinei (vezi mai jos).
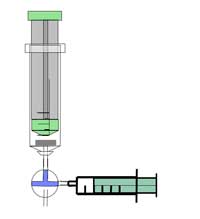
Notă de siguranţă: Purtaţi ochelari de protecţie. Reacţia creează gaz inflamabil – Atentie . A se vedea, de asemenea nota generala de siguranţă.
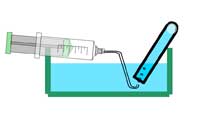
Opţional: se adaugă o picătură de soluţie de fenolftaleină la apa pe care o colectati în paharul de laborator. Ce se întâmplă? De ce?
Nota de sănătate şi siguranţă: lichidele ramase pot fi eliminate în chiuvetă. Curăţaţi materialele plastice cu apă şi lăsaţi-le să se usuce.
Alte reacţii frecvent utilizate în incalzirea mancarurilor includ oxidarea fierului, reacţia clorurii de calciu anhidre cu apa (vezi mai jos) sau, pentru răcire, reacţia îngrăşământului nitrat de amoniu cu apă.
Alte experimente cum ar fi producerea de pachetecalde si reci proprii , sau de stabilire a conţinutului de oxigen din aer, cu ajutorul reacţiei de oxidare a fieruluiutiloizata in pachetele incalzitoare, sunt descrise pe website-ul LNCUw3.
Această activitate poate forma de asemenea o parte ditr-o lecţie în care elevii îşi dezvoltă un scenariu pentru un program TV de stiinta,pentru a putea sa răspundă la întrebareaunui spectator despre cum functioneaza acest fenomen de incalzire. Versiunea în limba engleză a acestei fise de lucru este disponibila pe Science in School websitew5, varianta germana pe LNCU websitew3.
În această activitate, studenţii incalzesc cafeaua utilizand clorură de calciu anhidră şi apă. Activitatea poate fi o parte a unei unităţi de învăţare referitoare la dizolvarea sărurilor in apă; se introduc aspectele energetice ale acestui proces. Elevii ar trebui să fie deja familiarizati cu legaturile ionice şi covalente. Activitatea funcţionează bine cu grupuri de câte trei elevi de 14 ani şi peste aceasta varsta.
O posibilitate este aceea de a discuta energia lattice , folosind ca exemplu din viaţa de zi cu zi compresele reci care se bazează pe o reacţie endoterma declanşand îndoirea unei placi de metal. Următoarea activitate poate fi apoi folosita pentru a introduce noţiunea de energie hidratanta şi pentru a demonstra că reacţia prin care unele săruri se dizolva este o reacţie exotermă.
Activitatea este relativ sigura – cel mai periculos aspect este posibilitatea de a sparge sticla prin nefolosirea ei cu grija.
Notă de siguranţă: Purtaţi ochelari de protecţie, nu beti cafeaua.
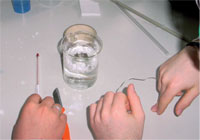
Două probleme cu care se confruntă adesea elevii sunt adăugarea a prea putina clorură de calciu in apă (cu cat folosesc mai mult, cu atat mai multă căldură va fi produsa) şi faptul de a uita sa isi izoleze paharel.
O rezolvare obisnuita a cerintei este aceea de a improviza o baie mica de apă prin punerea de apă şi clorură de calciu într-un vas mare, şi de fixare a polistirenului expandat în jurul paharuuil cu bandă adezivă. Cafeaua poate fi apoi încălzita într-un vas mai mic în baia de apă improvizata.
Cel mai bun rezultat în cadrul proiectului LNCU (vezi caseta) a fost realizat prin completarea unui mic pahar cu apă şi plasarea acestuia într-un pahar mai mare cu un strat de polistiren expandat între ele pentru izolare. Elevii plaseaza apoi clorura de calciu, la care au adăugat foarte puţină apă, într-un recipient mic. Ataşati la acesta un resort şi o greutate, lăsadu-le să atârne în apă.Temperatura celor 50 ml de cafea s-a schimbat de la 20 la 44 ° C în mai puţin de un minut.
Discutaţi despre contradicţia aparentă între comportamentul de comprese reci in experimentele anterioare şi experimentul pe care tocmai l-aţi efectuat – în acest caz, procesul de creare a soluţiei nu este endoterm. În compresele reci, este necesara mai multă energie pentru a distruge laticea (reteaua) de sare moleculara (retea de energie) decât este eliberată atunci când moleculele de apa inconjara ionii (energia de hidratare). Energia necesara este extrasa din mediu, astfel încât soluţia se răceşte. În experimentul legat de cafea, în schimb, energia hidratarii este mai mare decât energia de retea, astfel încât procesul ca întreg este exoterm. Hidratarea şi energia de retea sunt caracteristicile individuale ale unei sari.
Pentru cel ce urmeaza, elevii ar putea să încerce să realizeze cea mai joasă temperatură posibilă utilizând clorură de calciu anhidru, clorură de sodiu şi gheaţă. Ei pot fi surprinsi să constate că adăugarea de clorură de calciu anhidru la gheaţă (mai degrabă decât apa) nu creşte temperatura. Acest lucru se datorează faptului că legăturile de hidrogen din cristalele de gheaţă trebuie mai întâi să fie rupte, fapt care necesită energie, astfel încât întregul proces este endoterm.
În 2003, patru profesori germani si-au unit fortele pentru a crea un portal web care sa poata impartasi ideile lor despre cel mai bun mod de predare: Lebensnaher Chemieunterrichtw3 (LNCU, lecţii de chimie relevante pentru viaţa de zi cu zi). Colectia acestora a crescut constant, şi oferă o selecţie largă de activităţi pentru toate categoriile de vârstă de la şcoala primară la şcoala secundara superiora, conectarea la principalele teme curriculare în chimie, cum ar fi tabelul periodic, titrare, şi aer şi apă, plus biologie şi activităţi de fizica pentru cei mai tineri studenţi.
Materialele lor în limba germană sunt disponibile în mod gratuit prin descărcarea PDF-urilor şi documentelor Word® , care contin atât instrucţiuni pentru profesori cat şi fise de lucru pentru studenţi. În plus, site-ul oferă o gamă largă de clipuri video cu privire la activităţi şi o listă cu mai multe site-uri cu idei de predare şi materiale relevante pentru orele de ştiinţă. (in germana si engleza)
O fotografie demonstrativa despre cum sunt produse incalzitoarele de mancare puteti gasi de asemenea aici: www.mlaltd.co.uk/store
Kalogirou E, Nicas E (2010) Microscale chemistry: experiments for schools. Science in School 16: 27-32. www.scienceinschool.org/2010/issue16/microscale
Acest articol permite elevilor să descopere legătura dintre ora de ştiinţă şi lumea reală. Cu experimente care au un factor inedit – si care de multe ori lipsesc de la lecţiile practice – studenţii isi pot dezvolta şi construi abilităţile şi cunoştinţele.
Acest articol permite elevilor să descopere legătura dintre ora de ştiinţă şi lumea reală. Cu experimente care au un factor inedit – si care de multe ori lipsesc de la lecţiile practice – studenţii isi pot dezvolta şi construi abilităţile şi cunoştinţele.
Nick Parmar, UK