Supporting materials
Folha de informações sobre o limoneno (PDF)
Download
Download this article as a PDF

Esta atividade foi apresentada no European Science on Stage Festival 2022 ![]()
Quando a vida dá limões: use limoneno para explorar propriedades moleculares com os seus alunos e mostrar o método científico em acção.

As atividades deste artigo permitem que os alunos investiguem propriedades moleculares simples usando um composto de fácil acesso: o limoneno. As atividades foram desenvolvidas por grupos de estudantes italianos e espanhóis num projeto conjunto através de trabalhos escritos, questionários e vídeos.
Através da aplicação do método científico, os alunos desenvolvem a capacidade de observar um fenómeno, formular uma hipótese, procurar materiais adequados para montar uma experiência, recolher dados para análise e chegar a uma conclusão que é partilhada com os outros. O foco aqui é numa molécula orgânica simples, (R)-(+)-4- e (S)-(–)-4-isopropenil-1-metil-1-ciclohexeno (os dois enantiômeros do limoneno), que é segura, fácil de encontrar e do interesse do mundo quotidiano e industrial.
O limoneno (4-isopropenil-1-metilciclohexeno) é um monoterpeno cíclico quiral, com a fórmula molecular C10H16.[1–3] Este composto quiral existe em duas formas isoméricas, que são estereoisômeros; por outras palavras, moléculas com a mesma estrutura, mas com diferentes orientações dos mesmos átomos no espaço. As duas formas de limoneno diferem apenas na configuração dos grupos em torno de um único átomo de carbono. As duas formas são imagens especulares (=enantiômeros) uma da outra que apenas podem ser interconvertidas pela quebra e formação de ligações covalentes.
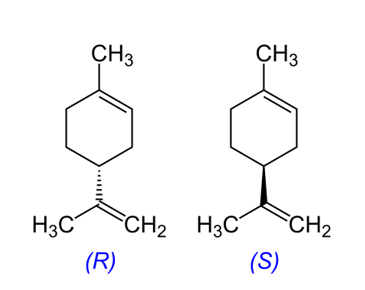
Fórmula Molecular: C10H16
Peso Molecular: 136.23
Sinônimo:
D-Limoneno, (R)-(+)-Limoneno
L-Limoneno, (S)- (−)-Limoneno
D-Limoneno é um componente importante do óleo das cascas de citrinos, que também contém limonóides cítricos.[4] O L-limoneno é menos comum e é encontrado em ervas como a alcaravia. O limoneno industrial é obtido da casca de frutas cítricas como um produto residual do processamento de frutas para a produção de sumos.[5] Por esta razão, é produzido como o enantiômero R (D-Limoneno). É usado como um composto de fragrância e para desengordurar.

Como todos os enantiômeros, as duas formas são indistinguíveis na maioria dos testes químicos/físicos. No entanto, eles giram o plano da luz polarizada em direções opostas. Assim, é possível distinguir os enantiômeros usando um polarímetro.
Além disso, eles são facilmente distinguidos biologicamente. D-limoneno (a forma R) tem um odor cítrico doce, enquanto a forma L tem um odor resinoso ou tipo aguarrás mais acentuado. Os nossos narizes são muito sensíveis e capazes de distinguir esses compostos muito semelhantes porque os receptores olfativos no nariz têm sítios moleculares que interagem especificamente com diferentes enantiômeros.[6]
Experiências:
Atividades adicionais: as propriedades antibacterianas e anti-germinação do limoneno (2 h)
O limoneno é um terpeno volátil, quando concentrado, não deve ser ingerido ou entrar em contato com os olhos, porque é irritante. A pele deve ser imediatamente lavada. Ao contrário da casca de laranja, o teor de limoneno na resina e na terebintina não atinge concentrações críticas.
Nesta primeira atividade, discutimos a quiralidade usando (R)- e (S)-limoneno. Esta atividade deve durar cerca de 60 min.
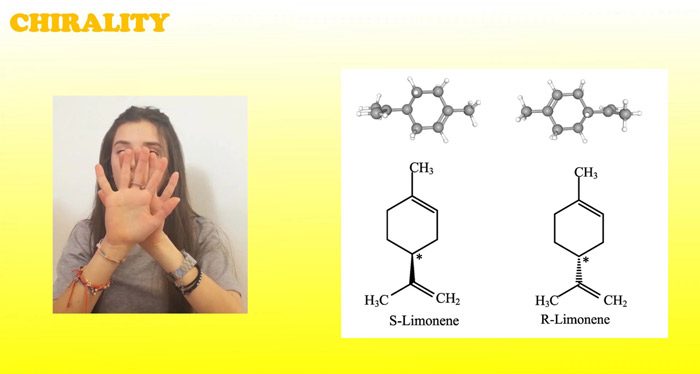
Em seguida, os alunos podem investigar a quiralidade usando (R)- e (S)-limoneno e ver como essa pequena mudança estrutural pode ter consequências no mundo real. Deve demorar cerca de 60 min.

O ângulo de rotação específico para reconhecer cada enantiômero é de +/- 123°, mas, na realidade, basta observar que o enantiômero R se extingue girando o analisador para a direita, enquanto, para o enantiômero S, a rotação é na direção oposta com o mesmo ângulo.
O cheiro dos citrinos também depende das moléculas limonóides cítricas. Adicionamos referências e uma atividade teórica para entender a diferença entre essas moléculas e estudar as vias metabólicas nas plantas.
A perceção do cheiro do (R)-limoneno como sendo diferente do (S)-limoneno é comum, mas não universal. Os alunos podem projetar uma experiência para testar isso, por exemplo, para determinar a percentagem da população num grupo capaz de distingui-los.
Em seguida, os alunos podem investigar o efeito do limoneno em diferentes polímeros. Esta atividade deve durar cerca de 1-2 h. Todas as etapas devem ser realizadas pelos alunos. Existem muitos testes, se necessário, os alunos podem trabalhar em grupos para poupar tempo/equipamento.

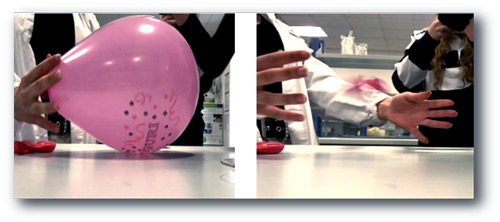

O material de látex, composto de 30 a 40% de poliisopreno reticulado, reage com o limoneno, “abrindo” um buraco ao redor da gota ou ponto de contato. Isso ocorre porque as moléculas de limoneno (monoterpenos) são pequenas o suficiente para deslizar ao longo das cadeias de poliisopreno e separá-las, enfraquecendo a cura química. Isso é suficiente para rebentar o balão cheio de gás. A reação é proporcional à concentração de limoneno e à espessura da borracha, mas não diferencia entre (R)- e (S)-limoneno.
Nesta atividade, investigamos as propriedades químicas do limoneno. Deve demorar cerca de 30 min.

O limoneno é solúvel em óleo e mistura-se naturalmente: deduz-se que é um soluto apolar que se dissolve em um solvente apolar.
O limoneno é insolúvel em água e não se mistura com ela: o limoneno é uma molécula apolar que não se dissolve em água que é uma molécula polar.
A polaridade de uma molécula depende das espécies químicas que a formam, da diferença de eletronegatividade presente nas ligações covalentes e do fato de que o centro das forças eletrostáticas positivas não coincide com as negativas.
O limoneno é um hidrocarboneto constituído por átomos de carbono e hidrogênio. Trata-se de um monoterpeno, derivado de isopreno, de cadeia fechada em que as únicas áreas com carga negativa parcial fraca são as ligações duplas; essas cargas são muito fracas para resultar numa interação com as moléculas de água.
[1] Erasto P, Viljoen AM (2008) Limonene – a review: biosynthetic, ecological and pharmacological relevance. Natural Product Communications 3: 1193–1202. doi: 10.1177/1934578X0800300728
[2] Perveen S (2018) Introductory Chapter. In Perveen S, Al-Taweel A (eds) Terpenes and Terpenoids pp 1–12. IntechOpen. ISBN: 978-1-78984-777-2
[3] Chemical information for limonene and a virtual 3D model: https://pubchem.ncbi.nlm.nih.gov/compound/Limonene#section=3D-Conformer
[4] Gualdani R et al. (2016) The chemistry and pharmacology of citrus limonoids. Molecules 21: 1530. doi: 10.3390/molecules21111530
[5] Jongedijk E et al. (2016) Biotechnological production of limonene in microorganisms. Applied Microbiology and Biotechnology 100: 2927–2938. doi: 10.1007/s00253-016-7337-7
[6] Malnic B, Godfrey PA, Buck LB (2004) The human olfactory receptor gene family. PNAS 101: 2584–2589. doi: 10.1073/pnas.0307882100. This article has a correction.
Folha de informações sobre o limoneno (PDF)
Download this article as a PDF