Supporting materials
Download
Download this article as a PDF

Tradução de Isabel Queiroz Macedo. A actividade industrial ou até mesmo alterações geológicas podem afectar a qualidade da água, causando contaminações que podem pôr em risco a saúde humana e o ambiente. Saiba como se tornar um analista independente que assegura que temos água de boa…

A actividade industrial ou até mesmo alterações geológicas podem afectar a qualidade da água, contaminando-a com iões metálicos, fertilizantes, pesticidas ou outros compostos orgânicos nocivos para a saúde humana e o ambiente. É por isso crucial fazer uma monitorização constante da qualidade de fontes de água doce, como rios.
Os analistas da qualidade têm um papel muito importante no processo de nos manter a salvo de água poluída. Eles verificam regularmente a qualidade da água, fazendo análises (como a quantificação de determinados iões em solução) de amostras de água colhidas em vários locais, antes, durante e após tratamento.
Nesta actividade os estudantes assumem o papel de um analista da qualidade da água que trabalha perto de uma fábrica semelhante à Tata Steel, em Scunthorpe, Reino Unido. Terão de reagir a um cenário específico, fazer as análises adequadas e determinar se a fábrica remove eficazmente o ião tiocianato das suas águas residuais.

O ião tiocianato é tóxico para os organismos aquáticos e afecta a glândula tiróide em seres humanos, reduzindo a sua capacidade de produzir hormonas necessárias ao normal funcionamento do organismo.
Os tiocianatos presentes no ambiente têm origens muito diversas. A gaseificação do carvão e a obtenção de produtos químicos de uso industrial a partir de carvão originam grandes quantidades de tiocianatos e de outros compostos tóxicos, como fenóis e ião amónio. Estes sub-produtos aparecem por isso nas águas residuais das fábricas.
Os tiocianatos podem também aparecer quando se usa cianeto na extracção de metais preciosos. O cianeto é convertido em tiocianato por reacção com enxofre, constituinte natural dos minérios.
8CN– + S8 → 8SCN–
O tiocianato é o princípio activo, venenoso, de alguns pesticidas.
O corpo humano contém quantidades vestigiárias de tiocianato – um sub-produto do metabolismo da cisteína e da destoxificação de cianeto – que é eliminado na urina. Pode ser ingerido através do tabaco e é também um sub-produto do metabolismo de alguns fármacos usados no tratamento da hipertensão.
O processo de remoção de tiocianato de águas residuais tem lugar em grandes tanques a céu aberto que contêm lamas activadas, um material biologicamente activo com um conjunto de microrganismos que metabolizam o tiocianato e outros contaminantes, convertendo-os em compostos menos perigosos. A reacção química de degradação do tiocianato é
SCN– + 3H2O + 2O2 → HCO3– + NH4+ SO42- + H+
Esta reacção é um exemplo de biorremediaçãow1, um processo em que se usam microrganismos para descontaminar solos e águas subterrâneas. Quando se usam plantas na descontaminação de solos, o processo designa-se fitorremediaçãow2.
A presença de tiocianato na água pode ser facilmente testada antes e depois do tratamento. Se a solução ficar de cor vermelho-sangue após adição de cloreto de ferro (III), é sinal de que contém iões tiocianato:

Fe3+(aq) + SCN–(aq) → [FeSCN]2+(aq)
Ou, mais rigorosamente,
[Fe(H2O)6]3+(aq) + SCN–(aq) → [Fe(H2O)5SCN]2+(aq) + H2O(l)
Esta reacção é usada para a análise quantitativa de ião tiocianato. Determina-se a concentração de ião tiocianato a partir da absorvância a 480 nm do complexo [Fe(H2O)5SCN]2+, que se mede num colorímetro. Pode-se também fazer uma comparação visual da intensidade da cor, mas os resultados são menos rigorosos e obtém-se apenas uma estimativa da concentração ou de uma gama de concentrações.
Como explicado na ficha 1w3, os estudantes assumem o papel de um analista de uma pequena empresa independente de controlo de qualidade, cuja função é verificar os resultados e assegurar que satisfazem os requisitos da Agência do Ambiente do Reino Unido.

A concentração de ião tiocianato no efluente de uma unidade industrial em Scunthorphe, a Tata Steel, é cerca de 250 mg/dm3. Porém, a concentração máxima estabelecida pela Agência do Ambiente é 10 mg/dm3. O efluente é tratado de modo a reduzir a concentração para 1mg/dm3, bem abaixo do limite de segurança. Deste modo os iões tiocianato são removidos do efluente antes da descarga no rio Trent.
Houve recentemente um período de muito frio que afectou a actividade microbiana. A companhia está com receio de que isso tenha afectado a eficácia do tratamento, reduzindo a remoção de tiocianato do efluente.
A análise de tiocianato é feita três vezes por dia com um teste simples: uma solução ácida de cloreto de ferro (III) é adicionada a uma amostra de água e a concentração de tiocianato é determinada espectrofotometricamente por medição da absorvância do complexo de Fe(III)-tiocianato. Fazem-se 16 testes semanalmente. Além disso analisam-se rigorosamente amostras de efluente antes e depois do tratamento.
Os analistas da fábrica fazem a verificação, mas a companhia está à procura de uma análise independente. E escolheu-o/a a si!
Quando manusear ácidos ou tiocianatos deve usar luvas e óculos de segurança. Pode consultar as normas de segurança no website da Science in School e no fim deste fascículo.
Esta actividade destina-se a alunos de 16-18 anos e demora cerca de 2 horas.

1. Preparar as seguintes soluções antes da actividade prática:
a– Solução padrão de tiocianato de potássio (KSCN) 250 mg SCN–/dm3. Num balão volumétrico de 500 cm3 prepare uma solução aquosa contendo 4,2 g de tiocianato de potássio (KSCN). Transfira 50 cm3 desta solução para um balão volumétrico de 1000 cm3, adicione água destilada até à marca e homogeneíze bem. Fica com uma solução 250 mg/dm3 (250 ppm) em ião tiocianato.
b– Solução de cloreto de ferro (III) (FeCl3.6H2O) 0.41 mol/dm3. Dissolva 50g de FeCl3.6H2O em 250 cm3 de uma solução de HCl 1 mol/dm3. Agite bem para homogeneizar.
c– Doze soluções amostra rotuladas contendo diferentes concentrações de tiocianato
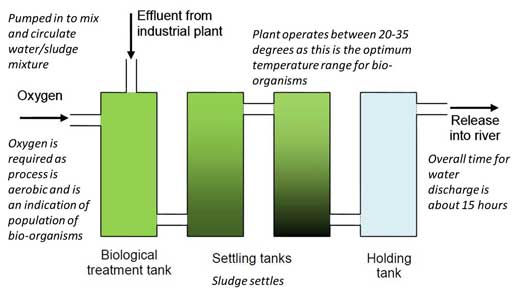
2. Forneça aos alunos um diagrama da estação de tratamento (figura 1), a ficha 1w3 , que descreve o cenário, e a ficha 2w4, com os detalhes do procedimento experimental.
3. Os alunos devem escrever uma carta à empresa que opera a estação de tratamento, solicitando amostras para análise. Devem especificar os locais de amostragem no circuito do efluente na estação de tratamento, o número de amostras e a data/hora da colheita. Devem também especificar a quantidade de amostra e o método de recolha da amostra, incluindo o tipo de recipiente.
4. Os alunos trabalham em grupos de dois e devem seguir o procedimento descrito na ficha de trabalho 2w4.

Cuidados: use óculos de segurança. O cloreto de ferro (III) é irritante para os olhos e o sistema respiratório
1. Curva de calibração
a. Encha com água destilada um frasco com esguicho, marque uma das pipeta de 10 cm3 para usar apenas com a solução de cloreto de ferro; a outra pipeta, diferencial, de 10 cm3, será usada para medir os volumes de solução padrão de tiocianato.
b. A seis balões volumétricos de 100 cm3, A a F, adicione 0,0, 2,0, 4,0, 6,0, 8,0 e 10,0 cm3 da solução padrão de tiocianato 250 mg/dm3.
c. Adicione água destilada até levar o volume a cerca de 80 cm3.
d. Adicione 10 cm3 da solução de cloreto de ferro (III) a cada balão volumétrico e depois perfaça o volume ao traço com água destilada. Agite bem para homogeneizar.
|
Balão |
a |
b |
c |
d |
e |
f |
|---|---|---|---|---|---|---|
|
Volume de solução de tiocianato de potássio/cm3 |
0.0 | 2.0 | 4.0 | 6.0 | 8.0 | 10 |
|
Concentração de tiocianato (ppm) |
0 | 5 | 10 | 15 | 20 | 25 |
e. Meça a absorvância das soluções a 480 nm.
f. Represente graficamente a absorvância (em ordenadas) em função da concentração de tiocianato (em abcissas) para as seis soluções.
2. Análise da amostra
a. Adicione 10 cm3 da solução de tiocianato de concentração desconhecida (amostra) a um balão volumétrico de 100 cm3. Adicione água destilada até um volume de cerca de 80 cm3.
b. Adicione 10 cm3 da solução de cloreto de ferro (III) e perfaça o volume ao traço com água destilada. Agite bem para homogeneizar.
c. Meça a absorvância da solução a 480 nm.
d. Determine graficamente a concentração (em ppm) de ião tiocianato na amostra.
3. Escrever um relatório com um resumo dos resultados e conclusões, indicando claramente se o efluente está em condições de ser descarregado no rio. Deve descrever a evidência em que se baseiam as conclusões e comentar o grau de confiança nos resultados, tendo em conta a percentagem de erro a eles associada.
A investigação em educação revelou o benefício de contextualizar ideias teóricas em cenários de “projectos ao vivo” ou da vida real. Esta actividade prática é um bom exemplo de aplicação da química analítica clássica a um contexto do mundo real. Dá também a oportunidade de desenvolver competências nas áreas de tratamento de dados e comunicação.
Marie Walsh, Limerick Institute of Technology, Irlanda
Download this article as a PDF