Supporting materials
Download
Download this article as a PDF

Traduzido por Paulo Santos Ramos Angelika Börsch-Haubold demonstra as delícias olfactivas da química orgânica.

“A química é tudo explosões e cheiros”. Nem todos os estudantes de química são atraídos para os cheiros e explosões do laboratório. Felizmente, existem várias moléculas orgânicas que cheiram muito bem. Experimentamos estas substâncias diariamente – quando usamos um gel de banho perfumado, saboreando as nossas refeições com ervas aromáticas, ou metendo o nosso nariz profundamente numa rosa. O ensino da química orgânica das fragrâncias naturais deverá motivar, até aqueles que detestam o lado tóxico e perigoso da química, a olhar para as fórmulas estruturais e as suas funcionalidades.
Para serem perceptíveis para o nosso nariz, os compostos químicos devem ser lipofilícos, pequenos (peso molecular <300 Da) e voláteis. As moléculas das fragrâncias escapam do seu fluído ou até do estado sólido para o ar. O tecido sensitivo, chamado epitélio olfatório, é uma membrana da mucosa que se situa no cima da cavidade nasal. Os odores chegam a esta área aproximadamente 7 cm acima das narinas) no ar que nós respiramos; se por vezes o cheiro é familiar, cheiramos duas ou três vezes mais, forçando mais ar e mais fragrância a chegar á membrana sensitiva. Ali, as moléculas são dissolvidas na mucosa e ligam-se aos receptores olfativos que estão presentes no plasma da membrana das células sensitivas. As células enviam impulsos nervosos para o nosso cérebro, o qual aprende a associar o cheiro com a substância original (como uma rosa), permite-nos reconhecer o objecto até quando o objecto está escondido (como quando entramos em casa e percebemos que está um bolo no forno) ou então classificá-lo como desconhecido (como quando vamos pela primeira vez a um restaurante exótico).
Organizar os cheiros num número limitado de distintas classes não é tão fácil como definir os sabores básicos (doce, azedo, salgado e amargo). Os atributos típicos dos cheiros são: floral (jasmim), picante (gengibre, pimenta), afrutado (acetato de etilo), resinoso (fumo de resina), sujo (ovos podres) e queimado (carvão). Musk (muscona), câmfora, ranço (ácido isovalérico, ácido butírico) e pungente (ácido fórmico, ácido acético), são frequentemente adicionados a esta lista. Focando a concentração nos detalhes químicos, os grupos funcionais das moléculas das fragrâncias podem ser relacionados com odores característicos (Tabela 1). Os cheiros dos álcoois n– alifáticos, por exemplo, variam entre o herbal, rosa e madeira até ao laranja. Em contraste, os ácidos n– alifáticos cheiram a gordura, azedo, rançoso ou doce. Os aromas das frutas são ésteres compostos de ácidos orgânicos alifáticos pequenos com álcoois. Diferenças subtis na composição química levam a distintos cheiros, como o aroma de ananás do butirato de etilo e o aroma de albricoque do butirato de pentilo. Os cheiros vegetais dependem frequentemente de compostos organosulfurados. Uma estrutura em anel com um nitrogénio pode cheirar a comida assada ou fermentada, enquanto álcoois aromáticos (fenóis) são os componentes dos alimentos fumados.
A maioria dos exemplos na Tabela 1 é escolhida a partir de diferentes tipos de alimentos para tornar mais fácil a demonstração dos odores. Pode distribuir aleatoriamente amostras de plantas e comida numa superfície grande, e pedir aos estudantes para agrupar as amostras expostas de acordo com o seu cheiro (pode ajudá-los limitando os atributos a: “floral”, “rançoso”, “afrutado”, “vegetal”, “picante” e “fumado”). Quando os estudantes terminarem, deixá-los comparer os seus resultados com a classificação química da Tabela 1.
Tendo em conta as características estruturais, a questão seguinte é como usar o cheiro para distinguir entre estas diferenças nos grupos funcionais, tamanhos e forma global das moléculas. Em vários processos fisiológicos que ocorrem nas membranas celulares, um receptor é activado após a ligação de um substrato ao seu meio extra celular. Este princípio é frequentemente visto como uma chave que encaixa numa fechadura – apenas a chave correcta abre a fechadura correspondente – ou seja o ligando tem uma grande especificidade para o local de encaixe no receptor.
|
Grupo Funcional |
Fonte | Exemplo | Cheiro |
|---|---|---|---|
|
Álcool |
Plantas |
Geraniol, linalool |
Fresco, floral |
|
Aldeido; cetona |
Gordura |
Diacetil |
Como a manteiga |
|
Ácido (C1-C12) |
Queijo |
Àcido Fórmico |
Pungente |
|
Éster, lactona |
Solvente (químicos usados como solventes ) |
Acetato de etilo |
Cola |
|
Pirazina |
Comidas assadas ou fermentadas |
2-isobutil-3-metoxipirazina |
Terra, picante, pimenta verde |
|
compostos de S-: alifáticos, aromáticos |
Vegetais |
Dialildisulfeto |
Alho |
|
Fenóis (mono-, poli-) |
Alimentos fumados |
Guaiacol |
Fumo de madeira |

Algumas das características mais fascinantes da fisiologia do cheiro foram descobertas pelos vencedores do Prémio Nobel de 2004, Linda Buck e Richard Axel. Em contraste com o modelo simples mas específico da chave-fechadura que governa o sabor, o cheiro é governado por uma série de células sensoriais. Um tipo de molécula de fragrância interage com mais que um tipo de receptor, portanto a sensação global é criada por uma combinação de receptores activados. Quando testaram uma série de álcoois n-alifáticos em neurónios de ratos, Buck e os seus colaboradores descobriram que grupos de neurónios olfatórios eram activados. Por exemplo, o pentanol estimula fracamente um receptor chamado S3; o hexanol activa fortemente os receptores S3 e S25; o heptanol activa o S3, S19 e S25; o octanol activa o S18, S19, S41 e S51; e o nonanol activa o S18, S19, S51 e S83. Assim uma única molécula é reconhecida especificamente por múltiplos recptores odoríferos que trabalham em conjunto.
Este padrão de activação de receptors cria um vasto reportório de odores perceptíveis. De facto, estima-se que seremos capazes de recordar cerca de mil odores e distinguir entre uma ordem de magnitude mais, dependendo da nossa idade, experiência e sensibilidade natural. A nossa habilidade linguística para nomes de cheiros, fica no entanto atrás da habilidade do nosso nariz para distingui-los. A indústria alimentar treina peritos em reconhecer diferenças subtis dos cheiros. Por exemplo, os óleos essenciais diluídos ou compostos isolados representando um certo aroma são aplicados numa tira de papel inodoro e colocados num frasco de vidro (ver abaixo) .

Numa experiência destas, pode fornecer aos alunos orégão (1% carvacrol em propilenoglicol), rosa (1% óleo essencial em etanol), limão (10% óleo essencial em etanol), canela (5% cinamaldeído em propilenoglicol), aroma de fruta (5% em propilenoglicol) ou amêndoa amarga (1% benzaldeído em propilenoglicol). Tanto o aluno pode escolher duma lista de 20 odores como ele ou ela é questionado para descrever e nomear o cheiro sem a ajuda dos atributos (ver Experiência 1 na actividade da aulaw1).
Uma pessoa não treinada pode associar correctamente um cheiro com a sua fonte ou qualquer coisa que a contenha, mas falha na identificação da substância original. No decorrer duma avaliação sensitiva de comida que eu recentemente ministrei, apenas metade dos estudantes reconheceram o aroma do orégão; um quarto confundiu-o com tomilho ou manjerona, as quais são ervas relacionadas com aromas bem distintos. Contudo, alguns estudantes associaram correctamente o odor com sopa de tomate, a qual pode estar temperada com orégão. Dois terços dos alunos reconheceram o cheiro das rosas, alguns estudantes associaram correctamente com flores similares como o lilás ou a melissa ou com perfume, mas outros sugeriram incorrectamente menta, medicamentos ou pimenta. Quase todos os alunos reconheceram a amêndoa amarga, menta e canela, mas falharam a identificar a salvia e coentro.
Quando a origem de cada amostra foi revelada, toda a gente reconheceu imediatamente o cheiro que tinham identificado previamente, demonstrando que a memória olfactiva é bastante melhor que a nossa habilidade para dar um nome a um cheiro em particular.
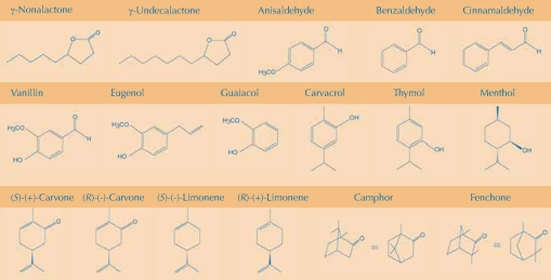
A afinação da nossa maquinaria receptora permite-nos distinguir entre moléculas quimicamente semelhantes. Muitas fragrâncias tem origem em plantas, e as plantas produzem produtos que podem ser usados para demonstrar como pequenas mudanças na estrutura química de uma molécula odorante dá lugar tanto a um cheiro completamente diferente como pelo menos a um cheiro distinto (ver esquemas). Os exemplos são apresentados partindo dos seguintes princípios químicos:
A elongação da cadeia carbonada: a adição de dois grupos metileno (‑CH2‑CH2‑) á molécula odorante do coco, g-nonalactona, dá origem ao odor do pêssego; a inserção de um grupo vinil (‑CH=CH‑) no benzaldeído (amêndoa amarga) dá origem ao cinamaldeído (canela).
A mudança de um grupo functional: substituir o grupo aldeído da molécula de vanilina com um grupo alil (‑CH2‑CH=CH2) dá eugenol, a fragrância das couves. O álcool 1-butanol cheira a pungente enquanto o seu correspondente ácido carboxílico (ácido butiríco) cheira a ranço, manteiga ou vomitado.
A adição de um grupo funcional: adicionando um grupo metóxi ao benzaldeído altera o seu cheiro de amêndoas para anis.
Posição do grupo functional: o carvacrol, que tem um grupo –OH a seguir ao grupo ‑CH3, cheira a orégão, enquanto o timol, que tem um grupo –OH a seguir ao grupo ‑CH(CH3)2, cheira a tomilho; 1-propanol cheira como o etanol, enquanto o 2-propanol tem um cheiro doce (os números reflectem a posição do grupo –OH).
Troca do grupo alifático e do anel aromático: substituindo o anel de benzeno do timol com ciclohexano produz mentol que tem um cheiro completamente diferente.
Diferenças estereoquímicas: normalmente, um enantiómero de uma molécula aromática quiral exibe um odor forte enquanto o outro o do outro é fraco. Excepções notáveis são a (S)-(+)-carvona (o ingrediente aromático das sementes de alcaravia) e (R)-(–)-carvon4 (hortelã). O (S)-(–)-limoneno cheira a turpentine (pinheiro) mas o (R)-(+)-limoneno cheira a laranjas.
Contudo, existem compostos que são estruturalmente diferentes mas cheiram de um modo similar. O ciclooctano, a cânfora e o 1,8-cineol tem todos um odor cânforico, apesar do cilooctano consistir numa estrutura ciclíca carbonada (C8H16), enquanto a cânfora e o 1,8-cineol serem ambos biciclos com um grupo funcional contendo um oxigénio. O chamado ‘toque verde’ das frutas e vegetais verdes (não maduros), que é adicionada aos cosméticos para dar um toque de frescura, vem de um grupo de compostos relacionado com os aldeídos C6 (cis-3-hexenal: tomates frescos; cis-2-hexenal: maçãs frescas; trans-2-hexenal: chá verde e preto, tomates frescos).

Pelo uso de uma grande variedade de odores contidas nas plantas, pode-se combinar a química orgânica com a fisiologia do cheiro para demonstrar o quanto podemos perceber o nosso ambiente sem tomar realmente consciência disso. Se pretende focar a atenção no treino do sentido do cheiro, pode pedir aos estudantes para seleccionar diferentes soluções de um odorante por aumento de intensidade (ver experiência 2 nas actividades em sala de aulaw2). Estas duas actividadesw1, w2 devem estimular os estudantes para ligar situações do dia-a-dia com a química e torná-los curiosos acerca da descrição do nosso mundo em termos de compostos químicos.
Gostaria de agradecer aos alunos pelo curso de terino olfativo (Fachhochschule Weihenstephan, semestre de Inverno 2006/07).
Os alunos podem ser agradávelmente surpreendidos pela descoberta de que os compostos químicos não são apenas responsáveis pelos efeitos potencialmente perigosos e/ou desagradáveis, mas dar origem a agradáveis odores e sabores. As actividades que Angelika Börsch-Haubold apresenta aqui podem ser usados para demonstrar que a base dos cheiros reside na Química e que os nossos narizes são sensores químicos extremamente sensíveis, capazes de detectar variações subtis na estrutura molecular.
O artigo é aplicável á química orgânica em geral, com relevância especifica á tecnologia alimentar. Pode ser interligado com uma discussão do uso de aditivos alimentares de origem não natural ou à modificação genética de alimentos. Pode ser igualmente útil como apoio para a demonstração dos sentidos.
Matthew Fletcher, Reino Unido
Download this article as a PDF