Titanic i zjadające żelazo bakterie Understand article
Gatunek bakterii odkryty na rozkładającym się wraku Titanica zapewnia nowy wgląd w sposób ochrony żywych komórek przed uszkodzeniem.
Wrak Titanica leży na dnie oceanu, prawie 4kg pod powierzchnią, w ciemnych i słonych wodach Północnego Atlantyku. W czasie wypraw w okolice wraku, nurkowie zauważyli „rdzewienie” – podobne do sopli narośla bogate w rdzę – pokrywające część uszkodzonego i skorodowanego kadłuba. W 2010 roku, naukowcy badający rdzewienie pobrane z Titanica odkryli nowy gatunek baterii w obrębie tych narośli w1. Nazwali go Halomonas titanicae.

Wikimedia Commons (własność publiczna)
Naukowcy odkryli również, że bakterie Halomonas titanicae są zaangażowane w proces rdzewienia i przyspieszają rozkład wraku. Rozkład przebiega w stosunkowo szybkim tempie: szacunki wskazują, że do roku 2030 wrak może zupełnie zniknąć. Bakterie te mogłyby zatem stanowić poważne zagrożenie dla platform wiertliczych i innych konstrukcji żelaznych znajdujących się w głębinach morskich. Jednak te organizmy stały się przedmiotem badań naukowych z innego powodu: aby dowiedzieć się w jaki sposób potrafią się rozwijać w warunkach wysokiego i zmiennego stężenia soli.
Sól i żywe komórki
Halo– oznacza w języku greckim sól. Bakterie szczepu Halomonas żyją w środowisku słonym, takim jak woda morska, czy słone bagna, gdzie stężenia soli mieszczą się w szerokim zakresie. Wszyscy członkowie tego szczepu są wyjątkowo „halotolerancyjni”: opanowali sposoby radzenia sobie z niezwykle zmiennym stężeniem soli poza komórką, przeżywając w szerokiej gamie stężenia chlorku sodu – od 0.5% (w/w) do 25%. Może się zdawać, że to banalna kwestia, ale tak nie jest.

Zdjęcie dzięki uprzejmości Lori Johnston, wyprawa na RMS Titanic 2003, NOAA-OE
Komórki chronią przed światem zewnętrznym bardzo cienkie membrany, które kontrolują ruch w komórce oraz poza nią, tworząc i wspierając ogromne różnice w składzie między wnętrzem i zewnętrzem komórki. Na przykład, komórki utrzymują potencjał elektryczny na poziomie 100 miliwoltów w membranie, która zazwyczaj ma grubość jedynie 10 nanometrów. Dla wszystkich typów komórek chlorek sodu (NaCl) jest dominującą solą poza komórką (na przykład w osoczu krwi), natomiast chlorek potasu (KCl) jest główną składową wewnątrz komórki. Jednak pomimo tego, że mamy do czynienia z różnymi typami soli, całkowite stężenie soli po obu stronach błony komórkowej powinno sobie dokładnie odpowiadać. Powodem tego jest osmoza: jeśli dwa roztwory o różnym stężeniu oddzielone są błoną, przepuszczalną dla wody, ale nieprzepuszczalną dla substacji rozpuszczonej, woda będzie przepływać z roztworu o niższym stężeniu w stronę roztworu o wyższym stężeniu.
Błony komórkowe nie radzą sobie z różnicą ciśnień osmotycznych. Czerwone krwinki umieszczone w czystej wodzie będą pękać, co ilustruje wpływ ciśnienia osmotycznego – oraz kruchość błon komórkowych. To oczywiste, że aby utrzymać swoje błony w stanie nienaruszonym, bakterie Halomonas muszą być zdolne do regulacji steżęnia substancji rozpuszczonych w cytoplazmie w odpowiedzi na zmiany steżęnia soli w środowisku zewnętrznym, bez zakłócania biochemii wewnątrz komórki (patrz Zaccai 2009). Jak one to robią?
Bakterie Halomonas wytwarzają duże ilości substancji zwanej ektoiną (patrz ryc. 1). Aby zrównoważyć stężenie soli zewnętrznych, dostosowują stężenie tych samych soli wewnątrz własnych komórek. Dzięki temu płyny komórkowe pozostają w równowadze osmotycznej ze środowiskiem zewnętrznym, chroniąc komórkę przed skurczeniem lub pęknięciem nawet w ekstremalnych warunkach. Co ciekawe, ektoina zdaje się działać w inny sposób niż większość soli i substancji rozpuszczonych, co może zakłócać rolę wody w procesach metabolicznych. Ektoina jest „kompatybilną substancją rozpuszczoną”, dlatego też zachowuje normalną biochemię w komórce. Dodatkowo, zwiększa stabilność białek i błon. W jaki sposób ta niezwykła substancja rozpuszczona osiąga takie rezultaty?
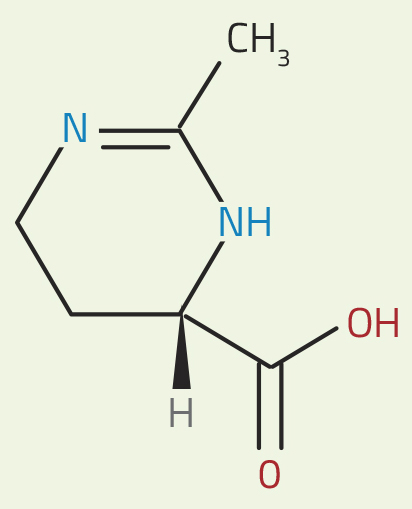
ektoiny. W wodzie, czerwone
grupy zyskują ładunek ujemny
(z powodu utraty kationu H+),
natomiast niebieskie grupy
zyskują ładunek dodatni (z
powodu uzyskania kationów
H+). Następnie naładowane
grupy tworzą wiązania
wodorowe z cząsteczkami
wody.
Nicola Graf
Ektoina i sieć wiązań wodorowych
Wskazówki dotyczące dokładnego działania ektoiny na poziomie molekularnym zostały niedawno odkryte dzięki zaawansowanej eksperymentalnej technice rozpraszania neutronów (zobacz tekst w okienku). Eksperymenty przeprowadzone w ramach międzynarodowej współpracyw2 z udziałem Instytutu Laue-Langevin (ILL)w3, ukazały, w jaki sposób ektoina wpływa na powierzchnię wody wokół cząsteczek białka oraz na powierzchniach membranowych (Zaccai et al., 2016). Zazwyczaj cząsteczki wody oddziałują ze sobą poprzez sieć wiązań wodorowych. Atomy w cząsteczce wody oddziałowują z sąsiadującymi cząsteczkami, przy czym każdy atom tlenu działa jako biorca dwóch wiązań wodorowych, a każdy atom wodoru jako donor jednego wiązania wodorowego. Daje to w efekcie wysoko dynamiczną sień wewnątrzcząsteczkowego wiązania, z cząsteczkami zmieniającymi partnerów miliard (109) razy na sekundę.
Przyciąganie pomiedzy cząsteczkami wody jest również podstawą „efektu hydrofobowego”, który powoduje, że woda i olej pozostają oddzielone. Efekt hydrofobowy jest istotny w wielu procesach biologicznych, w tym w trójwymiarowym fałdowaniu cząsteczek białka oraz formowaniu błon. Dlatego też dynamika wiązań wodorowych jest tak ważnym czynnikiem w sposobie organizacji życia komórek.
Inne substancje w wodzie, takie jak sole, mogą zakłocać tą organizację. Jednak, jak ukazały eksperymenty rozpraszania neutronów, ektoina zdaje się – przynajmniej częściowo – wzmacniać dynamikę wiązań wodorowych, zamiast ją hamować. Cząsteczka ta zawiera grupę naładowaną dodatnio (zaznaczoną na niebiesko na rycinie 1) oraz grupę naładowaną ujemnie (zaznaczoną na czerwono). Te naładowane grupy oddziałują z cząsteczkami wody, powodując, że sieć wiązań wodorowych w ich okolicy jest odrobinę mniej dynamiczna – a jednocześnie generują bardziej dynamiczną sieć cząsteczek wody bardziej od nich oddalonych.
Poza kontekstem bakteryjnym, ektoina okazuje się użytecznym elementem składowym kosmetyków oraz terapii klinicznych, ponieważ może zmniejszyć stan zapalny w komórkach ssaków. Prawdopodobną przyczyną jest to, że stabilizując białka i błony, ektoina chroni ludzkie komórki przed uszkodzeniem, zmniejszając w ten sposób stan zapalny i zapewniając środki zaradcze na takie stany jak alergie, egzema, objawy kaszlu i przeziębienia.
Powrót do Titanica
Pomimo tego, że eksperymenty neutronowe pomogły naukowcom w zrozumieniu sposobu, w jaki bakterie Halomonas rozwijają się w potencjalnie wrogim środowisku wokół zatopionego Titanica, dokładna rola Halomonas titanicae w formacji rdzy pozostaje nadal niejasna. Jest też dobra wiadomość: te zjadające żelazo bakterie mogą odegrać znaczącą rolę w przyszłym gospodarowaniu odpadami, przyspieszając rozkład metalowych śmieci składowanych – prócz historycznych wraków – na dnie oceanu.
Rozpraszanie neutronów
Rozpraszanie neutronów jest potężną metodą badania struktury materiałów, w tym wody i jej interakcji z innymi związkami.
Jądro atomu wodoru jest pojedynczym protonem. Neutrony i protony są co prawda bardzo podobnymi cząsteczkami (poza ładunkiem elektrycznym), ale neutrony rozpraszają protony, odskakując od siebie raczej jak bile w snookerze. Wzorzec rozpraszania neutronów dostarcza informacji na temat lokalizacji atomów tlenu i wodoru w pobliskich cząsteczkach wody, a tym samym dynamicznej sieci wiązań wodorowych, które je łączą.
Kolejna przydatna sztuczka jest wykorzystywana w rozpraszaniu neutronów. Jądra atomów deuteru (izotop wodoru z jednym protonem i jednym neutronem w jądrze) rozprasza neutrony w zupełnie inny sposób niż normalne jądra wodorowe. Zastąpienie wodoru w konkretnym związku (na przykład ektoinie) deuterem pozwala na obserwację udziału tylko tego związku w sygnale rozpraszania, odmiennym od otaczających cząsteczek wody. To z kolei pomaga w ujawnieniu szczegółów ich interakcji.
Rozpraszanie neutronów ze znakowaniem deuterem dostarczyło bogaty zbiór wyników w biologii strukturalnej. Obejmują one wgląd w złożone interakcje pomiędzy cząsteczkami białka oraz między białkami a kwasami nukleinowymi (DNA, RNA).

białek Drzwi aparatury zostały otwarte aby pokazać wygląd detektora neutronów.
©ILL/L. Thion
References
- Zaccai G (2009) The intracellular environment: not so muddy waters. Science in School 13: 19-23.
- Zaccai G et al. (2016) Neutrons describe ectoine effects on water H-bonding and hydration around a soluble protein and a cell membrane. Scientific Reports 6: 31434. doi:10.1038/srep31434
Web References
- w1 – Bakterie Halomonas titanicae zostały odkryte przez naukowców z uniwersytetów w Sewilli, w Hiszpanii, w Toronto oraz w Halifax w Kanadzie. Przeczytaj naukowe sprawizdanie z tego odkrycia na stronie internetowej UNESCO.
- w2 – Współpracujące organizacje, w tym Instytut Laue-Langevin, Instytut Biologii Strukturalnej w Grenoble, we Francji oraz Instytut Biochemii i Biotechnologii im. Maxa Plancka przedsiębiorstwa Bitop w Monachium, Niemcy. Aby uzyskać więcej informacji, przejdź do sekcji informacji uzupełniających w Zaccai et al. (2016).
- w3 – Instytut Laue-Langevin (ILL) z siedzibą w Grenoble, we Francji, jest międzynarodowym centrum badawczym znajdującym się w czołówce nauki i technologii neutronów.
Resources
- Więcej informacji na temat mikrobów żyjących na wrakach statków oraz roli ektoiny znajdziesz w artykule dostępnym na stronie internetowej BBC.
Institutions
Review
Wrak Titanica jest dobrze znany, dlatego artykuł ten można wykorzystać do tego, aby zainteresować uczniów nauką. Może również działać jako zachęta do zagłębienia się w świat bakterii i ich użyteczności dla ludzi – pomimo zwyczajowo negatywnych skojarzeń.
Artykuł może być przydatny w nauczaniu biologii, by odkryć, w jaki sposób organizmy prokariotyczne potrafią przetrwać w ekstremalnych środowiskach oraz w jaki sposób substancje są transportowane przez błonę komórkową. Można go również wykorzystać w nauczaniu chemii o wiązaniach wodorowych i interakcjach między wodą i innymi cząsteczkami. Co wiecej, recykling z wykorzystaniem Halomonas titanicae ma znaczenie w ekologii i badaniach nad równowagą energetyczną w ekosystemach.
Alina Giantsiou-Kyriakou, nauczyciel biologii, szkoła średnia Livadia High School, Cypr





