Zakaźne nowotwory: historia DNA Understand article
Tłumaczenie: Katarzyna Badura. Co powoduje, że komórka staje się nowotworowa – i jak nowotwór staje się zakaźny? Oto drugi z dwóch artykułów traktujących o nowotworach zakaźnych. Elizabeth Murchison tłumaczy co na ten temat mów nam genetyka.

Zdjęcie dzięki uprzejmości
Wayne’a McLean/Wikipedia
Dr Elizabeth Murchison określa swoją pracę mianem „archeologii molekularnej”: zamiast analizy wiekowych kamieni i kości, zajmuje się szczegółowym badaniem cząsteczek DNA, próbując zidentyfikować kluczowe mutacje zmieniające charakter komórek, w których zmiany te miały miejsce.
Celem dr Mirchison jest spisanie historii jak pewna wyjątkowo paskudna choroba – rak pyska diabła, lub DFTD (z ang. Devil Facial Tumour Disease) – pojawiła się i rozprzestrzeniła. Ta zakaźna choroba nie jest powodowana przez wirusy czy bakterie, ale przez komórki nowotworowe, które posiadły umiejętność przenoszenia się z jednego organizmu na drugi, wywołując śmiertelne zmiany nowotworowe u każdego nowego gospodarza. Co prawda DFTD nie dotyka ludzi, ale jest tak zjadliwy, że pomimo tego, iż wykształcił się dopiero w ciągu kilku ostatnich dekad, zagraża gatunkowi, który atakuje – diabłu tasmańskiemu – wyginięciem.
Archeologiczny nowotwór
Dzisiejsza sekwencja nukleotydowa nowotworu DFTD jest tak naprawdę archeologicznym zapisem genomu oryginalnego DFTD sprzed 30 lat z dodatkiem mutacji, które się przez ten okres czasu skumulowały. „Jako archeolodzy molekularnni składamy w jedną całość wariacje genomu, którymi na dzień dzisiejszy dysponujemy i próbujemy ocenić, które występowały w pierwotnej wersji nowotworu diabła, a które pojawiły się w późniejszym czasie” mówi dr Murchison.
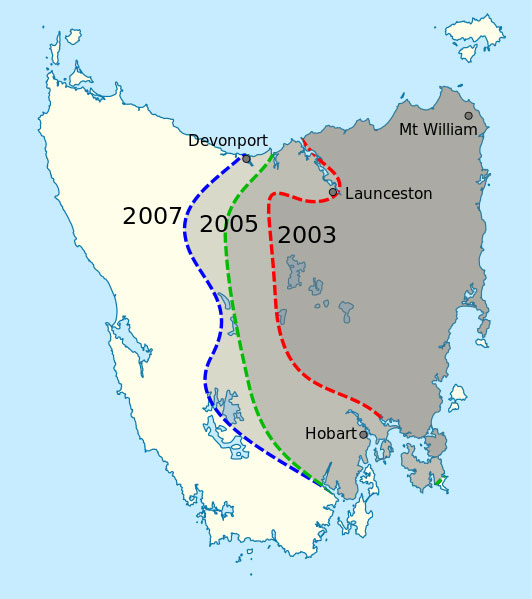
rozprzestrzenienie DFTD w
Tasmanii w roku 2007
Zdjęcie własności publicznej;
źródło zdjęcia: Wikipedia
Wszystkie nowotwory – nie tylko te zakaźne – powstają w momencie, gdy w komórce kumulują się mutacje. Za każdym razem, gdy komórka się dzieli, a jej DNA jest kopiowane, istnieje możliwość, że w wyniku tego procesu dojdzie do nowej mutacji. Inne mutacje pojawiają się w wyniku działania kancerogenów – np. dymu papierosowego lub infekcji wirusem brodawczaka ludzkiego (HPV). Niektóre mutacje, zwiększające ryzyko zachorowania na nowotwór, są dziedziczne, jak np. gen BRCA1, który jest powiązany z nowotworem piersi.
Zazwyczaj, komórki w ludzkich nowotworach mają w swoim DNA od 1000 do 5000 mutacji, ilość ta jednak może wzrosnąć nawet do 100 000 lub więcej jeśli dana jednostka przez długi okres czasu wystawiona jest na działanie kancerogenów.
Zaskakująco mało mutacji
Początkowo, zespół dr Murchison oczekiwał, że ilość mutacji w nowotworze DFTD będzie wyższa niż w ludzkich nowotworach ze względu na wyjątkowe właściwości oraz rzadkość występowania zakaźnych nowotworów – jednak nie w tym przypadku. „Oszacowaliśmy, że DFTD posiada ok. 20 000 mutacji, co jest ilością mniejszą niż w ludzkich nowotworach” mówi dr Murchison. „To sugeruje, że zaraźliwość nie wymaga nieskończonej ilości zmian – wystarczą tylko te kluczowe mutacje, które pozwalają nowotworowi się rozprzestrzeniać i przeżyć w organizmie nowego gospodarza.”
Zespół próbuje obecnie zidentyfikować kluczowe mutacje. Pierwsze zadanie polegało na wyodrębnieniu informacji genetycznej ze zdrowej komórki diabła tasmańskiego i porównaniu jej z DNA nowotworowym. „Musieliśmy zacząć od sekwencjonowania genomu diabła tasmańskiego, bowiem nie posiadaliśmy materiału, do którego moglibyśmy się odnieść” mówi dr Murchison. „Gdybyśmy wykonali sekwencjonowanie jedynie genów pochodzących z nowotworu DFTD, nie mielibyśmy możliwości określenia, które geny są zmutowane, a które normalne.” To było wyzwanie samo w sobie, skalą podobne do opracowania referencyjnego genomu ludzkiegow1.
Kolejny krok – porównanie DNA nowotworu DFTD z genomem referencyjnym – też nie był tak prosty jak by się mogło wydawać. Choroba ewoluowała po raz pierwszy w latach osiemdziesiątych, stąd trudno jest określić, czy różnica znaleziona pomiędzy genomem referencyjnym a konkretnym nowotworem DFTD pochodzi z oryginalnego nowotworu, czy też jest mutacją nabytą w okresie ostatnich 30 lat. Aby oddzielić oryginalne mutacje, które doprowadziły do pojawienia się choroby od zmian, które pojawiły się później, zespół przeprowadza obecnie wielko-ekranowe sekwencjonowanie DNA pochodzącego z setek zdrowych komórek diabłów tasmańskich i porównuje je z DNA pochodzącym z setek komórek nowotworu DFTD.
Póki co, wyniki pokazały, że oryginalny nowotwór zakaźny pojawił się w organizmie żeńskiego osobnika diabła tasmańskiego, bowiem genom nowotworu zawiera dwa osobne chromosomy X. Zidentyfikowano również genetyczną podstawę jednej kluczowej zmiany: właściwość nowotworu do ukrywania się przed układem odpornościowym gospodarza, poprzez usunięcie genu, odpowiedzialnego za produkcję sygnału molekularnego „przyjaciel czy wróg” w normalnej komórce. To odkrycie, w połączeniu z faktem, że diabły tasmańskie są do siebie genetycznie raczej podobne w obrębie populacji, wyjaśnia dlaczego komórki pochodzące od jednego osobnika są w stanie rozmnażać się w organizmie drugiego osobnika, bez wywoływania reakcji immunologicznej. Co więcej, jest ono wykorzystywane w poszukiwaniu szczepionki przeciwko DFTD. Prowadzone badania dodatkowo rzuciły światło na to w jaki sposób komórki nowotworu DFTD ewoluowały w trakcie rozprzestrzeniania się po Tasmanii, pozwalając na wyciągnięcie wniosku, że istnieje kilka genetycznych podtypów nowotworu.
Badania dr Murchison obejmują również analizę drugiego znanego nowotworu zakaźnego – zakaźnego psiego guza wenerycznego (CTVT od Canine Transmissible Venereal Tumour), tzw. „zakaźnego mięsaka”, który pojawia się – co oczywiste – u psów. W tym wypadku, podobnie jak z DFTD, celem badań jest złożenie genetycznych profili zwierząt, u których pierwotna wersja tego nowotworu wystąpiła oraz przeanalizowanie ścieżki jej zmian ewolucyjnych (zobacz okienko).
Genetyka zakaźnego mięsaka
Genetyczna analiza ujawniła, że nowotwory mięsaka zakaźnego, które możemy obserwować dzisiaj mają wszystkie jednego przodka, który ujawnił się 11 000 lat temu! Co więcej, analiza ta dostarczyła informacji o tym, jak wyglądał pierwszy pies – nosiciel CTVT, co widać na załączonym rysunku.
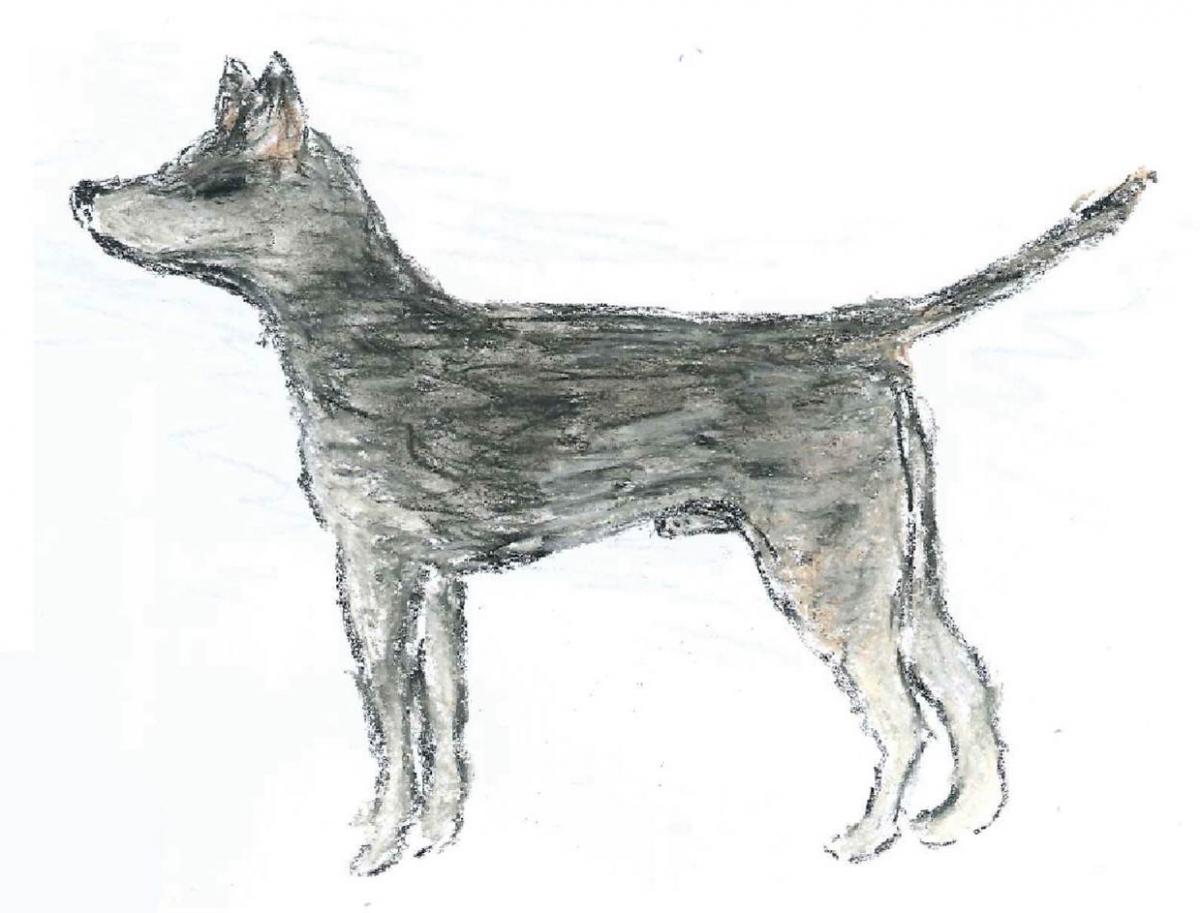
Zdjęcie dzięki uprzejmości Emmy Werner
|
Nazwa genu |
Powiązana cecha fizyczna |
|---|---|
|
ASIP |
‘Agouti’ (mieszany) kolor futra |
|
CBD103 |
Możliwy czarny kolor futra |
|
KRT71 |
Proste lub falowane futro |
|
FGF5 |
Krótki włos |
|
IGF1 |
Średni lub duży rozmiar |
|
BMP3 |
Prawdopodobnie spiczasty pysk |
|
MGAM |
Przystosowany do diety pełnej skrobi I mięsa |
Walka o przetrwanie
Z powrotem w Tasmanii, ludzie walczą o ochronę diabłów tasmańskich, nie opierając się jedynie na działaniach badawczych w celu radzenia sobie z zagrożeniem DFTD. Rozpoczęto projekt ochrony dzikiej przyrody, którego celem jest stworzenie nowej populacji zdrowych diabłów tasmańskich i umieszczenie jej na własnej małej wyspie, oddzielonej od głównej populacji. Tak więc, podczas gdy prace badawcze nad zrozumieniem tej niszczącej choroby są nadal prowadzone, przyszłość tych małych dzikich zwierząt zdaje się przedstawiać w jaśniejszych barwach. “Mamy jasno określony współny cel, próbując coś zrobić, by pomóc diabłom” mówi dr Murchison.
Web References
- w1 – Referencyjny genom ludzki został określony w ramach Projektu Poznania Ludzkiego Genomu (Human Genome Project). Aby uzyskać więcej informacji wejdź na stronę projektu.
Resources
- Jako wstęp do problemu DFTD zapoznaj się z pierwszym z dwóch artykułów Science in School poruszających ten temat:
- Watt S (2015) Zakaźne nowotwory. Science in School 32: 6–9.
- Poczytaj więcej o DFTD i wysiłkach aby uratować diabła tasmańskiego.
- Posłuchaj krótkiego wykładu w którym Elizabeth Murchison opowiada słuchaczom o swojej pracy.
- Jeśli interesujesz się problemem nowotworów zakaźnych, zobacz:
- Giles C (2010) Sympathy for the devil. Wellcome News 62: 8–9
- Publikację z Wellcome News można pobrać ze Strony internetowej Wellcome Trust.
Review
Druga część historii DFTD jest skupiona na genetyce nowotworów zakaźnych. DFTD jest straszną chorobą dziesiątkującą populację diabłów tasmańskich.
Artykuł ten można wykorzystać do omówienia nowych tematów, takich jak ‘molekularna archeologia’, sekwencjonowanie DNA/genomu, oraz aspektów immunologicznych normalnych i zakaźnych nowotworów. Możliwe, że najbardziej interesująca koncepcja została poruszona w ostatnim akapicie tekstu, opisującym strategie ochrony diabła tasmańśkiego. Możnaby to wykorzystać do zapoczątkowania debaty o problemach etycznych i granicach działań ochronnych:
- Czy ludzie powinni ingerować w proces selekcji naturalnej?
Ewentualnie, czy ludzie powinni próbować ocalić gatunki, które są zagrożone z przyczyn naturalnych?
- Biorąc pod uwagę dokonane przez Darwina odkrycie kilkunastu gatunków ptaków, zwanych ziębami Darwina, czy mamy prawo wybierać i separować grupę osobników od głównej populacji? Jakie konsekwencje dla gatunku niesie ze sobą izolacja rozrodcza jego populacji?
Podobnie jak pierwszy artykuł o tej tematyce, artykuł ten motywuje nauczycieli biologii do pogłębienia ich wiedzy w poruszanych kwestiach.
Luis M. Aires, szkoła średnia im. Antonio Gedeao, Portugalia





