Supporting materials
Dwutlenek węgla – informacje podstawowe (Word)
Dwutlenek węgla – informacje podstawowe (Pdf)
Historie o dwutlenku węgla (Word)
Historie o dwutlenku węgla (Pdf)
Download
Download this article as a PDF

Tłumaczenie Ola Jeglińska. Marlene Rau prezentuje gazowane ćwiczenia z użyciem dwutlenku węgla, stworzone przez Chemol i Science on the Shelves.

Dwutlenek węgla (CO2) jest nie tylko jednym z najważniejszych gazów cieplarnianych, lecz także znajduje się wszędzie wokół nas: w powietrzu (0.0388%), którym oddychamy; w powietrzu (4%), które wydychamy; w napojach gazowanych, w ciastach, które wyrastają dzięki dwutlenkowi węgla uwalnianemu przez proszek do pieczenia; oraz przy spalaniu takich związków organicznych jak parafina, papier, drewno i ropa naftowa. Używany jest w postaci płynnej w gaśnicach oraz jako środek zamrażający w przemyśle spożywczym (na przykład przy przechowywaniu i transporcie lodów).
Duże stężenia dwutleneku węgla mogą stanowić zagrożenie dla ludzi i zwierząt, będąc zarazem źródłem życia: podczas fotosyntezy rośliny potrzebują dwutlenku węgla i światła do produkcji cukrów, skrobii, tłuszczów i białek, a także tlenu, którego potrzebujemy, aby przeżyć.
Następujące ćwiczenia edukacyjne stworzone przez Chemolw1 i Science on the Shelvesw2 (zobacz ramkę) są wprowadzeniem do nauki o tym ważnym gazie, przeznaczonym dla uczniów szkół podstawowych. Aby ćwiczenia były pouczające, w bibliografii zawarto więcej źródeł na tematy takie jak chemia, wykrywanie i występowanie dwutlenku węgla oraz jego fizjologiczne znaczeniew3.

NB: ilości dwutlenku węgla wyprodukowanego podczas tych ćwiczeń nie są wystarczające, aby stanowić zagrożenie.
Gdy wrzucasz musującą tabletkę do szklanki z wodą, lub dodajesz do wody proszek do pieczenia powstają bąbelki: produkowany jest gaz. Możesz wykorzystać ten gaz do nadmuchania balonu. Jaki to gaz? Zbierzmy go i zbadajmy.

Pierwsze sześć kroków jest wspólne dla wszystkich ćwiczeń – potem następują dwie opcje do wyboru.
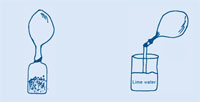
Gdy balon przestanie napełniać się, zakręć jego koniec, żeby gaz nie uciekł i zdejmij balon z butelki.
Ten sposób wykrycia dwutlenku węgla z użyciem wody wapiennej został odkryty przez chemika Josepha Blacka (1728 – 1799). Zarówno cement jak i zaprawa murarska zawierają wodorotlenek wapnia (Ca(OH)2). Gdy dwutlenek węgla dodany jest do rozwodnionego Ca(OH)2, wydzielają się maleńkie cząsteczki węglanu wapnia (CaCO3) powodując, że woda wapienna mętnieje.
Skąd wziął się dwutlenek węgla? Zarówno proszek do pieczenia, jak i tabletki musujące zawierają sodę oczyszczoną czyli wodorowęglan sodu (NaHCO3) oraz kwas krystaliczny (taki jak kwas cytrynowy). W zetknięciu z wodą, soda oczyszczona wchodzi w reakcję z kwasem powodując powstanie wody i dwutlenku węgla. Gaz ten powoduje formowanie się bąbelków po rozpuszczeniu tabletki musującej; powoduje on też, że ciasto wyrasta.
Świeczka powinna zgasnąć ponieważ gaz (CO2) stłumi jej płomień.
Tak jak poprzednio świeczka gaśnie, co dowodzi, że gaz przelany został z jednego kubka do drugiego, tak jakby był cieczą. Świadczy to, że dwutlenek węgla jest cięższy niż powietrze.
Chemolw1 to projekt Uniwersytetu w Oldenburgu, w Niemczech, mający na celu wprowadzenie uczniów szkół podstawowych w podstawy chemii. Zespół, w którego skład wchodzą nowi absolwenci szkół nauczycielskich, jest prowadzony przez Dr Julię Michaelis i organizuje warsztaty dla dzieci pod hasłem ogień, ziemia, powietrze i woda, a także zajęcia dla nauczycieli szkół podstawowych.
Inne ćwiczenia Chemolu o dwutlenku węgla to budowa gaśnicy z użyciem CO2, eksperymenty z napojami gazowanymi, pomiary ilości gazu wyprodukowanego przez jedną tabletkę musującą i testowanie wpływu temperatury na rozpuszczalność dwutlenku węgla w wodzie. Szczegóły można znaleźć na stronie Chemoluw1.
Science on the Shelves (Nauki przyrodnicze na półkach) to strona internetowaw2 ze wskazówkami na temat różnego rodzaju prostych eksperymentów naukowych z użyciem jedzenia i innych produktów sklepowych, nadających się dla dzieci w wieku od 6 do 11 lat oraz ich nauczycieli i rodziców. Projekt powstał w Wielkiej Brytanii i prowadzony jest przez Dr Nigela Lowe’a we współpracy z Uniwersytetem w Yorku oraz Engineering and Physical Sciences Research Council (Instytut Badawczy Nauk Ścisłych i Inżynierii). Skontaktuj się z Nigelem jeżeli masz dobry pomysł na eksperymenty dla dzieci.
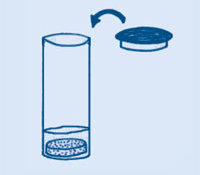
Wymieszaj 3 łyżki sody oczyszczonej i 1 łyżkę spożywczego kwasu cytrynowego. Aby nadać mieszaninie lepszy smak dodaj 2-4 łyżki cukru pudru, albo 1 łyżkę proszku do galaretki i 1 łyżkę cukru. Oranżada w proszku jest gotowa.
Kryształy kwasu cytrynowego rozpuszczają się na języku i wchodzą w reakcję z sodą oczyszczoną. Powstają bąbelki gazu, który powoduje musowanie odczuwane na języku. Aby zrobić napój musujący, należy wymieszać proszek w szklance wody.
Rakiety i materiały wybuchowe działają na zasadzie emisji dużych ilości gazu w krótkim czasie. Możesz stworzyć własną rakietę za pomocą kwasu cytrynowego i proszku do pieczenia lub tabletek musujących.
Następujące eksperymenty powodują szybkie poruszanie się małych obiektów. Przestrzegaj zasad bezpieczeństwa i miej na sobie ochronne okulary. Ćwiczenia nie powinny być wykonywane w zamkniętym pomieszczeniu. Zobacz też instrukcja bezpieczeństwa.
Od momentu umieszczenia armaty „z pociskiem” na platformie startowej nie pozwól uczniom zaglądać do wnętrza pojemnika. Jeżeli armata nie wystrzeli (co zdarza się jeśli nakrywka nie jest wystarczająco szczelna), bardzo ostrożnie otwórz pojemnik z głową odwróconą w przeciwną stronę.

Kiedy kwas cytrynowy i soda oczyszczona rozpuszczą się w wodzie, zachodzi między nimi reakcja, której produktem jest dwutlenek węgla. Tabletki musujące zawierają oba składniki (sodę oczyszczoną i kwas), między którymi zajdzie reakcja po dodaniu do wody. Otrzymany gaz zacznie rozpierać ścianki i nakrywkę armaty. W momencie gdy ciśnienie osiągnie siłę większą niż najsłabszy punkt pojemnika (nakrywka), armata efektownie wystrzeli wysyłając nakrywkę nawet 5 metrów w górę i wypuszczając gaz.
Zmierz czas między startem a wybuchem armaty, a następnie eksperymentuj z ilościami: na przykład postaraj się, żeby wybuch armaty nastąpił dokładnie po 1 minucie.

Dwutlenek węgla może być niebezpieczny jeśli zgromadzi się w wystarczająco wysokim stężeniu. Aby monitorować ten i inne niebezpieczne gazy w miejscu pracy, EFDA-JETw4 stosuje różne urządzenia – zarówno instalowane w budynkach, jak i przenośne – wykrywające gazy, które obniżają stężenie tlenu i mogą prowadzić do uduszenia. Monitorowane gazy to nie tylko dwutlenek węgla, lecz także azot (stosowany przy gaszeniu pożarów), heksafluorek siarki (SF6, gaz o własnościach izolacyjnych) oraz opary chłodziw takich jak Galden®. Przed rozpoczęciem pracy w obszarach zagrożonych tymi gazami pracownicy muszą sprawdzić zainstalowane urządzenia monitorujące lub zrobić pomiar za pomocą urządzenia przenośnego.
Dwutlenek węgla może być groźny także 350 km ponad powierzchnią Ziemi – dla astronautów na pokładzie Międzynarodowej Stacji Kosmicznej (ISS – International Space Station), wspólnego projektu Europejskiej Agencji Kosmicznej (ESA – European Space Agencyw5 i innych partnerów międzynarodowych.
Gdy istoty ludzkie oddychają, wdychają tlen i wydychają dwutlenek węgla. W rezultacie, jeśli przebywają na zamkniętych obszarach takich jak statki podwodne, samoloty czy stacje kosmiczne, poziom tlenu spada, a dwutleneku węgla rośnie, stając się źródłem zagrożenia dla załogi (tak jak w filmie Apollo 13).
W chwili obecnej ISS stosuje metodę „otwartą”: zamykając dwutlenek węgla w specjalnych pojemnikach (zawierają one na przykład wodorotlenek litu (LiOH), który reaguje z dwutlenkiem węgla, dając węglan litu i wodę) i transportując pojemniki z tlenem z Ziemi. W przyszłości ISS stosować będzie zamkniętą metodę „zamkniętą”, opartą na recyklingu: odzyskując tlen z dwutlenku węgla poprzez zastosowanie techniki z pogranicza fizyki i chemii (w zasadzie „odcinając” tlen od węgla) albo przy użyciu alg i innych roślin (fotosynteza).
EFDA-JET i ESA są członkami EIROforumw6, wydawcy Science in School.

„Gejzer” pochodzi od staronordyjskiego słowa geysa znaczącego „tryskać”. Użyte było po raz pierwszy w nazwie gejzeru Geysir – gorącego źródła w dolinie Haukadalur, w Islandii, które wyrzucało wodę na wysokość niemal 70 metrów. Obecnie termin stosowany jest bardziej ogólnie do opisu źródeł sporadycznie wyrzucających słupy wody. Oprócz gejzerów zasilanych gorącą wodą istnieją też zimne gejzery, zasilane dwutlenkiem węgla. Wyrastający z głębin Ziemi gaz gromadzi się na dnie podziemnych zbiorników wodnych, a jego ciśnienie rośnie. Gaz jest regularnie uwalniany przybierając postać fontanny zimnej wody. Tego typu gejzer może znajdować się bliżej, niż mogłoby się wydawać – na przykład w Herl’any na Słowacji albo w Walleborn oraz w okolicach Andernach, w Niemczech.
W przeciwnym razie możesz samodzielnie stworzyć mały gejzer przy użyciu plastikowej butelki po płynie do mycia naczyń (z ruchomą zatyczką, zobacz obraz poniżej). Do pustej butelki wlej 200 ml wody. Dodaj czubatą łyżeczkę sody oczyszczonej i wstrząśnij.

Następnie dodaj około 35 ml płynu do mycia naczyń, ponownie wstrząśnij. Przy użyciu lejka szybko dodaj trzy czubate łyżeczki kwasu cytrynowego. Bardzo szybko zatkaj butelkę, wstrząśnij i pociągnij zatyczkę, żeby ją otworzyć.
Fontanna z piany siegająca nawet 5 metrów wysokości wystrzeli w powietrze. Możesz też poczekać, aż zakrętka sama się otworzy. Tak czy inaczej, po chwili ciśnienie uwolni się, a fontanna przestanie tryskać. Zamknij butelkę; po około 30 sekundach ciśnienie znów będzie wystarczająco wysokie, żeby ponownie uruchomić gejzer. Eksperyment można powtórzyć kilka razy.
de Vries T (2002) Vitamintabletten einmal anders. Chemkon 9(3): 144-146. doi: 10.1002/1521-3730(200207)9:3<144::AID-CKON144>3.0.CO;2-K
Johnson S (2008) Planting ideas: climate-change activities for primary school. Science in School 10: 55-63. www.scienceinschool.org/2008/issue10/psiclimate
Shallcross D, Harrison T (2011) Is climate change all gloom and doom? Introducing stabilisation wedges. Science in School 20: 60-64. www.scienceinschool.org/2011/issue20/wedges
Artykuł ten prezentuje proste sposoby na odkrycie tajemnic nauki. Umożliwia lepsze zrozumienie zjawisk naturalnych i kryjących się za nimi faktów, tak codziennych czynności (jak oddychanie), jak i sporadycznych (erupcje wulkanówa). Może zainspirować on uczniów do dalszych eksperymentów. Zarówno na skali globalnej (ocieplenie klimatu), jak i znacznie mniejszej (eksperymenty) artykuł unaocznia uczniom istniejące zagrożenia oraz konieczność zapobiegania im.
Artykuł nawiązuje do współczesnych wydarzeń i lokalnych zjawisk naturalnych takich jak wybuch wulkanu w Islandii lub źródeł geotermalnych. Może przyczynić się też do wzbudzenia szacunku dla przyrody. Poruszając problemy ekologiczne i środowiskowe, nawiązuje do różnych dziedzin: chemii i fizyki, biologii (oddychanie), geologii, matematyki (pomiary i proporcje) oraz alfabetyzmu (rozumienie instrukcji i reguł).
Młodszym dzieciom spodobają się musujące balony i gejzery; ćwieczenia z wybuchami nadają się dla starszych uczniów.
Maria João Lucena, Portugalia