Supporting materials
Pobierz kartę ćwiczeń 1 (word )
Pobierz kartę ćwiczeń 2 (word )
Pobierz kartę ćwiczeń 2 (pdf )
Download
Download this article as a PDF

Tłumaczenie: Karolina Śmiech. Działalność przemysłowa oraz zjawiska geologiczne mogą niekorzystnie wpływać na jakość wody i powodować jej zanieczyszczenie, co może stanowić zagrożenie dla zdrowia ludzi i dla środowiska. Dowiedz się, jak zostać niezależnym ekspertem i…

Działalność przemysłowa, a także naturalne zjawiska geologiczne mogą szkodliwie wpływać na jakość wody, zanieczyszczając ją nawozami, pestycydami, jonami metali i związkami organicznymi, stanowiącymi zagrożenie dla zdrowia ludzi i dla środowiska. Dlatego tak ważna jest nieustanna kontrola jakości wody słodkiej, np. w rzekach.
Eksperci ds jakości odgrywają kluczową rolę w chronieniu nas przed zanieczyszczonymi źródłami wody. Regularnie kontrolują jakość wody za pomocą analiz ilościowych (takich, jak określanie stężenia jonów w roztworze), badając próbki pobrane zarówno przed, w trakcie, jak i po procesie oczyszczania ścieków.
W przedstawionym ćwiczeniu zadaniem uczniów jest wcielić się w rolę eksperta ds. jakości wody pracującego przy zakładzie przemysłowym podobnym do należącej do koncernu Tata Steel fabryki w Scunthorpe w Wielkiej Brytanii. Uczniowie muszą odnieść się do konkretnej sytuacji zaistniałej na terenie zakładu, wykonać odpowiednie analizy i określić, czy tiocyjaniany są skutecznie usuwane ze ścieków.

Jony tiocyjanianowe (SCN–) są toksyczne dla organizmów żyjących w wodzie. Wiadomo też, że u ludzi niekorzystnie wpływają na pracę tarczycy, obniżając jej zdolność do produkowania hormonów niezbędnych dla prawidłowego funkcjonowania organizmu.
Źródeł tiocyjanianów może być wiele. Na przykład procesy zgazowania węgla czy też wytwarzania z węgla związków wykorzystywanych w różnych gałęziach przemysłu mogą prowadzić do powstawania sporych ilości jonów tiocyjanianowych, a także innych szkodliwych związków, np. fenoli czy amoniaku. Dlatego też substancje te stanowią składnik ścieków produkowanych przez dany zakład przemysłowy.
Tiocyjaniany są również obecne tam, gdzie w procesie wydobywania metali z rud używa się cyjanków. Cyjanki reagują z naturalnie występującą w rudach metali siarką, tworząc tiocyjaniany:
8CN– + S8 → 8SCN–
Również niektóre pestycydy zawierają tiocyjaniany jako substancje czynną. Śladowe ilości tiocyjanianów są naturalnie wytwarzane w ludzkim ciele jako produkt uboczny metabolizmu cysteiny oraz procesu unieszkodliwiania cyjanków – z organizmu wydalane są wraz z moczem. Tiocyjaniany mogą znaleźć się w organizmie człowieka na skutek palenia papierosów. Stanowią też produkt uboczny metabolizmu niektórych leków na nadciśnienie.
Proces usuwania jonów tiocyjanianowych ze ścieków ma miejsce w ogromnych, otwartych, betonowych zbiornikach zawierających tzw. osad czynny – biologicznie aktywny materiał, w którego skład wchodzą różnorodne mikroorganizmy zdolne do rozłożenia tiocyjanianów oraz innych zanieczyszczeń na mniej szkodliwe substancje. Chemiczna reakcja unieszkodliwiania tiocyjanianów przebiega zgodnie z równaniem:
SCN– + 3H2O + 2O2 → HCO3– + NH4+ SO42- + H+
Reakcja ta jest przykładem procesu bioremediacjiw1, w którym do oczyszczania skażonej gleby bądź wód podziemnych wykorzystuje się bakterie. Do oczyszczenia skażonych terenów można również wykorzystać rośliny, w procesie zwanym fitoremediacjąw2.
Wodę przed i po oczyszczaniu można poddać prostej analizie na obecność jonów cyjanianowych. Jeśli po dodaniu chlorku żelaza (III) roztwór zabarwi się na kolor krwistoczerwony, oznacza to, że znajdują się w nim tiocyjaniany, zgodnie z reakcją:

Fe3+(aq) + SCN–(aq) → [FeSCN]2+(aq)
a dokładniej:
[Fe(H2O)6]3+(aq) + SCN–(aq) → [Fe(H2O)5SCN]2+(aq) + H2O(l)
Reakcja ta może być użyta jako podstawa analizy ilościowej niwielkich stężeń jonów tiocyjanianowych. Za pomocą kolorymetru można zmierzyć absorbancję kompleksu the [Fe(H2O)5SCN]2+ przy długości fali 480 nm i określić dokładne stężenie tiocyjanianów – pod warunkiem, że nie jest ono zbyt duże. Można też użyć prostej skali do porównywania kolorów – przy czym w tym wypadku otrzymany wynik będzie mniej dokładny i wyłącznie jakościowy.
Jak wyjaśniono w kacie ćwiczeń 1w3, zadaniem uczniów jest wcielić się w rolę ekspertów ds. jakości wody, pracujących dla niewielkiej, niezależnej firmy, która weryfikuje jakość wody w celu zapewnienia, że spełniane są normy brytyjskiej Agencji Środowiska (UK Environment Agency).

Wiadomo, że ścieki wypływające z zakładu przemysłowego Tata Steel w Scunthorpe zawierają tiocyjaniany w stężeniu ok. 250 mg/dm3 (250 ppm), natomiast stężenie określone przez Agencję Środowiska jako bezpieczne wynosi 10 mg/dm3. W związku z tym ścieki są poddawane procesom oczyszczania, w których stężenie tiocyjanianów jest redukowane do 1 mg/dm3 – znacznie poniżej wartości bezpiecznej. Tiocyjaniany są usuwane ze ścieków zanim te zostaną odprowadzone do rzeki Trent.
W ostatnim czasie w rejonie Scunthorpe nastąpiło znaczące obniżenie się temperatury powietrza, co mogło negatywnie wpłynąć na aktywność mikroorganizmów. Zakład przemysłowy jest zaniepokojony, że wydajność oczyszczalni ścieków mogła spaść i tiocyjaniany nie są usuwane w wystarczającym stopniu.
Stężenie tiocyjanianów jest rutynowo mierzone na terenie zakładu trzy razy dziennie za pomocą prostego testu: do próbki wody dodaje się kwasowy roztwór chlorku żelaza (III), a stężenie tiocyjanianów określa się fotometrycznie, tzn. mierząc absorbancję kompleksu żelaza (III) z jonami tiocyjanianowymi. W każdym tygodniu wykonuje się 16 takich oddzielnych pomiarów. Dokładnej analizie poddaje się również próbki ścieków nieoczyszczonych, oraz tych oczyszczonych przed odprowadzieniem do wód rzecznych.
Chemik analityk zatrudniony w zakładzie wykonał już pomiary, ale firma chce również poznać opinię niezależnego eksperta: Twoją!
Podczas pracy z kwasami i tiocyjanianami należy korzystać z okularów ochronnych oraz rękawiczek. Z dokładnym opisem wskazówek dotyczących zasad bezpieczeństwa można zapoznać się na stronie internetowej Science in School oraz na końcu bierzącego wydania magazynu.
Opisane ćwiczenie jest przygotowane z myślą o uczniach w wieku 16-18 lat. Jego wykonanie zajmuje ok. 2 godzin.

1. Przed przeprowadzeniem zajęć przygotuj
a. Roztwór tiocyjanianu potasu (KSCN) o stężeniu 250 mg/dm3 (250 ppm). Rozpuść 4,5 g tiocyjanianu potasu w 500 cm3 wody destylowanej. Następnie rozcieńcz 50 cm3 tak przygotowanego roztworu do objętości 1dm3: w ten sposób otrzymasz roztwór, wktórym stężenie jonów cyjanianowych wynosi 250 mg/dm3.
b. Kwasowy roztwór chlorku żelaza (III) (FeCl3(H2O)6) o stężeniu 0.41 mol/dm3. Rozpuść 50 g FeCl3(H2O)6 w ok. 250 cm3 roztworu kwasu solnego (HCl) o stężeniu 1 mol/dm3
c. Dwanaście oznakowanych próbek zawierających różne stężenia jonów tiocyjanianowych
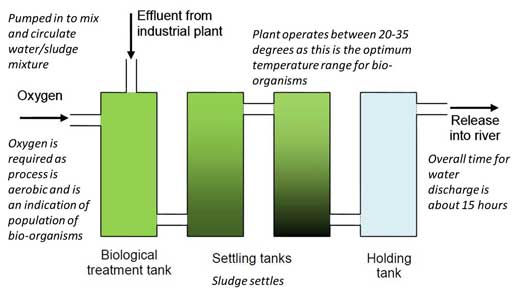
2. Rozdaj uczniom schemat oczyszczalni ścieków (Ryc. 1), karty ćwiczeń 1w3 z opisem scenariusza zajęć oraz karty ćwiczeń 2w4 ze szczegółowym opisem procesu analizy próbek.
3. Zadaniem uczniów jest napisać list to firmy obsługującej oczyszczalnię ścieków, w którym proszą o przesłanie próbek do analizy. W liście powinno zostać jasno określone, w których punktach procesu oczyszczania ścieków należy pobrać próbki i w jakim czasie należy to zrobić. List powinien też określać ilość potrzebnych próbek oraz ich objętość, a także sposób, w jaki należy je pobrać oraz rodzaj pojemników, w których mają być przechowywane.
4. Uczniowie wykonują analizy w parach, zgodnie z procedurą opisaną w karcie ćwiczeń 2w4.

Uwaga: używaj okularów ochronnych. Chlorek żelaza (III) jest substancją drażniącą.
1. Przygotuj krzywą kalibracyjną
a.Trzy buirety napełnij następującymi substancjami: roztworem tiocyjanianu potasu o stężeniu 250 ppm, wodą destylowaną, roztworem chlorku żelaza (III)
b. Do sześciu kolb miarowych o pojemności 100 cm3 przenieś następujące objętości roztworu tiocyjanianu potasu o stężeniu 250 mg/dm3: 0,0, 2,0, 4,0, 6,0, 8,0 oraz 10,0 cm3. Oznacz kolby literami od A do F.
c. Każdą z kolb dopełnij wodą destylowną do objętości ok. 80 cm3.
d. Do każdej z kolb dodaj 10 cm3 chlorku żelaza (III). Następnie dopełnij wodą destylowaną do objętości 100 cm3 i dokładnie wymieszaj.
|
Kolba |
a |
b |
c |
d |
e |
f |
|---|---|---|---|---|---|---|
|
Objętość roztworu tiocyjanianu potasu (cm3) |
0.0 | 2.0 | 4.0 | 6.0 | 8.0 | 10 |
|
Stężenie tiocyjanianów (ppm) |
0 | 5 | 10 | 15 | 20 | 25 |
e. Przy pomocy kolorymetru zmierz absorbancję każdego z roztworów.
f. Zrób wykres zależności absorbancji (oś y) od stężenia tiocyjanianów (ppm) (oś x) dla sześciu przygotowanych roztworów.
2. Zbadaj próbkę
a. Przenieś 10 cm3 roztworu tiocyjanianu o nieznanym stężeniu do kolby miarowej o pojemności 100 cm3. Dopełnij wodą do objętości ok. 80 cm3.
b. Dodaj do kolby 10 cm3 roztworu chlorku żelaza (III). Następnie dopełnij wodą destylowaną do objętości 100 cm3. Dokładnie wymieszaj.
c. Przy pomocy kolorymetru zmierz absorbancję roztworu.
d. Korzystając przygotowanej wcześniej krzywej kalibracyjnej, określ stężenie tiocyjanianów w badanej próbce.
3. Napisz sprawozdanie dla firmy kierującej oczyszczalnią ścieków. W sprawozdaniu streść otrzymane wyniki badań oraz przedstaw zalecenia dotyczące tego, czy oczyszczone ścieki mogą zostać bezpiecznie odprowadzone do rzeki czy też nie. Przedstaw dowody, na których opierasz swoje zalecenia oraz uwagi dotyczące wiarygodności otrzymanych wyników, biorąc pod uwagę wszelkie ewentualne błędy pomiarowe.
Badania nad procesem edukacji ujawniają wysoką wartość przedstawiania pojęć teoretycznych za pomocą “żywych” scenariuszy i projektów – bądź też w kontekście tzw. problemów „z życia wziętych”. Przedstawione tutaj ćwiczenie stanowi doskonały przykład umieszczenia klasycznych zagadnień z dziedziny chemii analitycznej w kontekście rzeczywistego problemu, zadania. Ćwiczenie jest też doskonałą okazją do pracy nad umiejętnościami opracowywania i przedstawiania danych oraz komunikacji.
Marie Walsh, Limerick Institute of Technology, Irlandia