Hoe voorkomt het lichaam dat meerdere spermacellen een eicel bevruchten? Understand article
Het volgende is aangepast vanuit een ESRF nieuwsbericht.
Je zult niet passeren: ontdek hoe het eiwitomhulsel rond een eicel na de bevruchting ‘dichtritst’ om te voorkomen dat er nog meer sperma binnendringt.

Volgens de Wereldgezondheidsorganisatie (WHO) treft onvruchtbaarheid wereldwijd ongeveer 17,5% van de volwassen bevolking. Er zijn veel mogelijke oorzaken en beide partners kunnen er last van hebben. Sommige gevallen van onvruchtbaarheid worden in verband gebracht met mutaties in de genen die verantwoordelijk zijn voor de vorming van eiervacht. De bekleding van het ei, ook bekend als de zona pellucida (ZP), is een extracellulaire matrix die essentieel is voor de groei van eieren, bevruchting en bescherming van het embryo totdat het zich in de baarmoeder nestelt. Het ZP bestaat uit verschillende eiwitten, die polymeriseren tot lange filamenten die een ‘maas’ rond het ei vormen.
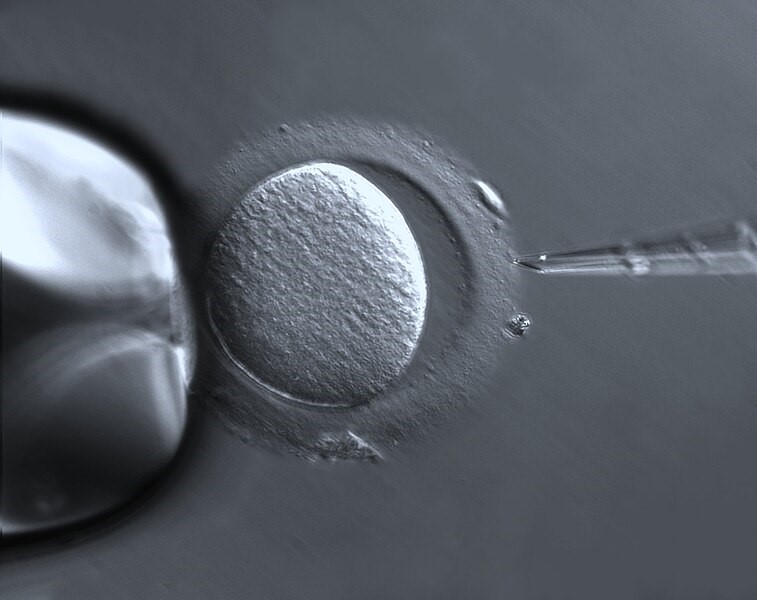
Afbeelding: ZEISS Microscopy/Wikipedia, CC BY-SA 2.0
Mutaties in ZP-eiwitten kunnen defecten in of het ontbreken van dit gaas veroorzaken. Het is momenteel onduidelijk hoeveel onvruchtbare vrouwen drager zijn van pathogene mutaties in de ZP-genen, omdat niet bij iedereen de reeks van hun genoom is bepaald. Desondanks, zijn er tot nu toe verschillende soorten ZP-mutaties gerapporteerd.
Om te begrijpen hoe deze mutaties vruchtbaarheid beïnvloeden, moeten we de processen begrijpen die plaatsvinden tijdens de bevruchting op moleculair niveau. Een team van onderzoekers heeft ontdekt hoe de herschikking van ZP-filamenten de bevruchting van een eicel door meer dan één spermacel (polyspermie) voorkomt, wat over het algemeen dodelijk is voor het embryo. Wetenschappers wisten al dat, nadat een sperma met een eicel is versmolten, de eicel een enzym vrijgeeft dat een belangrijk ZP-eiwit splitst, genaamd ZP2. Ook was bekend dat de bekleding van de eicel na de bevruchting ‘steviger’ wordt en dat extra sperma dan niet meer kan passeren. Het verband tussen deze processen en de basis van de blokkade tegen polyspermie blijft echter onduidelijk. “We wisten dat deze gebeurtenissen met elkaar verband hielden, maar een moleculair mechanisme dat de verschillende puzzelstukjes met elkaar verbond, ontbrak”, legt prof. Luca Jovine uit, leider van de studie.
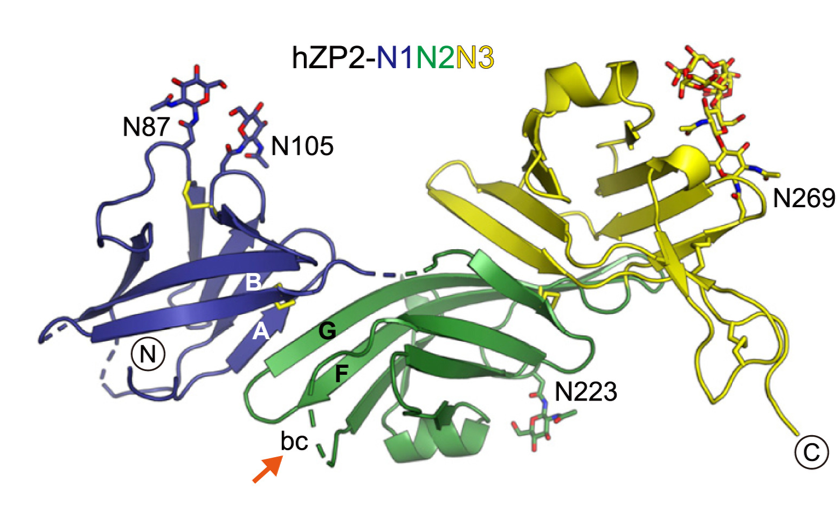
Afbeelding aangepast van Ref [1]
Het team wilde de structuur van ZP2 onderzoeken voor en na de splitsing veroorzaakt door fusie van eicel en sperma, en hoe ZP2-splitsing de algehele structuur van het ZP-gaas verandert. Om dit te doen, onderzochten ze verschillende ZP2- en eicel bekleding-filamentstructuren met behulp van röntgenkristallografie bij de ESRF, Diamond Light Source en BESSY II, evenals cryo-elektronenmicroscopie bij SciLifeLab. Volgens Daniele de Sanctis, wetenschapper die verantwoordelijk is voor bundellijn ID29: “Het zien van de atomaire details van zo’n fundamenteel levensproces is gewoonweg verbazingwekkend.”

© S. Candé
Jovine en collega’s ontdekten dat de splitsing van het deel van ZP2 dat uit de eicel bekleding-filament steekt (zie figuur 2) het mogelijk maakt om nieuwe interacties aan te gaan met andere ZP2-moleculen. Deze interacties creëren een uitgebreid netwerk van kruisverbindingen die de filamenten dichter bij elkaar brengen. Door de eicel bekleding te verstevigen en het gaas strakker te maken, wordt voorkomen dat extra sperma de ZP binnendringt. Het is net als een ritssluiting die wordt dichtgemaakt.
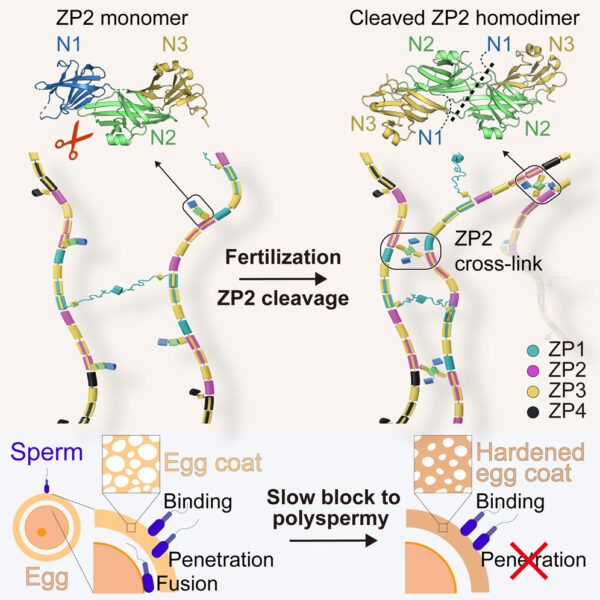
Afbeelding aangepast van Ref [1]
Mechanisch systeem
Het systeem blokkeert polyspermie niet door te voorkomen dat sperma zich aan de ZP bindt (zoals eerder werd aangenomen), maar eerder door de penetratie van sperma in de eicel bekleding te belemmeren. Het mechanische systeem dat we ontdekten is vanuit evolutionair oogpunt heel logisch, omdat het sperma permanent blokkeert op een manier die niet afhankelijk is van hoe ze zich hechten aan de eicel bekleding, wat per soort kan variëren.
Hoewel deze bevindingen zich op een fundamenteel niveau bevinden, hebben ze belangrijke implicaties voor de toekomstige reproductieve geneeskunde: voor het eerst hebben we een moleculair beeld van hoe de eicel bekleding na de bevruchting van architectuur verandert en hoe dit de functie ervan beïnvloedt. Deze kennis stelt ons in staat een groeiend aantal menselijke ZP-genmutaties te interpreteren die verband houden met vrouwelijke onvruchtbaarheid. Bovendien, aangezien de eicel bekleding nodig is voor natuurlijke bevruchting (maar niet voor in-vitrofertilisatie), zou gedetailleerde informatie over de structuur ervan diagnostische toepassingen kunnen hebben en, in principe, kunnen worden benut om niet-hormonale anticonceptiva te ontwikkelen.
De structurele biologiebundellijnen van het ESRF hebben een zeer belangrijke rol gespeeld in deze studie. In 2017 lieten ze Jovine en de Sanctis een eerste voorbeeld geven van hoe eicel bekleding en sperma elkaar herkennen aan het begin van de bevruchting, en in 2010 konden ze de 3D-structuur van ZP3 oplossen, een andere belangrijke subeenheid van eicel bekleding die ook betrokken is bij spermabinding. Er zijn al nieuwe experimenten gepland die mogelijk zullen worden gemaakt door de nieuwe Extremely Brilliant Source bij de ESRF.
Het ESRF

De ESRF is ‘s werelds helderste synchrotronlichtbron. Elk jaar reizen 9000 wetenschappers uit 21 partnerlanden en van over de hele wereld naar Grenoble om de uiterst briljante röntgenfoto’s te gebruiken voor toonaangevend onderzoek. Dit fundamentele en toegepaste onderzoek draagt bij aan het aanpakken van de complexe uitdagingen wereldwijd waarmee onze samenleving wordt geconfronteerd, zoals gezondheid, energie en het milieu. Het draagt ook bij aan de ontwikkeling van nieuwe technologieën voor de industrie en aan het behoud van het culturele erfgoed van de mensheid, en verlicht zo de weg naar een duurzame en vreedzame toekomst.
De kracht van het ESRF is haar vermogen om te innoveren, grenzen te verleggen en steeds hogere prestaties na te streven ten behoeve van de wereldwijde wetenschappelijke gemeenschap. In 2020 lanceerde de ESRF een gloednieuwe generatie hoogenergetische synchrotron, de Extremely Brilliant Source (EBS) van de ESRF. Met de steun van de 21 partnerlanden van de ESRF biedt EBS wetenschappers nieuwe mogelijkheden om de structuur van materialen en mechanismen van het leven te onthullen, tot aan de atomaire resolutie.
References
[1] Nishio S et al (2024) ZP2-splitsing blokkeert polyspermie door de architectuur van de eiervacht te moduleren. Cel 187: 1440–1459. doi: 10.1016/j.cell.2024.02.013
Resources
- Ontdek hoe wetenschappers hebben vastgesteld in welk seizoen de asteroïde die de dinosauriërs doodde de aarde trof: Capellas Espuny M (2022) The reign of the dinosaurs ended in spring. Science in School 57.
- Ontdek hoe kunstmatige intelligentie de vouwing van eiwitten helpt voorspellen: Heber S (2021) From gaming to cutting-edge biology: AI and the protein folding problem. Science in School 52.
- Ontdek de fascinerende wereld van niet-coderende RNA’s: Koskova Z, Hernandez M (2023) Not just a blueprint for proteins: the importance of non-coding RNAs. Science in School 65.
- Leer hoe hightech wetenschap kan worden toegepast op de studie van oude kunst en beroemde schilderijen: Capellas Espuny M (2019) Art and science from Pompeii to Rembrandt. School 48: 20–22.
- Ontdek de schoonheid van eiwitten met het PDB Art-project: Gupta D, Armstrong D (2021) Bringing the beauty of proteins to the classroom: the PDB Art Project. Science in School 54.
- Leer hoe u relevante gegevens over een gen uit biologische databases kunt verzamelen: Grazioli C, Viale G (2022) A chromosome walk. Science in School 57.
- Gebruik lactase om de biochemie van suikers en de eigenschappen van enzymen te onderzoeken: Rautenstrauch H, Ruppersberg K, Thomsen S (2024) Explore enzymes and the science of lactose intolerance using lactase tablets. Science in School 66.





