Supporting materials
Download
Download this article as a PDF

Traduzione di Leonardo Bertolai, Liceo Scientifico Esedra, Lucca. Avete mai assaporato la drammaticità della scienza? I colori, gli odori, la complessità? Perché non seguire il consiglio dell'insegnante di scienze Bernhard Sturm? “Fate in modo che i vostri studenti portino più teatralità…

Il teatro può mettere insieme componenti dell’arte, della musica e dello sport, e sviluppare la creatività e la forma fisica degli studenti, così come la loro consapevolezza delle emozioni e del senso estetico. Come ogni attività di gruppo, promuove inoltre la comunicazione e la cooperazione fra i vostri allievi. Allora, perché non usare il teatro per l’insegnamento delle scienze?
Questo articolo offre una selezione di attività basate sul teatro, per mettere o rimettere in scena le scienze nelle classi di chimica o fisica.
Questo è un modo per visualizzare lo scambio di ossigeno tra differenti atomi di metallo all’interno delle serie di Redox (secondo Lavoisier). Ciascuno studente indossa un cappuccio di uno dei tre colori, che rappresenti gli atomi di ossigeno e due metalli differenti (dovrebbe esserci un numero uguale di ciascun colore). In gruppi di circa 8-10 ragazzi, gli studenti inscenano semplici reazioni Redox 1:1, come ad esempio CuO + Fe à Cu + FeO, dopodiché le mostrano a tutta la classe. Spesso gli allievi trovano modi creativi per rappresentare sia l’attivazione che il rilascio di energia in queste reazioni.
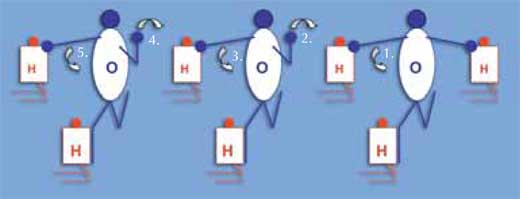
Il seguente metodo può essere usato per dimostrare come la corrente elettrica passi velocemente attraverso l’acqua, anche se non ci sono elettroni ad attraversarla: al contrario, è una carica positiva a spostarsi. Gli studenti, in questa simulazione, dovrebbero indossare cappucci di uno dei due colori, che rappresentano atomi di idrogeno e ossigeno (in rapporto 2:1). Fate loro formare una linea di molecole d’acqua: ciascuna molecola consiste di due atomi di idrogeno (ragazzi in ginocchio) e un atomo di ossigeno (in piedi). L’atomo di ossigeno tocca un atomo di idrogeno con il suo piede destro (vedi il grafico sulla destra). Gambe e braccia dell’atomo di idrogeno non vengono impiegate. Un altro atomo di idrogeno aggiuntivo è attaccato all’atomo di ossigeno (toccato dalla sua mano sinistra) alla fine di una delle linee (H3O+). Le braccia e le gambe dello studente-ossigeno rappresentano una coppia di elettroni. La coppia di elettroni in eccesso viene fatta passare dalla fine di una delle file di molecole d’acqua a un’altra, così come l’atomo di ossigeno nella molecola di H3O+ si stacca dall’atomo di idrogeno: ciò viene segnalato da un tocco della mano destra; invece, l’atomo di ossigeno delle molecole vicine tocca questo atomo di idrogeno con la sua mano sinistra, e così via via fino in fondo alla linea.
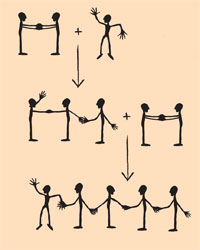
Il seguente metodo è utile per capire il meccanismo della polimerizzazione radicalica e la differenze esistenti tra la sintesi di polimeri lineari e reticolati. La polimerizzazione dell’etilene può essere rappresentata unendo gli studenti uno a uno. Il corpo di ogni studente rappresenta un atomo di carbonio, ciascun piede un atomo di idrogeno e ogni braccio un elettrone di legame. Lo studente che rappresenta il radicale metilico inizia ad agitare il braccio (elettroni non accoppiati). Due studenti, che si tengono per entrambe le mani (doppio legame), rappresentano una molecola di etilene. Il radicale metilico si lega alla molecola di etilene: uno dei due componenti della molecola di etilene stacca una mano (rottura di uno dei due legami) per legare l’elettrone libero del radicale metilico attraverso una nuova stretta di mano. La molecola risultante, composta da tre atomi di carbonio, è ancora un radicale. Questo lega un’altra molecola di etilene e così via (vedi il grafico sulla sinistra).
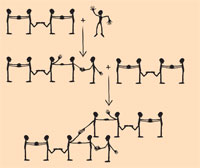
Il modello precedente può essere utilizzato anche per descrivere la reticolazione dell’1-3-butadiene, nella quale gli studenti che simboleggiano gli atomi di carbonio in posizione 2 e 3 si toccano i piedi per rappresentare il legame singolo che li unisce (vedi la figura a sinistra). L’arrivo del radicale metilico causa la rottura di uno dei due legami doppi (una doppia stretta di mano) della molecola di 1,3-butadiene e la formazione di un nuovo legame singolo (corrispondente ad una stretta di mano) tra lo stesso metile e, ad esempio, il carbonio C4 della molecola. La molecola appena formatasi è ancora un radicale, con un elettrone libero sull’atomo di carbonio in posizione 3. Il C1 di una seconda molecola di 1,3 – butadiene può spezzare uno dei suoi due doppi legami (rappresentati dalla doppia stretta di mano tra i due studenti) e legarsi al carbonio 3 della molecola iniziale (nuova stretta di mano). Si creano così le condizioni per dare origine ad una reticolazione. La molecola a 9 atomi di carbonio che ne deriva è ancora un radicale, con un elettrone sul carbonio 2 della seconda unità di 1,3 – butadiene in grado di formare un nuovo legame.
La distanza e la velocità delle molecole dell’acqua differisce tra stato solido, liquido e gassoso. In questo esercizio, gli studenti si comportano come le molecole dell’acqua. Secondo la mia esperienza, è opportuno condurre l’esercizio all’aperto, dove lo spazio è maggiore, e ciò aiuta a separare i ragazzi in maschi e femmine – un gruppo recita, l’altro guarda. L’insegnante dice agli studenti come muoversi: si comincia con l’inverno (0 °C), in cui i ragazzi dovrebbero star fermi e in una formazione a reticolo. Al passare dell’anno, giungeranno la primavera e poi l’estate, in cui le molecole si muoveranno più velocemente (fino a 40 °C), ma resteranno sempre in contatto l’una con l’altra. Infine, le molecole finiranno in un bollitore, dove, riscaldate, evaporeranno (100 °C).
In ciascuna fase, l’insegnante prenderà una istantanea di ciascuna situazione gridando “Stop!”. Gli attori (ad esempio le ragazze) e gli spettatori (ad esempio i ragazzi) descriveranno cosa è successo prima e ciò che possono vedere attorno a loro in quel momento.
I gruppi di attori e spettatori, poi, scambieranno i loro ruoli, e le molecole verranno raffreddate fino a raggiungere nuovamente gli 0 °C.
Questa attività può, in alternativa, esser modificata per mostrare l’espansione termica del benzene: otto studenti circonderanno con una corda non stretta una ventina di ragazzi “benzene”, fino a che la pressione dovuta al “riscaldamento” diverrà troppo forte e gli studenti attorno saranno costretti ad uscire dal cerchio descritto dalla corda.
Il dipinto An Experiment on a Bird in the Air Pumpw1 di Joseph Wright di Derby (1768) può essere utilizzato per insegnare la storia del vuoto.
Dividete la classe in gruppi di tre, e date ad ogni gruppo una copia del dipinto ed un foglio che mostri il contorno dei principali meccanismi e soggetti (vedi l’immagine sulla destra; si può scaricare onlinew2). Le tre domande seguenti hanno come fine il promuovere una discussione sul dipinto:



Dopo la discussione, l’intera scena può essere recitata dagli studenti usando una pompa a vuoto e una ‘Schokokuss’ (una piccola torta alla crema coperta di cioccolato) al posto dell’uccello.
Questa attività aiuta ad introdurre l’idea degli elettroni come cariche mobili che trasportano energia. Uno studente rappresenta la fonte di energia (una batteria): lui, o lei, sta fermo in fondo alla classe e porge piccoli sacchetti di gelatine alla frutta (energia). Dall’altra parte della classe, un altro studente rappresenta il “consumo” di energia: lui, o lei, raccoglie i sacchetti. Potreste posizionare al centro della stanza alcuni tavoli, per delineare un circuito.
I rimanenti studenti saranno gli elettroni: essi si accodano alla fonte di energia e, uno alla volta, ricevono un sacchetto di gelatine alla frutta; dopodiché, entrano nel “circuito elettrico” e camminano/corrono fino al “consumatore” per consegnargli le gelatine (energia). Ritornano, poi, alla fonte di energia, per accodarsi nuovamente. L’ “elettricità” continuerà a scorrere finché lo studente-fonte di energia non finirà i sacchetti (la batteria è scarica). Questa attività può essere ampliata anche per rappresentare circuiti in parallelo e in serie.
Questa attività è un utile modo per dimostrare che la conduttività dei metalli diminuisce all’aumentare della temperatura, una cosa che può, altrimenti, esser determinata solo con un esperimento. All’aperto, usate un gessetto per disegnare un rettangolo di 2 x 5 m, che rappresenterà la sezione di un cavo elettrico. Chiedete a 20 studenti circa di mettersi all’interno del rettangolo; essi rappresenteranno gli atomi di metallo. Gli altri 10 studenti (elettroni) cercheranno di correre attraverso il cavo, mentre tutti gli atomi staranno fermi (a bassa temperatura) o oscilleranno muovendo il loro corpo (ad alta temperatura). Il tempo impiegato dagli “elettroni” per passare attraverso il “cavo” verrà misurato con un cronometro.

Per introdurre il tema, chiedete ad uno studente (studente 1) di leggere ad alta voce la storia della scoperta della legge di caduta liberaw3. Mentre uno degli assistenti di Galileo (studente 2) segna il tempo colpendo regolarmente una corda di chitarra, Galileo stesso (studente 3) e un suo secondo assistente (studente 4) realizzeranno i loro esperimenti con una pallina da ping-pong (o qualcosa di simile – una pallina più dura darà migliori risultati) e un piano inclinato con corde incrociate (di metallo) a differenti altezze (vedi l’immagine sulla sinistra).
La pallina verrà fatta rotolare giù sul piano inclinato da differenti altezze. Lo studente 4 registrerà:
Con una sola lezione, questo metodo fornisce materiale eccellente per illustrare l’idea del periodo di dimezzamento, senza nessuna attrezzatura per esperimenti complicata o pericolosa.
Una plancia da gioco di 6 x 6 caselle viene riempita con 36 pezzi rossi. Due dadi, facilmente distinguibili, vengono lanciati sopra la plancia e i loro numeri usati come incognite X (dado 1) e Y (dado 2). I pezzi da gioco rossi sulla plancia che corrispondono alle coordinate (X, Y), sono disintegrati (e pertanto vengono rimpiazzati) da pezzi blu. Se vengono lanciati nuovamente i dadi , ai pezzi non succederà nulla, ma un lancio in cui usciranno numeri uguali verrà contato. Dopo ciascun gruppo di 10 lanci in cui si otterranno numeri uguali, il numero totale di lanci dei due dadi (t) e il numero di pezzi rossi rimanenti (N) verranno registrati. Un grafico, in cui le N saranno rappresentate in funzione delle t, verrà usato per determinare il periodo di dimezzamento.
Per illustrare diversi periodi di dimezzamento, si potrebbero utilizzare dadi a otto facce e una plancia da gioco di 8 x 8 caselle, oppure cambiare le regole affinché ciascuna casella debba essere colpita due volte prima che il pezzo rosso sia disintegrato.
Alcune delle attività in questo articolo sono state ispirate dal lavoro di altri. L’autore, perciò, vuol riconoscere quanto dovuto a Pöpping (2003; Radical polymerisation of ethene to polyethylene), Schreiber (2004; Physical states of water), Fallscheer (2006; Electric circuit), Bührke (2003), Drake (1975), Hepp (2004) e Riess et al. (2005; Galileo’s law of free fall), e Barke & Harsch (2001; Nuclear disintegration and half-life).
Questo articolo dà idee chiare e specifiche su come gli insegnanti possano usare la teatralità per facilitare l’apprendimento degli studenti di concetti astratti riguardanti la chimica e la fisica. Tali attività si potrebbero usare soprattutto quando ci si confronta con argomenti standard del curricolo.
Il fatto che le attività accennate prima non necessitino di complicate o costose risorse le rende facilmente usabili in ogni classe. Agli insegnanti vengono date precise e chiare istruzioni su come inserire la scrittura creativa e i giochi di ruolo nelle loro lezioni. Questo non solo rende le lezioni di scienze più interessanti e divertenti per gli studenti, ma significa che essi saranno maggiormente coinvolti nella loro stessa esperienza di apprendimento. Inoltre questo approccio attirerà studenti più orientati sulle lingue e le arti, poiché stimolerà la loro immaginazione e la loro creatività. In aggiunta, potrebbe aiutare gli insegnanti ad iniziare ad applicare piccoli cambiamenti al loro metodo di insegnamento, poiché fornisce nuove idee per docenti che hanno già incominciato a mettere in atto simili attività nella loro classe.
Catherine Cutajar, Malta
Download this article as a PDF