Colore, clorofilla e cromatografia Teach article
Usate la cromatografia su strato sottile (Thin-layer chromatography, o TLC) per scoprire la varietà di pigmenti che hanno un ruolo nella fotosintesi e conferiscono alle foglie i loro colori.

Percorrendo con lo sguardo delle lussureggianti vallate o foreste, è affascinante osservare l’ampia gamma di sfumature di colore differenti. Le foglie vanno dal chiaro allo scuro, e persino screziato. I colori sono determinati dalla presenza di diversi pigmenti, molti dei quali sono responsabili di una delle più interessanti ed importanti reazioni metaboliche degli organismi viventi: la fotosintesi.
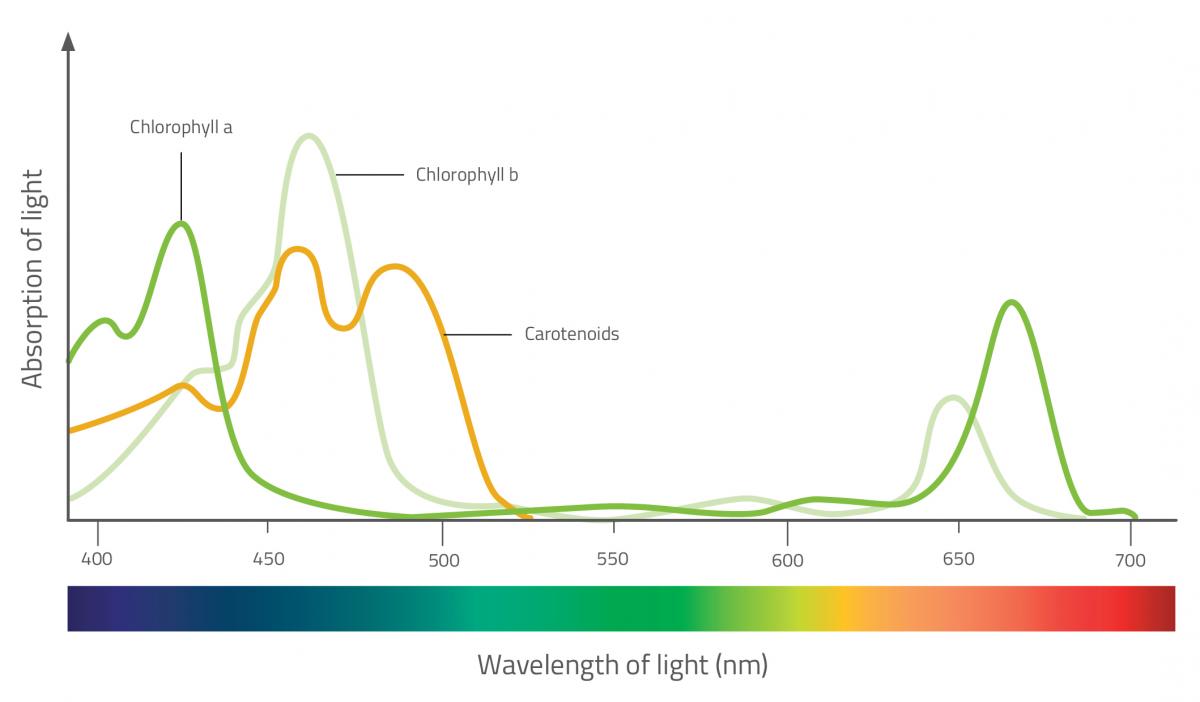
I pigmenti fotosintetici si trovano nei cloroplasti delle foglie. Essi catturano l’energia dello spettro della luce visibile, e la usano per sintetizzare carboidrati a partire da sostanze inorganiche. Ci sono molti tipi di pigmenti fotosintetici, ma i due gruppi principali sono la clorofilla e i carotenoidi (che sono ulteriormente suddivisi in due classi: caroteni e xantofille). Ciascun tipo assorbe una diversa lunghezza d’onda, in modo che tutti insieme riescono a catturare più luce.
Le clorofille sono i pigmenti maggiormente responsabili della fotosintesi. Essi assorbono la luce rossa e blu, e riflettono quella verde, e questo fatto conferisce alle foglie il loro colore verde. I carotenoidi, d’altra parte, riflettono il giallo, l’arancione e il rosso – i colori delle foglie in autunno. Durante questa stagione, infatti, la quantità clorofilla diminuisce sensibilmente, così i pigmenti carotenoidi diventano visibili.
I carotenoidi contribuiscono alla fotosintesi assorbendo le lunghezze d’onda che la clorofilla non può assorbire. Essi trasferiscono energia alle molecole di clorofilla e aiutano anche a proteggere le foglie dalla luce eccessiva – essi assorbono il surplus di energia luminosa e lo dissipano sotto forma di calore in modo da evitare il danneggiamento delle foglie.
Altri pigmenti non fotosintetici, come le antocianine o altri flavonoidi, determinano i colori dei fiori, e in questo modo i loro spettri di assorbimento variano. La funzione di questi pigmenti è quella di attrarre gli insetti e gli uccelli necessari perché avvenga l’impollinazione.
Nicola Graf
Absorption of light: Assorbimento della luce;
Wavelength of light (nm): Lunghezza d’onda della luce (nm);
Chlorophyll a: Clorofilla a;
Chlorophyll b: Clorofilla b;
Clorofilla b: Carotenoidi
Separazione dei pigmenti delle foglie mediante cromatografia su strato sottile
Questo articolo illustra un semplice esperimento di laboratorio utile per conoscere i pigmenti delle foglie. Gli studenti impiegano la cromatografia su strato sottile per separare i diversi pigmenti che sono presenti in due diversi estratti di foglie. Poi identificano ogni pigmento e verificano se i due estratti hanno dei pigmenti in comune. L’esperimento è adatto per studenti di 11-16 anni, e richiede 1-2 ore per essere completato.
Notate che abbiamo usato foglie di Epipremnum aureum (comunemente noto come edera del diavolo) e di Ficus benjamina (detto anche fico piangente), ma qualunque specie potrebbe essere usata per preparare gli estratti di foglie. Potreste anche trovare interessante eseguire l’esperimento usando fiori dai colori brillanti, come quelli del genere Petunia, o anche foglie gialle o arancioni.

Joydeep/Wikimedia Commons, CC BY-SA 3.0

JM Garg/Wikimedia Commons, CC BY 3.0
Per la TLC, utilizziamo come fase mobile una miscela di esano, acetone e triclorometano (3:1:1) in quanto è quella che fornisce la migliore separazione. Tuttavia, questo richiede che parte dell’attività sia condotta dall’insegnante lavorando sotto cappa. Questa fase mobile è quella che separa i pigmenti più nettamente, ma si potrebbe modificare l’attività utilizzando fasi mobili costituite dai soli esano o etanolo, permettendo così agli studenti di eseguirla loro stessi. Sia l’esano che l’etanolo separano efficacemente i pigmenti, ma non permettono di distinguerli così bene come quando si usa la miscela di solventi.
Materiali
- Campioni di foglie (es. E. aureum e F. benjamina), tagliati in pezzi che misurano approssimativamente 2 cm x 2 cm
- Lastrine per TLC (10 cm x 5 cm) in gel di silice
- Miscela eluente organica formata da:
- 3 parti di esano, C6H14
- 1 parte di acetone, (CH3)2CO
- 1 parte di triclorometano, CHCl3
- Un beaker e un vetro d’orologio (o una camera cromatografica)
- Piastra di porcellana con incavi
- Mortaio e pestello
- Pipette Pasteur da 1 ml (una per ogni campione di foglie)
- Matita
Nota di sicurezza
Bisogna indossare camice, guanti e occhiali protettivi. I solventi impiegati in questo esperimento sono infiammabili, quindi non vanno usati vicino a delle fiamme . La miscela di solventi (esano, acetone e triclorometano) deve essere usata unicamente sotto cappa, a causa della volatilità, dell’odore e della pericolosità per la salute.
Procedimento
I seguenti passaggi dovrebbero essere eseguiti dagli studenti:
- Mettete il primo campione di foglie nel mortaio. Aggiungete con la pipetta 1 ml di acetone nel mortaio e usate il pestello per macinare il campione finché la foglia non è finemente suddivisa.
- Con la pipetta, trasferite la miscela in un incavo della piastra di porcellana.
- Lavate mortaio e pestello, e ripetete i passaggi 1-2 con il secondo campione di foglie. Usate una nuova pipetta per aggiungere 1 ml di acetone e utilizzate ancora la stessa pipetta per trasferire la miscela in una nuova cavità della piastra di porcellana.
- Sulla lastrina per TLC, utilizzando una matita, disegnate una linea orizzontale a 1.5 cm dal bordo inferiore. Fate attenzione a non toccare la superficie della lastra con le dita.
- Con la prima pipetta (attenzione a non mischiare le pipette che sono state usate per i diversi campioni), effettuate la deposizione di parte del vostro primo campione di foglie. Applicate un’unica, piccola goccia sulla linea tracciata a matita sulla sinistra della lastrina cromatografica. Assicuratevi di lasciare abbastanza spazio per depositare il secondo campione sulla parte destra.
- Aspettate alcuni secondi finché non asciuga, quindi depositate una seconda goccia nello stesso punto. Continuate così fino alla deposizione di circa 10 gocce.
- Utilizzando la seconda pipetta, ripetete i passaggi 5 e 6 per il secondo campione di foglie depositandolo sul lato destro della lastrina.
- Fate asciugare completamente la lastrina.
I seguenti passaggi devono essere eseguiti dall’insegnante:
- Lavorando sotto la cappa aspirante, miscelate i solventi nelle seguenti proporzioni: esano, acetone e triclorometano, 3:1:1.
- Mettete la miscela di solventi nel beaker. Bisognerebbe aggiungere solo una piccola quantità di solvente, in modo che la linea di deposizione tracciata a matita sulla lastrina non venga sommersa.
- Collocate la lastrina verticalmente nel beaker, con la linea di deposizione in basso, e coprite il beaker con il vetro d’orologio. Gli studenti possono osservare l’eluente che sale lungo la lastrina e i pigmenti che si separano.
- Aspettate finché l’eluente non è salito grossomodo 6 cm rispetto al punto di partenza (questo richiederà circa 15–30 minuti) prima di togliere la lastrina dal beaker, lasciandola sotto la cappa aspirante.
- Con una matita segnate velocemente la linea corrispondente al punto più lontano raggiunto dal solvente. Lasciate asciugare completamente la lastrina prima di toglierla da sotto la cappa aspirante.
I seguenti passaggi dovrebbero essere eseguiti dagli studenti:
- Fotografate il cromatogramma non appena è asciutto. I colori sbiadiranno nel giro di poche ore. Stampate una copia della fotografia per inserirla nei vostri appunti.
- Usando la foto del cromatogramma, cercate di determinare quanti pigmenti sono presenti in ciascuno degli estratti di foglie.
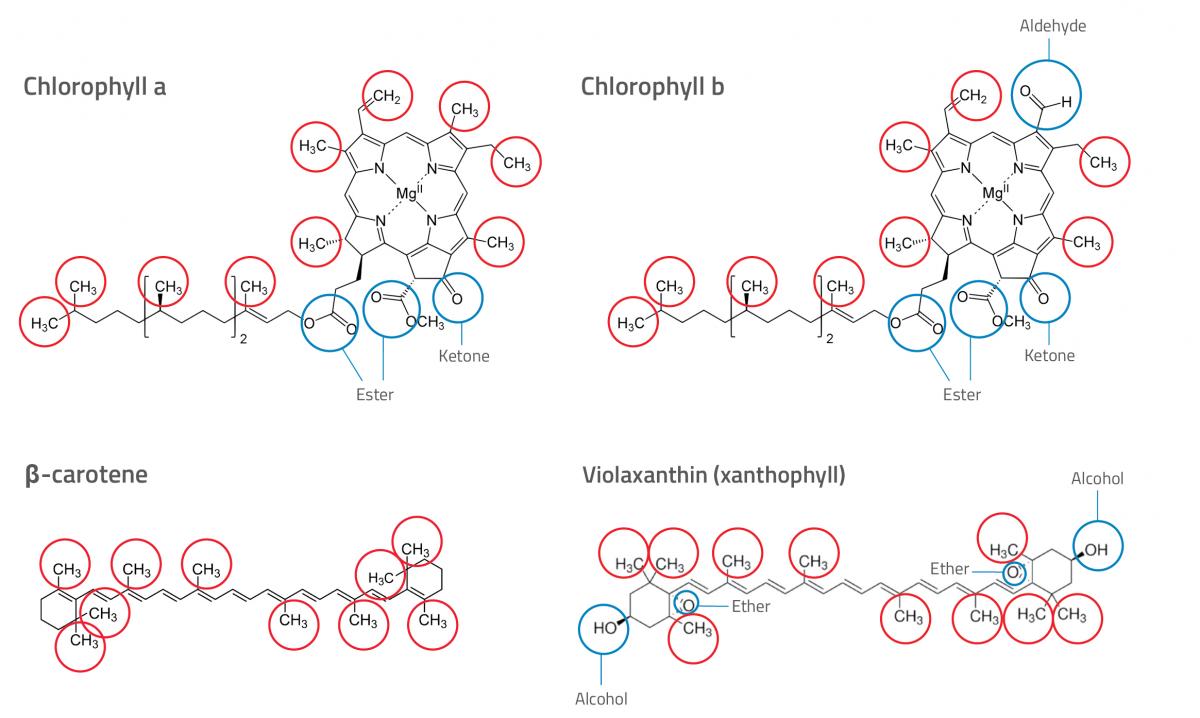
- Ora osservate le strutture chimiche dei diversi pigmenti (vedere la figura 1). È possibile identificare i diversi pigmenti sul cromatogramma (consultare la sezione ‘Spiegazione’ per ulteriori indicazioni)? Scrivete le risposte.
- Misurate le distanze percorse dal solvente e dai pigmenti, quindi calcolate il fattore di ritardo, o di ritenzione (Rf) usando la seguente equazione:
Rf = (distanza percorsa dal pigmento) / (distanza percorsa dall’eluente)
Registrate i vostri risultati in una tabella. Confrontateli con i valori della tabella 1: le vostre risposte erano corrette?
Nicola Graf
Chlorophyll a: Clorofilla a;
Chlorophyll b: Clorofilla b;
β-carotene: β-carotene;
Violaxanthin (xanthophyll): Violaxantina (xantofilla);
Ester: Estere;
Ketone: Chetone;
Ether: Etere;
Alcohol: Alcol;
Aldehyde: Aldehyde
Spiegazione
I diversi pigmenti presenti nell’estratto di foglie vengono separati in base alle loro affinità per la fase stazionaria (il gel di silice sulla lastrina – una sostanza polare) e la fase mobile (l’eluente – una sostanza apolare). I composti con elevata affinità per l’eluente (i composti apolari) correranno molto di più di quelli dotati di elevata affinità per il gel di silice (i composti polari).
Nel nostro esempio (vedere la figura 2), entrambi gli estratti di foglie contenevano quattro pigmenti. Il pigmento 4 si è mosso molto meno del pigmento 1, evidenziando così il fatto che il pigmento 4 è più polare ed il pigmento 1 è meno polare. Osservando le strutture chimiche dei diversi pigmenti, e i gruppi polari e apolari, gli studenti possono provare a identificare i diversi pigmenti presenti in ciascuno degli estratti di foglie.
Dovranno sapere che, dei vari gruppi funzionali presenti nei pigmenti della figura 1, i gruppi alcolici sono i più polari, i gruppi funzionali di esteri ed eteri sono i meno polari, e quelli di aldeidi e chetoni sono una via di mezzo. Da tutto ciò possiamo dedurre che i caroteni sono i pigmenti meno polari (non contengono gruppi polari), e le xantofille sono le più polari (presentano due gruppi alcolici, uno ad ogni estremità della molecola). Perciò, i pigmenti 1 e 2 sono presumibilmente caroteni, ed il pigmento 4 una xantofilla. Il pigmento 3 potrebbe essere la clorofilla, poiché essa è più polare dei caroteni ma meno polare delle xantofille. Potete osservare il caratteristico colore verde della clorofilla sul cromatogramma.

Josep Tarragó-Celada
Pigment: Pigmento
Ora osservate i valori di Rf, che vanno da 0 a 1, essendo 0 quello di un pigmento che non si muove affatto, mentre il valore 1 indica un pigmento che si muove con l’eluente. Il valore di Rf varia in funzione dell’eluente impiegato, ma l’ordine generale dei pigmenti (dal valore di Rf più alto a quello più basso) solitamente rimane lo stesso, in quanto i composti apolari corrono di più di quelli polari. I valori di Rf per diversi pigmenti (impiegando come eluente la miscela esano, acetone e triclorometano (3:1:1)) sono mostrati nella tabella 1.
| Pigmento | Valore di Rf |
|---|---|
| β-carotene | 0.98 |
| Clorofilla a | 0.59 |
| Clorofilla b | 0.42 |
| Antocianine | 0.32-0.62 |
| Xantofille | 0.15-0.35 |
Discussione
Ad esperimento concluso, potete porre ai vostri studenti alcune delle seguenti domande per verificare quanto abbiano compreso a proposito di pigmenti vegetali e cromatografia su strato sottile.
- Osservate gli spettri di assorbimento di vari pigmenti vegetali. Quali pigmenti assorbono più luce dall’estremità rossa dello spettro? Di che colore sono?
- Se la clorofilla è il più importante pigmento fotosintetico, quali colori dello spettro visibile sono più utili per la fotosintesi delle piante?
- Spesso le alghe sono di colore giallo-bruno. Pensate che la luce delle estremità rossa o blu dello spettro penetri meglio nell’acqua?
- Quali specie di piante hanno foglie che non sono verdi? Come potreste scoprire quali pigmenti contengono?
- Dove sono collocati i pigmenti fotosintetici all’interno di una foglia?
- Perché per le piante è utile contenere più pigmenti fotosintetici diversi?
- Perché è importante usare un solvente apolare (come esano, acetone e triclorometano) e non un solvente polare (come l’acqua) per studiare i pigmenti vegetali usando la cromatografia su strato sottile?
- Perché dovreste cercare di evitare di toccare la superficie della lastrina per TLC?
- Perché la lastrina dovrebbe essere completamente asciutta prima di metterla nel beaker?
- Perché alcuni pigmenti hanno un valore di Rf maggiore degli altri?
References
- Reiss C (1994) Experiments in Plant Physiology. Englewood Cliffs, NJ, USA: Prentice Hall. ISBN: 0137012853
Resources
- Per un’infografica che illustri le sostanze chimiche che stanno alla base dei colori delle foglie, visitare il sito Compound Interest.
- Si può leggere di più sulla struttura chimica dei diversi pigmenti vegetali visitando il sito Harvard Forest della Harvard University.
Review
La combinazione dell’elemento ambientale della natura con l’identificazione delle strutture chimiche dà luogo ad una perfetta lezione di scienze applicate. L’analisi dei diversi pigmenti delle foglie ha un risultato chiaramente visibile che può essere correlato alle strutture chimiche dei pigmenti fotosintetici.
Questa attività pratica fornisce agli studenti l’opportunità di andare oltre la semplice cromatografia su carta, arrivando alla più complessa tecnica della cromatografia su strato sottile. Questo lavoro interdisciplinare saprà coinvolgere gli studenti che amano gli argomenti correlati alla biologia come la fotosintesi, come pure quelli che apprezzano l’aspetto del problem-solving delle tecniche analitiche in chimica.
L’attività è particolarmente adatta per studenti di 14-16 anni, sia che facciano parte di club scientifico, sia come attività di approfondimento. In aggiunta alla metodica principale, gli autori forniscono suggerimenti sull’uso di diversi solventi, in modo da consentire agli studenti di condurre l’esperimento completamente da soli. Con ulteriori dettagli, l’attività potrebbe essere utile anche per studenti di 16-19 anni.
Vengono introdotti molti nuovi termini, perciò l’articolo fornisce un’eccellente opportunità di stimolare gli studenti alla comprensione di concetti quali le fasi mobile e stazionaria, la polarità delle molecole e come la biologia abbia fondamentalmente delle basi chimiche.
Caroline Evans, capo dipartimento di chimica, Wellington College, UK





