Fumées violettes : l’importance de l’iode Understand article
Traduit par Maurice Cosandey. L’iode, avec ses vapeurs violettes caractéristiques, présente des milliers d’applications, depuis le désinfectant des familles jusqu’aux cellules solaires.

Image reproduite avec
l’aimable autorisation de
Eleanor A Merritt
Qu’est-ce qui rend l’iode si important et si intéressant ? C’est vrai qu’il sublime en formant un gaz violet, mais il a de nombreuses applications dans la vie de tous les jours. Saviez-vous par exemple qu’il protège les algues de l’effet oxydant des rayons solaires, qu’il prévient les anomalies congénitales chez les humains, et qu’il a de nombreuses applications industrielles ?
La découverte de l’iode date du 19ème siècle et des guerres napoléoniennes. Avec le blocus continental imposé par les Anglais, la France manquait de salpêtre (KNO3) pour fabriquer sa poudre noire. A la recherche d’un substitut riche en potassium, le chimiste Bernard Courtois décida d’étudier le potentiel des algues brunesLaminaria. Il ajouta de l’acide sulfurique aux cendres de ces algues, et observa avec surprise la formation de magnifiques fumées violettes.

Gay-Lussac, physicien et
chimiste français, par
François Séraphin Delpech
(1778–1825)
Image du domaine publique /
Wikimedia Commons
Bien que Courtois ait tout de suite pensé avoir découvert un nouvel élément, il n’avait pas les moyens financiers de le prouver. Il confia cette tâche à ses collègues, et Joseph Gay-Lussac confirma l’existence de ce nouvel élément, qu’il baptisa iode, du grec iodes, ce qui signifie pourpre ou violet.
Gay-Lussac poursuivit l’étude de la chimie de l’iode. Malgré la guerre, il réussit à en débattre par courrier avec le chimiste anglais Sir Humphry Davy, qui avait d’abord cru que cette vapeur était un composé de chlore. Mais il a assez vite conclu que l’iode était bel et bien un nouvel élément.

plus forts accumulateurs
d’iode du monde vivant.
Photo prise sur la côte de
Dunstaffnage, près d’Oban,
en Ecosse
Image reproduite avec
l’aimable autorisation de FCK
Aujourd’hui, la spectroscopie d’absorption des rayons X a montré que les algues (Figure 2) accumulent l’iode sous forme d’ion iodure I–. Cet ion agit en antioxydant et protège les algues de l’oxydation par l’ozone atmosphérique (O3). Ceci explique sans doute pourquoi on trouve des traces infimes d’iode moléculaire (I2) dans l’atmosphère des regions côtiéres, et pourquoi l’absorption d’iode par l’homme dépend plus de l’abondance des algues que de la proximité de la mer.
Pendant tout le 19ème siècle, l’iode a été extrait des algues. Aujourd’hui, on l’extrait de certaines saumures naturelles riches en iode proches de mines de pétrole du Japon et des USA. On l’extrait aussi du caliche, ou salpêtre du Chili, qui contient de l’iodate de calcium (Ca(IO3)2). L’iode vendu dans le commerce est un solide violet foncé presque noir.
Chimie de l’iode
L’iode est un membre de la famille des halogènes, et présente les caractéristiques des éléments de ce groupe. Son électronégativité élevée lui permet de former des iodures avec la plupart des éléments, en adoptant le degré d’oxydation -1. Les composés organiques iodés sont des réactifs très utilisés en synthèse organique, car ils permettent d’ioder, d’oxyder et de former des liaisons C-C.
L’iode présent dans l’atmosphère a une origine essentiellement marine, d’où il est capté par les algues avant de passer dans l’air. Mais cet iode atmosphérique est entraîné par les pluies et retourne à la mer. Dans les océans, l’iode se dissout et peut se trouver sous la forme oxydée de l’ion iodate IO3–, ou sous la forme réduite de l’ion iodure I–. Dans la croûte terrestre ou lithosphere, l’iode se trouve dans certains sédiments marins ou terrestres. Mais il est quasiment absent des roches ignées.
L’importance physiologique de l’iode
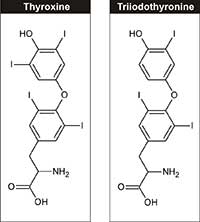
thyroxine (T4) et
triiodotyrosine (T3)
Image reproduite avec
l’aimable autorisation de
Michael Zimmermann
L’iode est un élément essentiel, nécessaire à la synthèse des hormones de la thyroïde comme la triiodotyrosine et la thyroxine (Figure 3), qui régularisent la croissance, le développement et le métabolisme cellulaire. Pour les adultes, l’apport d’iode alimentaire recommandé est de 150 µg/jour, et il peut provenir des produits laitiers, des algues ou du sel iodé.
Le premier symptôme d’un manque d’iode est l’hypertrophie de la tyroïde (goitre). Comme l’iode manque, la glande pituitaire antérieure secrète de plus en plus d’hormone stimulant la tyroïde, dans une tentative désespérée de capter davantage d’iode. Ceci conduit à une hypercroissance de la glande thyroïde.
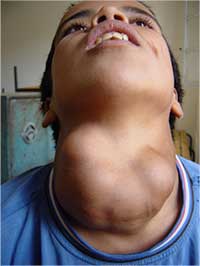
d’un goitre causé par le
manque d’iode
Image reproduite avec
l’aimable autorisation de
Michael Zimmermann
Mais l’effet le plus dramatique du manque d’iode est le sous-développement du cerveau des nouveaux-nés, ce qui conduit à une déficience mentale. De plus, le manque d’iode pendant la grossesse augmente le risque de fausse couche, de mortalité à la naissance, et d’autres anormalités.
La manière la plus efficace pour prévenir la déficience en iode est d’ajouter du iodure de potassium (KI) ou du iodate de potassium (KIO3) au sel de table. Cette méthode d’iodation du selest pratiquée dans 120 pays : plus de 70% de la population du globe consomme du sel iodé.
Usages industriels de l’iode
L’iode et ses composés sont utilisés dans des myriades de produits, tant agricoles que pharmaceutiques, voire comme catalyseurs industriels (Figure 4). Par exemple, l’iode est un agent antimicrobien potentiel. La solution faite d’iode, d’alcool, d’iodure de potassium et d’eau, connue sous le nom de teinture d’iode, a servi pendant plus d’un siècle comme antiseptique pour les blessures. Aujourd’hui on lui prèfère des agents moins irritants pour la peau comme les ionophores (complexe de surfactant et d’iode), comme l’iodopovidone, qui est un mélange de polyvinylpyrroldone et d’iode utilisé pour le nettoyage chirurgical.
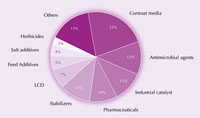
de l’iode. Cliquer sur l’image
pour l’agrandir.
Image reproduite avec
l’aimable autorisation de
Tatsuo Kaiho
En chimie, on synthétise l’acide acétique industriel par carbonylation du méthanol à l’aide d’iodure de rhodium (Procédé Monsanto) ou d’iridium (procédé BP Cativa) comme catalyseur.
L’iodure d’argent (AgI) a servi à faire les premières plaques photographiques. Aujourd’hui on l’utilise pour initier la pluie, car les cristaux de AgI ont la même structure que la glace, et initient la condensation de la pluie dans l’atmosphère. Ce procédé a été utilisé lors des Jeux olympiques de Beijing 2008 pour prévenir la pluie pendant les cérémonies d’ouverture et de clôture.

équipé de deux générateurs
latéraux pour ensemencer les
nuages avec de l’iodure
d’argent.
Image reproduite avec
l’aimable autorisation de
Christian Jansky / Wikimedia
Avec sa masse atomique (126.9) et son nombre élevé d’électrons, l’iode est un excellent agent de contraste pour les radiographies aux rayons X. Les composés d’iode sont en général inoffensifs pour les êtres humains, et ils permettent aux tissus mous d’être visibles aux rayons X.
Une application plus récente de l’iode réside dans les films polarisants filtrant la lumière dans les écrans plats à cristaux liquides pour appareils TV et autres consoles. Ces écrans sont faits de films d’alcool polyvinylique dopés à l’iode. Ici, l’iode agit en agent réticulant, ce qui crée une structure polarisante.
L’iode et l’industrie de l’énergie

France, est proche d’une
région fortement peuplée.
Tous les cinq ans, on
distribue aux populations
avoisinantes des pastilles
d’iodure de potassium, afin
de prévenir toute atteinte à
leur gande thyroïde en cas
d’accident nucléaire.
Image reproduite avec
l’aimable autorisation de the
AIEA /Wikimedia
L’iode est utilisé dans les cellules solaires les plus prometteuses du marché, à savoir les cellules “vertes” économiques, ou à colorant et à oxyde de titane. Ces cellules, appelées aussi “cellules Grätzel” d’après le nom de leur inventeur, contiennent une solution de polyiodure servant de porteur de charge entre cathode et anode. Voir aussi Shallcross et al., 2009).
Parmi les 37 isotopes connus de l’iode, tous sont radioactifs, sauf un, l’iode 127I. La plupart de ces radioisotopes sont produits lors des explosions atomiques ou dans les réacteurs nucléaires. Ils ont une durée de vie très courte, ce qui les rend utiles comme traceurs ou en thérapie. On les utilise pour visualiser la glande thyroïde, qui absorbe l’iode injecté dans le flux sanguin.
Malheureusement, l’iode radioactif 131I est relâché lors des désastres comme celui de Fukushima 2011 et peut être accumulé par la thyroïde. Comme c’est un émetteur de particules β énergiques, il endommage les cellules et peut causer le cancer. Pour empêcher cet effet, on ingère des tablettes de iodure de potassium non radioactif afin de saturer la glande thyroïde, et prévenir ainsi l’absorption d’îode radioactif.
Nous venons de décrire un petit échantillon des nombreuses applications de l’iode. Cet élément a beau n’avoir été découvert qu’il y a 200 ans, son utilité est bien établie en chimie, en physique et en médecine.
L’iode en classe
Nous commaissons tous la célèbre “horloge à iode” colorée, qui contient un mélange d’iodure de potassium, d’amidon, d’eau oxygénée et de thiosulfate de sodium. Mais il y a beaucoup d’autres moyens d’introduire l’iode expérimentalement en classe. Par exemple :
- En présence d’eau comme catalyseur, l’aluminium et l’iode réagissent et dégagent d’intenses. vapeurs violettes d’iode.
- La poudre de zinc réagit directement avec une solution d’iode dans l’éthanol. La reaction redox est exothermique, et produit de l’iodure de zinc.
- L’iode en solution permet de détecter la présence d’amidon dans la nourriture.
- Les solutions des divers iodures peuvent être électrolysées en classe, et leurs produits identifiés. Les élèves peuvent utiliser leurs connaissances théoriques et leur habileté pratique pour établir les équations ioniques.
Les details relatifs à ces expériences peuvent être déchargés sur les sites de Learn Chemistry websitew1.
Remerciement
Cet article est une adaptation d’une publication plus longue parue dansAngewandte Chemie International Edition (Küpper et al., 2011).
References
- Küpper FC, Feiters MC, Olofsson B, Kaiho T, Yanagida S, Zimmermann MB, Carpenter LJ, Luther GW, Lu Z, Jonsson M, Kloo L (2011) Commemorating two centuries of iodine research: an interdisciplinary overview of current research. Angewandte Chemie International Edition 50: 11598-11620. doi:10.1002/anie.201100028
- Shallcross D, Harrison T, Henshaw S, Sellou L (2009) Regarder vers le ciel: expériences sur le changement climatique. Science in School 12.
Web References
-
w1 – La page Learn Chemistry de la Royal Society of Chemistry offre une longue liste de ressources qui peuvent être déchargées pour servir de support à l’enseignement et l’apprentissage de la chimie.
Review
Dans cette courte mise-à-jour centrée sur l’élément iode, les auteurs ont présenté l’histoire et les applications de cet élément, de la médecine à l’industrie et à la production d’énergie. Les suggestions faites en vue d‘expériences de laboratoire en classe ajoutent de l’intérêt à ce dossier.
Je recommande la lecture de cet article aussi bien aux maîtres de science européens, qu’à leurs élèves âgés de 13 à 18 ans. Son style est clair et précis. Il pourrait être utilisé dans les leçons de chimie (table périodique, halogènes), de biologie (thyroïde et ses maladies) et de physique (radioactivité et cellules solaires). Il permet aussi une approche interdisciplinaire de l’histoire des sciences (découverte des éléments), ou vers le rôle des scientifiques dans le développement des armements, comme celui des contacts entre scientifiques appartenant à des pays en guerre.
Quelques questions de compréhension générale :
- Après la lecture de cet article, vous en déduisez que les algues accumulent l’iode :
- pour oxyder l’ozone atmosphérique
- pour absorber l’ozone atmosphérique
- pour produire l’ozone atmosphérique
- pour se protéger de l’ozone atmosphérique.
- Si nous ne recevons pas assez d’iode :
- Notre glande thyroïde s’agrandit/ s’atrophie
- Notre glande pituitaire secrète plus/ moins d’hormone stimulant la thyroïde.
Giulia Realdon, Italie





