La science garde la tête froide… même au sujet de la surfusion Understand article
Traduit par Maurice A. Casimir. Lorsque nous refroidissons un corps en dessous se sa température de congélation, il se solidifie – c’est du moins ce à quoi nous nous attendons. Tobias Schülli recherche pourquoi ce n’est pas toujours le cas.

l’aimable autorisation de
ktsimage / iStockphoto
Comment est-il possible que des nuages de haute altitude, à une température inférieure à 0°C, soient constitués de minuscules gouttelettes d’eau et non de glace? En fait, sous certaines conditions, les liquides peuvent garder leur état liquide bien en dessous de leur point de congélation. Bien que ce phénomène, connu sous le nom de surfusion, ait été découvert en 1724 par Daniel Gabriel Fahrenheit (Fahrenheit, 1724), il continue à faire l’objet de multiples recherches.
Les différents états de la matière
Pour les scientifiques, la phase liquide est un état de la matière curieux entre ordre et désordre. L’état désordonné de la matière est bien illustré par le gaz parfait: la chaleur crée un mouvement des atomes individuels (ou des molécules) si important que les forces d’attraction entre eux ne jouent aucun rôle et qu’ils se déplacent librement dans l’espace. Au contraire, à l’état solide, chaque atome occupe une position déterminée, et est fortement lié à ses voisins. Grâce à l’optimisation des liaisons chimiques et des énergies de liaison, ceci conduit généralement à l’empilement le plus dense des atomes en un arrangement répétitif en trois dimensions appelé cristal. Par conséquent, ce que l’on appelle solide est en fait un solide cristallin.
A l’état liquide – intermédiaire – les atomes voisins sont en contact les uns avec les autres comme à l’état solide (les deux états étant ainsi considérés comme état condensé de la matière), mais les atomes individuels peuvent migrer, ce qui empêche la formation du schéma régulier parfait du cristal. La densité d’un liquide (comparée à celle d’un gaz) diffère donc très peu de celle du même corps à l’état solide (voir Figure 1).

Les états de la matière:
a) A l’état solide ou cristallin de la matière, chaque atome reste en en endroit déterminé. On peut le considérer comme fermement lié à se voisins. Si l’on chauffe un cristal, les atomes commencent à se déplacer (vibrations thermiques).
b) A l‘état liquide (pour des températures supérieures à celle du point de fusion), les mouvements thermiques permettent aux atomes individuels de se déplacer librement, bien que les forces d’attraction entre atomes fassent qu’ils soient presque aussi proches les uns des autres qu’à l’état solide. Un liquide a donc à peu près la même densité qu’un solide, et il résiste à la compression comme un solide.
c) A des températures élevées, le mouvement thermique des atomes individuels devient si important que les forces d’attraction entre atomes ne jouent plus leur rôle, et les atomes peuvent se déplacer librement dans l’espace. La densité du gaz dépend de la pression et de la température du système. Sous haute pression ou à basse température, les atomes peuvent commencer à se rassembler de nouveau et à se condenser en arrangements plus denses pour former un liquide ou un solide. Pour cette raison ces deux états sont également appelés état condensé de la matière
Image reproduite avec l’aimable autorisation de Tobias Schülli
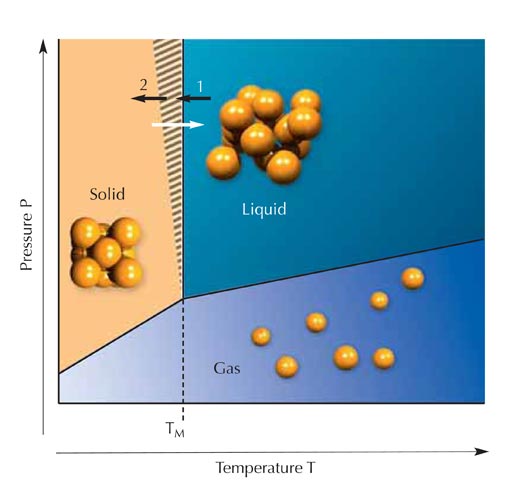
Image reproduite avec l’aimable autorisation de Tobias Schülli

entoure une zone d’état
métastable : il ne restera
dans cet état que si les
conditions sont inchangées.
Le cercle bleu entoure une
zone d’état de transition (ou
instable) se déplaçant vers la
zone d’état stable limitée par
le cercle noir. Tout état
instable va vers un état
stable, alors que l’état
métastable exige des
conditions spécifiques pour
cela
Image reproduite avec
l’aimable autorisation de
Tobias Schülli
Bien que l’on considère qu’un liquide est principalement dans un état désordonné, ses atomes peuvent se grouper localement en petits agglomérats, donnant naissance à la notion d’ordre local. La nature exacte d’un tel état est très difficile à observer expérimentalement, mais l’on pense qu’il joue un rôle crucial dans la transition d’un corps de la phase désordonnée vers la phase ordonnée.
Le fait pour un corps particulier d’être à l’état gazeux, liquide ou solide depend de sa température et de sa pression. La glace fond à 0°C sous la pression atmosphérique, le mercure à -39°C, et l’or à 1064°C. En se réchauffant, les solides (cristaux) fondent exactement à ces températures. L’opposé n’est toutefois pas vrai: lorsqu’un liquide est refroidi à sa température de fusion, la formation d’un cristal est possible, mais ne se produit pas nécessairement à cette température (Figure 2). Dans la zone hachurée de la figure, un liquide pur (sans impuretés cristallines) restera liquide. On dit que le liquide est en surfusion. Cet état de la matière est appelé métastable (Figure 3).
Comment expliquer la surfusion?
On trouve dans la physique de la cristallisation la première explication de la surfusion. La formation d’un cristal exige un noyau d’atomes régulièrement arrangés autour duquel le cristal peut croître. La cristallisation se produit habituellement lorsque le liquide est en contact avec une surface solide ou lorsqu’il contient des impuretés cristallines; tout se passe comme si le liquide imite la structure ordonnée de la surface voisine. On appelle ce phénomène germination hétérogène, partant d’un germe cristallin.
En l’absence d’un solide cristallin, la formation spontanée d’une structure vaste et régulière à partir d’un liquide désordonné est peu probable. Bien que de petits nombres d’atomes puissent former spontanément un arrangement régulier, ces agglomérats sont habituellement trop petits pour servir de germes de cristallisation et ils se dissolvent rapidement à nouveau dans le liquide. Un liquide pur a donc besoin d’être en surfusion de manière significative avant que ne se produise une germination homogène: quelques atomes s’ordonnent spontanément dans le liquide de la manière adaptée à la formation d’un cristal suffisamment grand et stable pour servir de noyau pour une croissance supplémentaire du cristal (Figure 4).

a) La formation d’un cristal commence habituellement autour d’un solide déjà cristallisé au contact du liquide (germination hétérogène).
b) En conséquence, il faut que le liquide soit en surfusion de manière significative avant que ne se produise la germination homogène: quelques atomes s’ordonnent de manière spontanée dans le liquide de la manière adaptée à la formation d’un cristal, qui sert alors de noyau pour une croissance supplémentaire du cristal
Image reproduite avec l’aimable autorisation de Tobias Schülli
La plupart des minuscules gouttelettes d’eau qui constituent les stratus et les cumulus ne contiennent pas de germes de cristallisation; ces gouttelettes peuvent retser liquides bien en dessous de 0 °C.
La surfusion accentuée dans les métaux
Les métaux qui peuvent exister à l’état liquide plusieurs centaines de degrés en dessous de leur température de fusion offrent des cas encore plus spectaculaires que celui de l’eau dont l’état de surfusion ne peut atteindre que 40 degrés en dessous de la température de fusion de 0 °C. Le phénomène est connu sous le nom de surfusion accentuée (deep supercooling) et a constitué un défi pour les scientifiques désireux d’aller au-delà de la germination du cristal pour expliquer la métastabilité des liquides (Turnbull, 1952).
Les scientifiques ont émis l’idée que la structure interne de certains liquides pourrait être incompatible avec la cristallisation. Dans les années 1950, Frederick Charkes Frank a suggéré que l’arrangement plus dense des atomes de ces liquides pourrait être différent de l’arrangement des atomes dans un cristal, et que ces agglomérats dans un liquide sont par conséquent ordonnés de façon inadaptée à un usage de noyau de cristallisation (Frank, 1952).

Image reproduite avec l’aimable autorisation de Nicola Graf
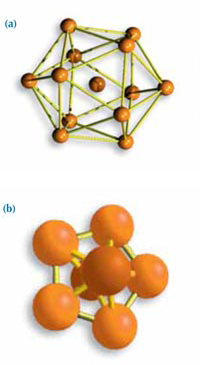
structures incompatibles
avec la formation d’un cristal:
(a) Un icosahèdre,
l’arrangement le plus dense
possible pour 13 atomes.
(b) Un agglomérat de 7
atomes en symétrie d’ordre
cinq.
Image reproduite avec
l’aimable autorisation de
Tobias Schülli
Frank a pris pour modèle l’icosahèdre: un atome central avec douze atomes autour. Une telle structure à symétrie d’ordre cinq ne peut former la base d’un cristal. Un structure cristalline doit généralement se reproduire en trois dimensions, comme les briques d’un mur. Un arrangement cubique, par exemple, est une structure excellente pour un cristal, car elle est à la fois dense et parfaitement régulière.
Si l’on prend une comparaison en deux dimensions, les triangles, rectangles ou hexagones peuvent remplir un espace plan parfaitement, mais les pentagones ne le peuvent pas (Figure 5). En trois dimensions, les structures pentagonales sont incompatibles avec la formation d’un cristal (Figure 6).
De récents modèles théoriques et simulations viennent en appui de l’idée de Frank, ce qui laisse penser qu’une fraction significative des atomes dans les liquides s’arrangent en agglomérats à symétrie d’ordre cinq, présentant ainsi un obstacle à la cristallisation. Jusqu’à présent, toutefois, très peu d’expériences ont permis de visualiser une symétrie d’ordre cinq dans des liquides (Reichert et al., 2000).
La surfusion en nanostructures de semi-conducteurs
Ma propre rencontre avec le phénomène de la surfusion n’a pas vraiment été intentionnelle. En fait, ma recherche, à l’intérieur d’une équipe du CEAw1 à Grenoble, était focalisée sur la compréhension et l’amélioration de méthodes novatrices de croissance pour des nanostructures de semi conducteurs. Dans ces méthodes, les processus de solidification et germination sont cruciaux. L’attention de notre équipe a été attirée par un rapport sur la surfusion de gouttelettes de métal – des alliages pour semi- conducteurs: ces gouttelettes nous offraient un bon sujet d’étude de l’influence d’un germe de cristallisation ( une surface de silicium) sur la solidification d’un alliage.
Nous avons déposé de minuscules gouttelettes (0.1 à 2 µm) d’un alliage or-silicium sur une surface de silicium préparée sous ultra vide, une technique standard utilisée en élaboration de semi-conducteurs. Nous avons observé que, pendant leur contact avec cette surface cristalline, les gouttelettes restaient liquides à 240°C, bien en dessous de leur température de fusion (qui est de 363°C). Pour comprendre cet extraordinaire état de surfusion, (qu’on n’observe habituellement qu’en l’absence de germes de cristallisation), nous avons réalisé une expérience à l’Installation Européenne de Rayonnement Synchrotron (ESRF)w2, également à Grenoble. La diffusion de Rayons X très intenses produits dans le synchrotron constitue l’unique façon d’obtenir des informations sur l’arrangement des atomes dans un liquide et sur des surfaces solides.
Nous avons émis des Rayons X presque parallèlement à la surface du cristal de silicium sur lequel avaient été déposées les gouttelettes d’alliage or-silicium. Sous un angle de 0.1° (selon une technique appelée diffraction en incidence rasante), les Rayons X sont réfléchis par la surface de silicium plate et pénètrent les gouttelettes qui y sont déposées. Les Rayons X diffusés fournissent des informations sur l’arrangement des atomes de la couche atomique ultime de la surface de silicium, ainsi que sur la structure des gouttelettes.
Ces expériences nous ont permis de déterminer l’état (liquide ou cristallin) des gouttelettes au cours de leur refroidissement, et de déterminer l’arrangement atomique exact de la couche atomique supérieure de la surface de silicium. Les résultats aux Rayons X ont montré que, sur l’ultime couche atomique de la surface de silicium, les atomes étaient arrangés selon une symétrie d’ordre cinq. Les gouttelettes restaient liquides sur ces surfaces même lorsque l’on les refroidissait à une température inférieure de 100 °C à celle de leur point de fusion.
Une analyse plus détaillée de l’interface solide / liquide a révélé que ces structures de surface pentagonales étaient formées d’un couche unique d’atomes d’or fortement liés au cristal de silicium. Comme cela a été expliqué précédemment, on s’attend généralement à ce que les liquides aient une structure très proche de celle de la structure solide avec laquelle ils sont en contact, ce qui amène une germination hétérogène. Nos mesures ont montré qu’une telle ressemblance avec la structure de la surface existe effectivement, maiss qu’elle peut avoir l’effet opposé: une structure incompatible avec la formation d’un cristal en 3D peut forcer le liquide à adopter localement le ‘mauvais’ schéma ordonné. Au lieu de renforcer la germination hétérogène, cela augmente la stabilité de la phase surfusion du liquide (voir Figure 7).
Après 60 ans de recherche sur la surfusion des métaux, il s’agit finalement de la démonstration expérimentale de ce que la symétrie d’ordre cinq affecte la métastabilité d’un liquide (Schülli et al., 2010; Greer, 2010).
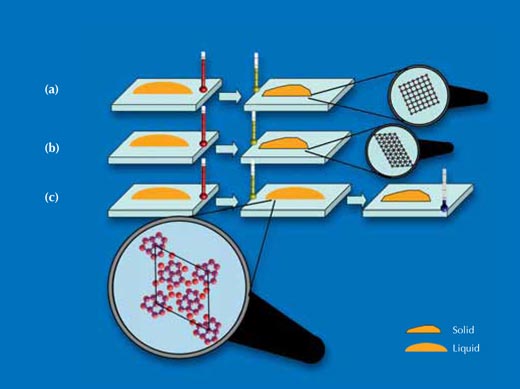
(a) Lorsque le cristal de silicium est coupé le long de ses faces cubiques, les atomes de silicium de la surface qui étaient au contact de la gouttelette étaient arrangés en treillis à mailles carrées. Sur une telle surface, les gouttelettes ont cristallisé à une température inférieure d’environ 60 K en dessous de leur température de fusion. Les résultats de mesures aux Rayons X ont montré que la gouttelette avait cristallisé selon une structure et une orientation similaires à celles du cristal de silicium sur lequel elle reposait.
(b) Lorsque le cristal de silicium est coupé selon la diagonal spatiale du cube, les atomes de silicium de la surface au contact de la gouttelette étaient arrangés en treillis triangulaire. Sur une telle surface, les gouttelettes ont cristallisé à une température inférieur d’environ 70 K en dessous de la température de fusion. Les résultats de mesures aux Rayons X ont montré que la gouttelette avait également cristallisé selon une structure et une orientation similaires à celles du cristal de silicium sur lequel elle reposait.
(c) Le cristal de silicium a alors été coupé comme dans le cas (b) mais a ensuite subi un traitement à haute température qui provoqua la formation d’un arrangement atomique pentagonal des atomes d’or liés à la surface de silicium. Sur cette surface, les gouttelettes restèrent en phase liquide métastable jusqu’à une température de 120 K inférieure à leur température de fusion – en surfusion accentuée.
Image reproduite avec l’aimable autorisation de Tobias Schülli
Expérience de surfusion
Mettre une bouteille d’eau distillée bouchée au congélateur pendant 1 à 2 heures. Après cela, l’eau doit être à environ -10 à -5 °C. Comme une telle eau ne doit contenir aucune impureté, elle devrait être encore liquide même à cette température – elle est en surfusion.
Retirer la bouteille du congélateur avec precaution, puis la cogner contre la table ou avec la main. Vous devez constater que l’eau cristallise (se congèle), la formation de la glace progressant très rapidement à travers le contenu de la bouteille. La cristallisation est accentuée par l’onde de choc qui se propage à travers le liquide. (L’onde de choc est une autre explication possible de la traînée de cristaux de glace que les avions laissent derrière eux).
Ceci ne peut être realisé qu’avec des liquides ne contenant pas de germes pouvant provoquer la cristallisation. Cela ne marchera probablement pas avec de l’eau du robinet, qui peut contenir des impuretés cristallines entraînant la cristallisation à une température proche de celle du point de fusion (ou de congélation) de l’eau.
Nota: ne pas laisser la bouteille dans le congélateur trop longtemps, car l’eau gélera une fois atteinte une température inférieure à -5 à -10 °C, même s’il n’y a pas d’impuretés cristallines.

References
- Fahrenheit DG (1724) Experimenta & observationes de congelatione aquæ in vacuo factæ. Philosophical Transactions 33: 78-84. doi: 10.1098/rstl.1724.0016
- Frank FC (1952) Supercooling of liquids. Proceedings of the Royal Society 215: 43-46. doi: 10.1098/rspa.1952.0194
- Greer AL (2010) Materials science: a cloak of liquidity. Nature 464: 1137-1138. doi: 10.1038/4641137a
- Téléchargement gratuit de l’article here, ou abonnement à Nature immédiat: www.nature.com/subscribe.
- Reichert H et al. (2000) Observation of five-fold local symmetry in liquid lead. Nature 408: 839-841. doi: 10.1038/35048537
- Téléchargement gratuit de l’article here, ou abonnement à Nature immédiat: www.nature.com/subscribe.
- Schülli TU et al. (2010) Substrate enhanced supercooling in AuSi eutectic droplets. Nature 464: 1174-1177. doi: 10.1038/nature08986
- Téléchargement gratuit de l’article here, ou abonnement à Nature immédiat: www.nature.com/subscribe.
- Turnbull D (1952) Kinetics of solidification of supercooled liquid mercury droplets. Journal of Chemical Physics 20: 411-424. doi: 10.1063/1.1700435
Web References
- w1 – Le CEA est le Commissariat français de l’Energie Atomique et des Energies Alternatives. Pour en savoir plus, voir: www.cea.fr
- w2 – Le “European Synchrotron Radiation Facility (ESRF)” est un institut scientifique international de recherche avancée sur les photons. L’ESRF est membre de EIROforum, l’éditeur de Science in School. Pour en savoir plus, voir: www.esrf.eu
Resources
- Pour en savoir davantage sur les nuages, voir:
-
Ranero Celius K (2010) Clouds: puzzling pieces of climate. Science in School 17: 54-59. www.scienceinschool.org/2010/issue17/clouds
-
Institutions
Review
Le fait que, pour certaines substances, le point de fusion ne coïncide pas toujours avec le point de congélation représente l’un des phénomènes étranges de la nature. Dans le présent article, Tobias Schülli nous emmène dans le monde de la matière condensée; il introduit les différences entre les états de la matière et nous fournit une explication de cette anomalie apparente: la surfusion.
On peut utiliser l’article de diverses façons comme aide pédagogique. Les enseignants pourraient amener leurs élèves à lire l’article avant de lancer une discussion en classe, non seulement sur les modifications des états de la matière, mais aussi sur les méthodes modernes de recherche dans le domaine de la physique de la matière condensée. Pour s’assurer que les élèves aient bien compris le texte, l’enseignant pourrait leur poser des questions, par exemple sur les conditions de la croissance du cristal.
L’article pourrait également amener certains lecteurs à développer leurs propres matériels éducatifs sur le thème de la surfusion.
En outre, la simple expérience de classe décrite dans l’article pourrait montrer aux élèves qu’il n’y a pas que la température pour déterminer l’état de la matière.
Vangelis Koltsakis, Grèce





